7.18: Vinylhalogenide und Arylhalogenide
Nukleophile Substitution in den Arylhalogeniden
Wir werden uns die Struktur von Chlorbenzol genauer ansehen. Brombenzol und Iodbenzol sind genau gleich. Der einfachste Weg, die Struktur von Chlorbenzol zu zeichnen, ist:
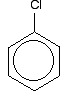
Um Chlorbenzol richtig zu verstehen, müssen Sie etwas tiefer graben. Es gibt eine Wechselwirkung zwischen den delokalisierten Elektronen im Benzolring und einem der einsamen Paare am Chloratom. Dies überschneidet sich mit dem delokalisierten Ringelektronensystem . . .
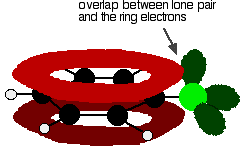
um eine Struktur wie diese zu geben:
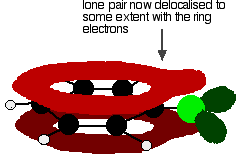
Diese Delokalisierung ist keineswegs vollständig, hat jedoch einen signifikanten Einfluss auf die Eigenschaften sowohl der Kohlenstoff-Chlor-Bindung als auch der Polarität des Moleküls. Die Delokalisierung führt zu einer zusätzlichen Bindung zwischen dem Kohlenstoff und dem Chlor, wodurch die Bindung stärker wird. Dies hat einen großen Einfluss auf die Reaktionen von Verbindungen wie Chlorbenzol.
Es gibt auch eine gewisse Bewegung von Elektronen weg vom Chlor in Richtung des Rings. Chlor ist ziemlich elektronegativ und zieht normalerweise Elektronen in der Kohlenstoff-Chlor-Bindung zu sich. In diesem Fall wird dies durch die Bewegung von Elektronen in Richtung des Rings bei der Delokalisierung etwas ausgeglichen. Das Molekül ist weniger polar, als Sie sonst erwartet hätten.
Einfache Arylhalogenide wie Chlorbenzol sind sehr resistent gegen nukleophile Substitution. Es ist möglich, das Chlor durch -OH zu ersetzen, jedoch nur unter sehr strengen industriellen Bedingungen – beispielsweise bei 200 ° C und 200 Atmosphären. Im Labor treten diese Reaktionen nicht auf. Dafür gibt es zwei Gründe – je nachdem, über welchen der oben genannten Mechanismen Sie sprechen.
- Die zusätzliche Stärke der Kohlenstoff-Halogen-Bindung in Arylhalogeniden: Die Kohlenstoff-Chlor-Bindung in Chlorbenzol ist stärker als erwartet. Es gibt eine Wechselwirkung zwischen einem der einsamen Paare am Chloratom und den delokalisierten Ringelektronen, und dies stärkt die Bindung. Beide oben genannten Mechanismen beinhalten das Brechen der Kohlenstoff-Halogen-Bindung zu einem bestimmten Zeitpunkt. Je schwieriger es ist zu brechen, desto langsamer wird die Reaktion sein.
- Abstoßung durch die Ringelektronen: Dies gilt nur, wenn das Hydroxidion das Chlorbenzol durch einen Mechanismus wie den ersten oben beschriebenen angreift. In diesem Mechanismus greift das Hydroxidion den leicht positiven Kohlenstoff an, an den das Halogenatom gebunden ist.Wenn das Halogenatom an einen Benzolring gebunden ist, wird das ankommende Hydroxidion mit den delokalisierten Ringelektronen oberhalb und unterhalb dieses Kohlenstoffatoms konfrontiert. Das negative Hydroxidion wird einfach abgestoßen. Dieser spezielle Mechanismus ist einfach ein Nichtstarter!