Ein besonderer Zucker: Wie sich Sialinsäure auf Stoffwechsel, Gesundheit und Krankheit auswirkt
Wir wimmeln von Mikroben, die auf Oberflächen außerhalb und innerhalb unseres Körpers leben. Insbesondere unser Verständnis des Darmmikrobioms verbessert sich rapide, da wir erkennen, wie komplexe mikrobielle Gemeinschaften mit unserer Ernährung, mit anderen Mikroben und mit unseren Zelloberflächen interagieren. Während viele Chemikalien in diesem Milieu wichtig sind, konzentrieren wir uns hier auf Sialinsäuren als eine kritische Gruppe von Molekülen, die viele dieser Wechselwirkungen und Auswirkungen auf Stoffwechsel, Gesundheit und Krankheit unterstützen.
Die häufigste Sialinsäure, N-Acetyl-Neuraminsäure (Neu5Ac) (Abb. 1) ist eine relativ einfache Zuckersäure, die, abgesehen von ihrer Ladung, nichts an sich Ungewöhnliches hat. Wenn Zellen jedoch andere Zellen kontaktieren, verwenden sie häufig Moleküle, die auf der Oberfläche angezeigt werden, und hier werden Sialinsäuren so wichtig, da sie normalerweise die terminalen Zucker auf den Wirtsglykanen sind, die Proteine und Lipide sind, die auf Zelloberflächen sitzen. Zelloberflächen- oder sekretierte Mucin-Glykoproteine sind gute Beispiele für mit Sialinsäure beschichtete Strukturen, auf die Mikroben an Schleimhautoberflächen wie den Atemwegen oder dem Magen-Darm-Trakt (GI) stoßen können. Diese einzigartige Position als ‚Meet and Greet‘-Molekül für andere menschliche Zellen, Bakterienzellen und Viren stellt die Sialinsäuren in den Mittelpunkt vieler wichtiger Prozesse.
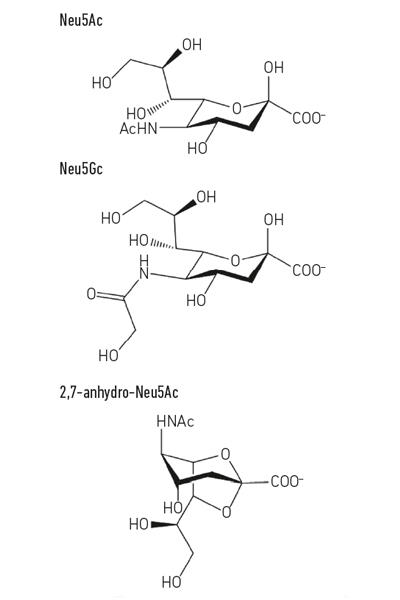
- Abb. 1. Beispiel für Sialinsäurederivate. Beachten Sie, dass die N-Glycolyl-Neuractinsäure (Neu5Gc) nicht vom Menschen hergestellt werden kann, ein biochemischer Unterschied, der uns von anderen Menschenaffen unterscheidet, sondern in unsere Zelloberflächen eingebaut werden kann, wenn sie aus der Nahrung aufgenommen wird.
- Zuckerüberzogene Krankheitserreger
- Kreuzfütterung – die Süßigkeiten teilen
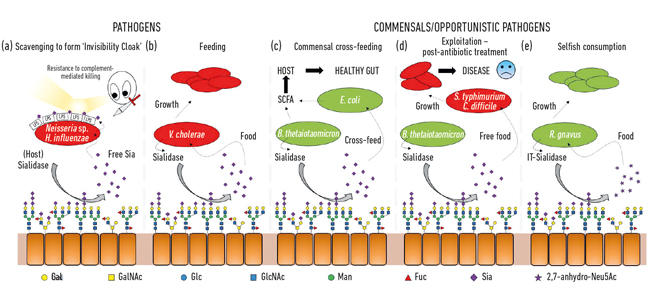
- Abb. 2. Cartoon-Illustration der verschiedenen Wechselwirkungen zwischen Bakterien und Sialinsäuren, die als terminale Zucker auf einer Reihe von Wirtsglykanen vorhanden sind. Diese werden von Sialidasen gespalten und in der Regel in freies Neu5Ac umgewandelt, mit Ausnahme der IT-Sialidase, die 2,7-Anhydro-Neu5Ac freisetzt. Freie Sialinsäure, die von Wirts- oder pathogenen Sialidasen freigesetzt wird, kann dann von Krankheitserregern als Unsichtbarkeitsmantel (a) oder zur Fütterung (b) verwendet werden. Kreuzfütterung kann zwischen Mitgliedern der Darmmikrobiota oder zwischen kommensalen und pathogenen Bakterien auftreten, die sich dieselbe Nische teilen (c, d), während andere Bakterien egoistische Mechanismen entwickelt haben, um Sialinsäure für ihren eigenen Verzehr zu reservieren (e).
- Halten Sie Ihre eigenen Süßigkeiten
- Viren machen mit
- Weiterführende Literatur
- Andrew Bell
- Emmanuele Severi
- Nathalie Juge
- Gavin H. Thomas
- Warum ist Mikrobiologie wichtig?
- Welchen Rat würden Sie jemandem geben, der in diesem Bereich anfängt?
Abb. 1. Beispiel für Sialinsäurederivate. Beachten Sie, dass die N-Glycolyl-Neuractinsäure (Neu5Gc) nicht vom Menschen hergestellt werden kann, ein biochemischer Unterschied, der uns von anderen Menschenaffen unterscheidet, sondern in unsere Zelloberflächen eingebaut werden kann, wenn sie aus der Nahrung aufgenommen wird.
Zuckerüberzogene Krankheitserreger
Eine der ersten mikrobiellen Funktionen von Sialinsäuren war mit der Fähigkeit einiger Krankheitserreger verbunden, sich beim Menschen anzusiedeln und dann Krankheiten zu verursachen. In der Tat war der Ex-Präsident der Mikrobiologischen Gesellschaft, Professor Harry Smith FRS, der an der Universität von Birmingham arbeitete, Pionier dieser Arbeit mit Neisseria gonorrhoea. Als Wissenschaftler in seiner Gruppe den Käfer direkt aus dem Körper isolierten, war er resistent gegen das Töten durch menschliches Serum (komplementvermitteltes Töten), aber wenn die Käfer einige Generationen im Labor kultiviert wurden, ging dieser Schutz verloren und die Zellen wurden durch das Serum getötet. Seine Gruppe hatte herausgefunden, dass diese Krankheitserreger dem Wirt Sialinsäure stehlen und damit ihre eigene Zelloberfläche beschichten, um sie zu humanisieren. Da sie diese Sialinsäure jedoch nur abfangen können, bedeutet ihre Abwesenheit in Wachstumsmedien, dass keine weitere Sialinsäure hinzugefügt wird, so dass sie diesen Serumschutz schnell verlieren und getötet werden. Es stellt sich heraus, dass eine Reihe anderer hinterhältiger Käfer ähnliche Strategien anwenden, um ihren eigenen Unsichtbarkeitsmantel mit Sialinsäure zu erzeugen, wie Neisseria meningitidis, Campylobacter jejuni oder Haemophilus influenzae (Abb. 2a)
Kreuzfütterung – die Süßigkeiten teilen
Sialinsäuren werden nicht nur von Krankheitserregern als Unsichtbarkeitsmantel verwendet, sondern sind auch eine ziemlich gute Nahrung für Bakterien, da sie sowohl Kohlenstoff als auch Stickstoff liefern und als Energiequelle verwendet werden können. Frühere Arbeiten zeigten, dass Krankheitserreger wie Vibrio cholerae glücklich waren, nur Sialinsäuren zu essen, und das an sich war wichtig für eine erfolgreiche Wirtsbesiedlung (Abb. 2b).
Im Darm kommt eine Hauptquelle von Sialinsäuren aus Mucinen, die die Hauptstrukturkomponenten der Schleimschicht sind, die die Epitheloberfläche bedeckt. Die am stärksten exponierte Schleimschicht ist der Lebensraum verschiedener Kommensalbakterien, die gelernt haben, sich an Mucinproteinen zu erfreuen, wo Zucker 80% ihrer Masse ausmacht. Aus einer einfachen topologischen Perspektive werden die Sialinsäuren als Endzucker zuerst geerntet, wodurch die darunter liegenden Zucker freigelegt werden, die anschließend auch freigesetzt und verzehrt werden können. Mit dem Aufkommen der Next-Generation-Sequenzierung haben wir Wissen über die Mikroben gewonnen, die in dieser Nische leben, und viele haben Gene für die Aufnahme von Sialinsäure und den anschließenden Katabolismus. Was aufregend war, war die Entdeckung, dass einige der kommensalen Anaerobier, wie Bacteroides thetaiotaomicron, sezernieren Sialidasen, um die Sialinsäure freizusetzen, aber es fehlen Transporter und katabole Gene, um sie tatsächlich zu nutzen. Diese scheinbar altruistische Geste ist erforderlich, damit die Bakterien auf den zugrunde liegenden Zucker zugreifen können, und untermauert einen Prozess der metabolischen Kreuzfütterung an andere Käfer, die in der Schleimnische leben, wie kommensale Escherichia coli-Stämme, die keine Sialidase haben, aber gut freie Sialinsäure essen können (Abb. 2c). Dieses Konzept wird heute als wichtiger Aspekt der Kolonisierung und Nischenanpassung anerkannt. Ein brillantes Beispiel dafür beschrieb die Gruppe von Justin Sonnenburg von der Stanford University anhand eines Mausmodells mit einer einfach definierten Darmmikrobiota. Nach der Antibiotikabehandlung wurden viele der Sialinsäure fressenden Bakterien ausgelöscht, was zur Ansammlung von freier Sialinsäure im Darm führte. Wenn sie dann mit Krankheitserregern wie Salmonella typhimurium oder Clostridium difficile in Kontakt kommen, würden diese Erreger von der freien Sialinsäure als Nährstoff profitieren (Abb. 2d). Mutierte Stämme von Krankheitserregern, denen die Transporter oder katabolen Gene fehlten, hatten keinen Vorteil und stellten eine direkte Verbindung zum Auswachsen von Krankheitserregern her, wenn die mikrobielle Gemeinschaft im Darm gestört ist. Mechanismen zur Verringerung des Pools an freier Sialinsäure im Darm wurden daher als Teil einer neuartigen antiinfektiösen Strategie vorgeschlagen.
Abb. 2. Cartoon-Illustration der verschiedenen Wechselwirkungen zwischen Bakterien und Sialinsäuren, die als terminale Zucker auf einer Reihe von Wirtsglykanen vorhanden sind. Diese werden von Sialidasen gespalten und in der Regel in freies Neu5Ac umgewandelt, mit Ausnahme der IT-Sialidase, die 2,7-Anhydro-Neu5Ac freisetzt. Freie Sialinsäure, die von Wirts- oder pathogenen Sialidasen freigesetzt wird, kann dann von Krankheitserregern als Unsichtbarkeitsmantel (a) oder zur Fütterung (b) verwendet werden. Kreuzfütterung kann zwischen Mitgliedern der Darmmikrobiota oder zwischen kommensalen und pathogenen Bakterien auftreten, die sich dieselbe Nische teilen (c, d), während andere Bakterien egoistische Mechanismen entwickelt haben, um Sialinsäure für ihren eigenen Verzehr zu reservieren (e).
Halten Sie Ihre eigenen Süßigkeiten
Während sich die frühe Sialomikrobiologie auf Krankheitserreger konzentrierte, konzentrierten sich neuere Arbeiten auf die Kommensalbakterien, die dieselbe Nische bewohnen. Die heutigen Studien auf dem Gebiet der Darmmikrobiota zeigen, wie heftig die Konkurrenz um Neu5Ac in unserem Darm ist und wie sie das Gleichgewicht zwischen Krankheitserregern und Kommensalen kippen kann. Was wäre, wenn ein bestimmtes Bakterium Sialinsäure in einer Form freisetzen könnte, auf die nur es zugreifen könnte? Arbeiten in der Juge-Gruppe in Norwich zeigten, dass sich der Darmsymbiont Ruminococcus gnavus dazu entwickelt hat, indem er eine spezielle Art von Sialidase namens intramolekulare Trans-Sialidase (IT-sialidase) verwendet, die 2,7-Anhydro-Neu5Ac freisetzt (siehe Abb. 1) statt Neu5Ac. Durch die Entwicklung einer Methode zur Synthese von reinem 2,7-Anhydro-Neu5Ac zeigten sie, dass R. gnavus-Stämme auf 2,7-Anhydro-Neu5Ac als einzige Kohlenstoffquelle wachsen konnten. Neben der Domäne, die die enzymatische Reaktion katalysiert, umfassen IT-Sialidasen eine Kohlenhydratbindungsdomäne, die hilft, die Bindung der IT-Sialidase an sialinsäurereiche Mucine zu vermitteln. In vivo kann dies einen Mechanismus begünstigen, der dazu beiträgt, die Bakterien auf sialinsäurereiche Regionen des Gastrointestinaltrakts auszurichten und so die bakterielle Besiedlung innerhalb der Schleimschicht zu fördern. Einmal an der richtigen Stelle lokalisiert, spaltet die IT-Sialidase Sialinsäure von den terminalen Ketten der Mucine ab und setzt sie in einer Form, 2,7-Anhydro-Neu5Ac, frei, die R. gnavus kann als eigene Nahrungsquelle verwendet werden, anstatt Neu5Ac mit anderen Bakterien zu teilen, die die Schleimnische bewohnen, einschließlich Krankheitserregern (Abb. 2e). Dieser Mechanismus bietet einen Wettbewerbsvorteil gegenüber anderen Sialinsäure fressenden Bakterien, die die Schleimnische bewohnen, indem er eine Nährstoffquelle bereitstellt, auf die er bevorzugt zugreifen kann. Darüber hinaus kann R. gnavus auch dazu beitragen, das Wachstum von magensaftresistenten Erregern zu reduzieren, indem es das Niveau von Neu5Ac in der Schleimhautumgebung reduziert und Wege für eine neuartige therapeutische Strategie in einem Zeitalter zunehmender Antibiotikaresistenz öffnet.
Viren machen mit
Viren verwenden auch Sialinsäuren als Schlüsselmoleküle während ihres Infektionszyklus, am bekanntesten Influenzavirus. Die anfängliche Anheftung ist der erste wichtige Schritt, da Sialinsäuren als Rezeptoren für das Virus auf respiratorischen Epithelzellen fungieren. Die Art der Verknüpfung der Sialinsäure mit den zugrundeliegenden Zuckern in den Glykanen steuert häufig den Wirtsbereich von Influenzaviren, und pandemische Stämme haben häufig Adhäsionsprotein (Hämagglutinin), das die menschenähnlichen Formen der Sialinsäureanhaftung erkennt und daher besonders virulent ist. Sialinsäure ist im letzten Stadium des viralen Lebenszyklus wichtig, da die Freisetzung aus der infizierten Zelle eine Spaltung von Sialinsäuren von der Oberfläche der Wirtszelle erfordert. Dies wird durch ein virales Enzym namens Sialidase (oder Neuraminidase) katalysiert. Die Hemmung dieses Enzyms durch strukturelle Analoga von Sialinsäure, formuliert in Tamiflu® (Oseltamivirphosphat) und Zanamivir, sind unsere Front-Line-Behandlung für Influenza und sind ein Triumph der Struktur / Funktion inspiriert Drug Design.
Zusammenfassend ist klar, dass Sialinsäuren kritische Moleküle in vielen Prozessen sind, in denen mikrobielle Zellen und Viren mit Säugetierzelloberflächen interagieren. In diesem kurzen Artikel haben wir einige davon angesprochen, um eine Vorstellung von den zentralen Funktionen dieser Zucker in Kommunikation, Tarnung, Besiedlung und Stoffwechsel in verschiedenen Aspekten von Gesundheit und Krankheit zu geben. Sialinsäuren wurden als die wichtigsten Chemikalien der Welt beschrieben und werden zweifellos weiterhin mehr über die Evolution des Menschen und sein Zusammenspiel mit seinen Mikroben verraten.
Weiterführende Literatur
Thomas, GH. Sialinsäureakquisition in Bakterien – ein Substrat, viele Transporter. Biochem Soc Trans 2016;44:760-765.
Ng KM, Ferreyra JA, Higginbottom SK, Lynch JB, Kashyap PC et al. Mikrobiota-befreite Wirtszucker erleichtern die postantibiotische Expansion von magensaftresistenten Erregern. Natur 2013;502:96-99.
Owen CD, Tailford LE, Monaco S, Šuligoj T, Vaux L et al. Entschlüsselung der Spezifität und des Mechanismus der Erkennung von Sialinsäure durch den Darmsymbionten Ruminococcus gnavus. Nat, 2017;8:2196.
Tailford LE, Owen CD, Walshaw J, Crost EH, Hardy-Goddard J, Le Gall G, de Vos WM, Taylor GL, Juge N. Entdeckung intramolekularer Trans-Sialidasen in der menschlichen Darmmikrobiota legt neue Mechanismen der Schleimhautanpassung nahe. Nat, 2015;6:7624.
Juge N, Tailford L, Owen CD. Sialidasen aus Darmbakterien: ein Mini-Review. Biochem Soc Trans 2016;44:166-175.

Andrew Bell
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, UK
Andrew Bell ist Doktorand in der Abteilung Darmmikroben und Gesundheit am Quadram Institute und untersucht die Auswirkungen eines neuartigen Mechanismus des Sialinsäurestoffwechsels auf die Darmhomöostase. Er erwarb seinen BSc in Biochemie an der University of East Anglia und arbeitete 2 Jahre am John Innes Centre on chlorophyll metabolism in pea (Pisum sativum), bevor er 2015 für seine Doktorarbeit in die Gruppe von Nathalie Juge am Quadram Institute eintrat.

Emmanuele Severi
Fachbereich Biologie, University of York, Wentworth Way, York YO10 5DD, UK
@emm_severi
Emmanuele Severi ist Postdoktorandin am Fachbereich Biologie der University of York und arbeitet im Labor von Prof. Gavin Thomas. Er hat zu verschiedenen Zeiten in seiner Karriere an Sialinsäuretransport und Stoffwechsel gearbeitet und ist seit 2002 Mitglied der Gesellschaft.

Nathalie Juge
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, UK
Nathalie Juge ist Forschungsleiterin am Quadram Institute Bioscience (QIB) in Norwich, stellvertretende Leiterin des strategischen Programms des Instituts für Darmmikroben und Gesundheit (GMH) und Honorarprofessorin an der School of Biological Sciences der University of East Anglia. Sie leitet eine Forschungsgruppe zur Glykobiologie von Wirt-Mikroben-Interaktionen im Darm mit Schwerpunkt auf Mucin-abgeleitetem Sialinsäure-Metabolismus durch die Darmmikrobiota (https://quadram.ac.uk/nathalie-juge).

Gavin H. Thomas
Department of Biology, University of York, Wentworth Way, York YO10 5DD, UK
@GavinHThomas
Gavin H. Thomas ist Professor für Mikrobiologie am Department of Biology der University of York und beschäftigt sich seit über einem Jahrzehnt mit bakteriellem Sialinsäuretransport und -katabolismus jahrzehnt. Er ist seit 1995 Mitglied der Gesellschaft, war Herausgeber von Microbiology Today (2003-2006), war im selben Zeitraum Mitglied des Rates, Mitglied des Kommunikationsausschusses (2012-2015) und des Gleichstellungsausschusses (2013-2015). & Diversity Committee (2013-2015). Er war Redakteur, Leitender Redakteur und ist jetzt stellvertretender Chefredakteur der führenden Zeitschrift der Gesellschaft Mikrobiologie (http://thomaslabyork.weebly.com).
Warum ist Mikrobiologie wichtig?
Gavin: Es ist wichtig für unsere Gesundheit – erst jetzt beginnen wir wirklich, die molekulare Zusammensetzung und Funktion unseres Mikrobioms zu verstehen, die sich wahrscheinlich auf vielfältige Weise auf unseren Körper auswirkt.
Welchen Rat würden Sie jemandem geben, der in diesem Bereich anfängt?
Gavin: Lesen Sie weiter und darüber hinaus ‚your bug‘ – Mikroben können so ziemlich alles und haben in der Regel mehrere verschiedene Möglichkeiten, es zu tun erfunden!
Bilder: H3N2-Influenzavirus-Partikel. CDC / Wissenschaft Foto-Bibliothek.
Abb. 1. Andrew Bell.
Abb. 2. Emmanuele Severi.