Grenzen in der kardiovaskulären Medizin
Einführung
Bei der Untersuchung von Koordinatensystemen, die für verschiedene biologische Einheiten verwendet werden könnten, sollten spezifische Merkmale berücksichtigt werden. Beispielsweise bilden Chromosomenzahl und Basenpaarposition ein lineares Koordinatensystem, das ausreicht, um die Position im Referenzgenom zu definieren (1). Ein Koordinatensystem für den gesamten menschlichen Körper, das den Anforderungen von HuBMAP, HCA, HPA und anderen Kartierungsbemühungen gerecht werden kann, ist jedoch aus mehreren Gründen weitaus komplexer (2-5). Erstens leben Zellen in drei Dimensionen; und zusätzliche Informationen werden benötigt, um die Größe und Rotationsausrichtung jeder Gewebeprobe zu beschreiben, die zur Erzeugung der Daten verwendet wird. Zweitens, während die Position des Basenpaares des Genoms nicht davon abhängt, wie die DNA gefaltet und in den Kern gepackt wird, sind die Positionen einzelner Elemente (z., Zellen, Organe) im Körper sind dynamisch, da sie sich mit Skelett- und Muskelbewegungen, Schwerkraft, Atmung, Herzschlag und anderen Funktionen und Kräften, die das Gewebe verzerren, ändern können. Drittens, obwohl die Variabilität der DNA zwischen Menschen <1% beträgt, erstreckt sich die menschliche Körpergeometrie über einen weiten Bereich von Höhen, Gewichten und Formen, die je nach Geschlecht und Rasse variieren und sich im Laufe der Lebensspanne einer Person erheblich verändern.
Eine Möglichkeit besteht darin, ein kartesisches 3D-Koordinatensystem zu verwenden, um die Position innerhalb des Körpers zu beschreiben. Kartesische Koordinatensysteme haben den Vorteil, dass sie vertraut und leicht verständlich sind. Wenn sich der Körper in der anatomischen Standardposition befindet, bilden links-rechts, kaudal-kranial und posterior-anterior drei senkrechte (x-y-z) Achsen. Für Analysen in kleinerem Maßstab kann die Zentrierung des Ursprungs auf eine anatomische Landmarke am nützlichsten und möglicherweise weniger variabel zwischen verschiedenen Personen sein. Zum Beispiel wäre es einfacher, den Abstand einer Gewebeprobe von der Niere zum oberen Pol der Niere als zur Oberseite des Kopfes einer Person zu messen. Der Nachteil kartesischer Koordinaten besteht darin, dass ihre Achsen nicht der natürlichen Form des Körpers folgen. Infolgedessen würde das Erstellen einer Referenzkörperkarte durch digitales „Zusammennähen“ von Gewebeproben, die von Personen unterschiedlicher Größe gesammelt wurden, einen komplexen Prozess des Verwerfens, Drehens und Ausrichtens der Daten erfordern. Dies auf eine Weise zu tun, die auf den gesamten Körper skaliert und gleichzeitig die Präzision auf zellulärer Ebene beibehält, wäre äußerst herausfordernd.
Andere 3D-Koordinatensysteme wurden für verschiedene Anwendungen entwickelt. Beispielsweise beschreiben Kugelkoordinaten mit Achsen, die Breitengrad, Längengrad und Höhe darstellen, bequem die Position auf der Erdoberfläche. Ein einfacher Pfad in sphärischen Koordinaten wie „1 km östlich“ ist mit kartesischen Koordinaten viel schwieriger zu kommunizieren. In ähnlicher Weise sollten Koordinatensysteme für den menschlichen Körper idealerweise Achsen aufweisen, die anatomischen Strukturen, genetischen Expressionsmustern, chemischen Gradienten und / oder anderen biologisch relevanten Pfaden folgen. Es wurden mehrere organspezifische Koordinatensysteme entwickelt, wie z. B. Talairach-Koordinaten für die funktionelle Bildgebung des Gehirns, die sich jedoch nicht auf den gesamten Körper erstrecken (6).
Vaskuläres Koordinatensystem
Im Jahr 2017 wurde ein gemeinsames Koordinatensystem (CCF) von den National Institutes of Health, dem Broad Institute, dem Sanger Institute und der Chan Zuckerberg Initiative organisiert. Die Teilnehmer des Treffens, zu denen Anatomen, Pathologen, Kliniker und Technologieexperten aus der ganzen Welt gehörten, schlugen verschiedene Ansätze zur Kartierung der Zellen des menschlichen Körpers vor, einschließlich anatomisch basierter Koordinatensysteme (7). Eine davon, die das Gefäßsystem nutzt, wurde auf einem CCF-Workshop 2019 speziell zur Lokalisierung von Nierenzellen weiter diskutiert (8). In diesem Manuskript geben wir einen konzeptionellen Überblick über dieses vaskuläre Koordinatensystem und beschreiben seine Vorteile und Einschränkungen (Abbildung 1).
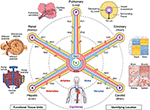
Abbildung 1. Die Hub-and-Spoke-Struktur eines vaskulären Koordinatensystems. Das vaskuläre Koordinatensystem besteht aus repräsentativen Gefäßschleifen, die in den Herzkammern beginnen und enden und sich bis zu den Funktionseinheiten jedes Organs erstrecken (gegen den Uhrzeigersinn von oben links: Alveolen, Glomeruli und Leberläppchen). Die „Adresse“ einer Zelle umfasst den Namen der Schleife (z. B. „R“ für Niere und „H“ für Leber) und die Verzweigungsebene des nächsten Gefäßes (z. B. „RA1“ für afferente Arteriolen in der Nierenschleife). Beachten Sie, dass die Wände des Herzens entlang der koronaren („C“) Gefäßschleife liegen und die Zellen einiger Strukturen innerhalb des Herzens tatsächlich an der Peripherie des Koordinatensystems in der Nähe der Kapillaren positioniert sind, die sie mit Blut versorgen. Es gibt mehrere Möglichkeiten, eine noch präzisere „GPS-ähnliche“ Position zu bestimmen, einschließlich des „Hypoxie-Fingerabdrucks“, der sich aus der Abnahme des Sauerstoffgehalts weiter vom Gefäß entfernt ergibt, des einzigartigen „histologischen Fingerabdrucks“ und „Genexpressionsfingerabdrucks“ in verschiedenen Arten von vaskulären Endothelzellen und des unverwechselbaren „vaskulären Architektur-Fingerabdrucks“, der in verschiedenen Gewebetypen gefunden wird. Das Gefäßsystem erstreckt sich auf alle Körperteile (unten) und umrahmt alle Organe in allen Maßstäben. Quelltextdateien: Bilder der Leberläppchen, Glomeruli, Alveolen, Genexpression Heatmap und Ganzkörpergefäße sind von Wikimedia Commons angepasst: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (Public Domain); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (CC BY 3.0 Lizenz); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (Public Domain); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (CC BY-SA 4.0 Lizenz); und https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (Gemeinfrei). Heatmap der Genexpression aus Guo et al. (9) mit simulierten Daten. Gefäßarchitektur basierend auf Bosetti et al. (10) (CC BY 4.0 Lizenz).
Das Ziel eines vaskulären Koordinatensystems besteht nicht darin, eine Karte des Gefäßsystems zu erstellen. Vielmehr geht es darum, bekannte Gefäßwege durch den Körper als Achse in einem Koordinatensystem zu verwenden, das die Position anatomischer Elemente, wie Zellen, im das Gefäßsystem umgebenden Gewebe beschreiben kann. In diesem vorgeschlagenen Rahmen können die Kammern des Herzens als Ursprung in der Ganzkörperkarte angesehen werden. Die Gefäßachse enthält Gefäßschleifen (vergleichbar mit „Straßen“ in der Google Map-Metapher), die sich durch die Aorta oder die Lungenarterie erstrecken, sich allmählich auf eine einzelne Zellgröße verjüngen, wenn sie sich jeder anderen Zelle in jedem Organ des Körpers nähern und zum Herzen zurückkehren. Entlang dieser Wege folgt das Gefäßsystem der einzigartigen Biologie der verschiedenen Organe und Gewebe; und ebenso könnten die Organe und Gewebe des Körpers nicht ohne die einzigartigen Eigenschaften ihres eng integrierten Gefäßsystems existieren.So wie die Genomkarte die DNA zu einer linearen Sequenz entfaltet, können wir uns vorstellen, die komplexen 3D-Drehungen und Wendungen der Gefäßachse in eine einfachere 2D- „Hub-and-Spoke“ -Form mit den Kammern des Herzens in der Mitte zu entfalten. Diese schematische Darstellung des Gefäßsystems erleichtert es, (1) den Ort im Körper zu beschreiben; (2) Gefäßwege mit unterschiedlichen 3D-Formen, aber gleichwertiger Funktion von verschiedenen Personen auszurichten; (3) Muster wie Veränderungen des Zelltyps und der Genexpression beim Übergang von größeren zu kleineren Gefäßen innerhalb eines Organs (entlang einer Speiche) zu identifizieren; und (4) Vergleichen Sie Gewebe auf derselben Ebene (z. B. Kapillaren) in verschiedenen Organen (über Speichen hinweg).
Ein Organ wie die Niere hat Zehntausende von Gefäßwegen, wenn jede Kapillare genau betrachtet wird. Um jedoch den Aufbau eines CCF machbar zu machen, werden wir eine zusätzliche vereinfachende Annahme machen, dass viele dieser Pfade nicht voneinander zu unterscheiden sind. Bemerkenswert ist, dass die kleinsten Gefäße (Kapillaren) im Zentrum der kleinen spezialisierten Funktionseinheiten in jedem Organ (z., Leberläppchen in der Leber, Glomeruli in der Niere und Alveolen in der Lunge). Ein ganzes Organ benötigt viele dieser gefäßzentrierten Funktionseinheiten, die anatomisch und physiologisch ähnlich sind (11). Diese Ähnlichkeit kann verwendet werden, um zahlreiche Gefäßwege in einige repräsentative zu zerlegen (Abbildung 2). Wenn wir in Zukunft mehr über die biomolekularen Profile dieser Signalwege erfahren, können wir den CCF verfeinern, indem wir die Signalwege in alle entdeckten Subtypen aufteilen.

Abbildung 2. Entfaltung des Nierengefäßweges bis zur Einzelzellebene. Ein repräsentativer Gefäßweg tritt durch die Nierenarterie in die Niere ein, passiert den Glomerulus und kehrt aus der Nierenvene zurück. Auf der Makroskala (links) und Mesoskala (Mitte) sind Beschriftungen in gelben Kästchen anatomische Strukturen, die verschiedenen Gefäßen entlang dieser Schleife entsprechen. Auf der Mikroskala (rechts) sind Etiketten in gelben Kästchen verschiedene Arten von Zellen, die sich in kurzer Entfernung von einem nahe gelegenen Gefäß im Glomerulus befinden. Die Position einzelner Zellen kann durch die Adresse des nächstgelegenen Schiffes (z., „RA0“ für Glomeruluskapillare), den Abstand in Mikrometern oder die Anzahl der Zellen vom Gefäßendothel und einen Winkel senkrecht zur Länge des Gefäßes (z. B. „RA0-10 µm-135°“ oder „RA0-1c-135°“). Ganz rechts wurde jedes Gefäß und sein umgebendes Gewebe aus dem Originalbild extrahiert und vertikal ausgerichtet, um leicht zu erkennen, wie sich Zelltypen und -verteilung entlang des Gefäßwegs ändern. In diesem Beispiel wurden die ausgerichteten Bilder ebenfalls gedreht, sodass die Mitte des Glomerulus immer rechts liegt. Quelltextdateien: Bilder der Niere und des Glomerulus stammen aus Wikimedia Commons: https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg (CC BY 3.0-Lizenz); und https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (CC BY-SA 4.0-Lizenz).
Eine „Adresse“ einer einzelnen Zelle in einem vaskulären Koordinatensystem hat vier Komponenten. (1) Das erste ist das nächstgelegene anatomisch benannte Gefäß, das eine Gefäßschleife (das Gefäßgebiet oder die „Wasserscheide“) wie die rechte Nierenarterie am genauesten identifiziert. (2) Die nächste Komponente stellt die Verzweigungsebene des Schiffes dar. In der Niere umfassen Beispiele von proximal nach distal die interlobären Arterien, kortikale Strahlenarterien, afferente Arteriolen und glomeruläre Kapillaren. Die Verzweigungsebene kann auch numerisch definiert werden, wobei Kapillaren auf der Nullebene und höhere Ebenen mit größeren Zahlen liegen. (3) Die dritte Komponente ist der senkrechte Abstand in Mikrometern oder die Anzahl der Zellen von der Endothelschicht des Gefäßes. (4) Eine optionale vierte Komponente könnte der Drehwinkel senkrecht zur Länge des Gefäßes sein. Null Grad können je nach Anwendung auf vielfältige Weise definiert werden. Zum Beispiel kann es relativ zu einem Marker auf der Gewebeprobe sein, oder es kann auf eine anatomische Struktur zeigen, wie das Zentrum des nächsten Glomerulus in der Niere. Der Nutzen und die Notwendigkeit dieser Komponenten müssten durch experimentelle Tests bestätigt werden.Ein anderer Ansatz besteht darin, Endothelzellen als „Verankerungszellen“ zu verwenden, um die relativen Positionen der anderen Zellen GPS-ähnlich zu identifizieren. Endothel Linien das gesamte Gefäßsystem. In verschiedenen Teilen des Gefäßsystems treten unterschiedliche Endothelzelltypen (EC) auf, die histologisch durch eindeutige Zelleigenschaften und benachbarte Zellen (den „histologischen Fingerabdruck“) sowie durch Analyse ihrer spezifischen Genprofile (den „Fingerabdruck der Genexpression“, Abbildung 1 Heatmap) nachgewiesen werden können (9, 12, 13). Vaskuläres Organisationsmuster, Verzweigungskomplexität, Durchmesser usw. stellen Sie zusätzliche erkennbare Merkmale bereit, die einen „vaskulären Architektur-Fingerabdruck“ für jedes Gewebe bilden (Abbildung 1 Falschfarben-Fluoreszenzgefäßbilder) (10, 14). Jedes Gewebe hat spezifische Sauerstoffgradienten, anhand derer die Entfernung zum Gefäß bestimmt werden kann. Wenn PO2 nicht direkt gemessen werden kann, kann man den Zellabstand aus den Induktions- / Expressionsgradienten von Hypoxie-induzierbaren Genen in verschiedenen Zelltypen ableiten (der „Hypoxie-Fingerabdruck“, Abbildung 1 Queransicht eines Gefäßes) (15-17).
Vorteile eines vaskulären CCF
Ein Gefäßkoordinatensystem ist biologisch sinnvoll. Jede lebende Zelle muss sich in einem kleinen Radius des nächstgelegenen Blutgefäßes befinden (100 µm bis 1 mm, abhängig vom Gewebe), um Sauerstoff aufzunehmen (18); und jedes Gefäß ist mit derselben durchgehenden Endothelschicht ausgekleidet (19). Somit bildet das Gefäßsystem einen ununterbrochenen Weg, der alle Teile des Körpers erreicht und sich nahtlos über Skalen von der Makroskala (Ganzkörper / klinisch) über die Mesoskala bis zur Mikroskala (einzelzellgroße Kapillargefäße) verjüngt. Als Teil davon behandelt es den allmählichen Übergang von großen Arterien und Venen, die bei den meisten Menschen konserviert sind, bis hin zu den Millionen von mikroskopisch kleinen Gefäßen, die nach Kategorie (z. B. Glomeruluskapillare), aber nicht nach individuellen Namen erkennbar sind. Das Gefäßsystem passt sich der individuellen Körpergröße und -form an und berücksichtigt interindividuelle Variationen (20, 21). Es definiert die Form von Funktionseinheiten in verschiedenen Organen wie Leberläppchen, Nierenglomeruli und Lungenalveolen. Die normale Entwicklung von neuem Gewebe beginnt mit der Gefäßbildung, bevor zusätzliche Zelltypen um es herum wachsen können (22).
Das Gefäßsystem erreicht auch alle Organe, Gewebe und Zellen auf zusammenhängende Weise. Andere anatomische Strukturen scheinen keine ähnliche Vielseitigkeit zu haben. Zum Beispiel erstreckt sich das Skelettsystem auf den gesamten Körper; der Abstand von einer Zelle innerhalb eines Organs zum nächsten Knochen kann jedoch mehrere Zentimeter betragen, und es ist unwahrscheinlich, dass dieser Knochen Teil des Organs und noch weniger wahrscheinlich Teil einer Gewebeprobe ist. Das Nervensystem folgt vielen der gleichen Wege wie größere Gefäße mit kontraktilen Eigenschaften, aber es ist nicht bekannt, ob sie sich erstrecken, um den kleineren Gefäßen zu folgen, die alle Gewebezellen erreichen. Im Gegensatz zur Abhängigkeit der Zellen von Sauerstoff gibt es also keine Garantie dafür, dass sich jede Zelle in unmittelbarer Nähe eines Nervs befindet. Organspezifische Referenzsysteme basieren auf einzigartigen strukturellen Merkmalen, die nur in diesem einzelnen Organ (z. B. bestimmten Regionen des Gehirns) vorhanden sind, und es ist unwahrscheinlich, dass sie für die Darstellung von Zellstandorten an anderer Stelle im Körper nützlich sind.
Es gibt viele praktische Vorteile eines vaskulären Koordinatensystems. Gefäßwege in allen Organen wurden ausführlich untersucht und in der Literatur ausführlich beschrieben. Sie sind nützlich, bekannt und haben standardisierte Namen in vielen Spezialgebieten. Gewebevaskularisationsmuster werden klinisch zur Diagnose von Krankheiten verwendet; und Gefäße werden in der Chirurgie und Biopsien als die wichtigsten anatomischen Landmarken verwendet und um „vaskuläre Territorien“ zu definieren (23, 24). Obwohl die genaue Position im kartesischen 3D-Raum für eine resezierte Gewebeprobe schwierig zu bestimmen sein kann, kann der Chirurg normalerweise angeben, welche vaskuläre Wasserscheide die Probe enthielt.
Einschränkungen eines vaskulären CCF
Nur die Kenntnis der Basenpaare in einer Genomsequenz liefert nicht genügend Informationen, um zu bestimmen, wie die DNA in einer bestimmten Zelle gefaltet ist. In ähnlicher Weise, obwohl das entfaltete vaskuläre Koordinatensystem die 3D-räumliche Beziehung von nahe gelegenen Zellen auf der Mikroskala beschreiben kann, gehen die gewundenen Pfade, die Gefäße nehmen, und der relative Abstand zwischen Zellen auf größeren Skalen verloren. Informationen über größere Strukturen könnten durch die Integration von klinischer Bildgebung und histologischer und molekularer Strukturierung erhalten werden.
Einige zusätzliche Positionsinformationen gehen durch kollabierende Gefäßwege verloren. Zum Beispiel könnte ein vaskuläres Koordinatensystem anfänglich alle Glomeruluskapillaren in der Niere als die gleiche Struktur behandeln und möglicherweise Unterschiede in Glomeruli an den oberen und unteren Nierenpolen maskieren. Wenn wir jedoch mehr über die biomolekularen Profile dieser Signalwege erfahren, können wir den vaskulären CCF im Laufe der Zeit iterativ verfeinern, indem wir die Signalwege in alle entdeckten Subtypen aufteilen.Trotz dieser Einschränkungen behält ein vaskuläres Koordinatensystem genügend Positionsinformationen bei, um viele Arten von Forschungsfragen zu beantworten, indem es Forschern ermöglicht, einzelne Zellen innerhalb von Funktionseinheiten, Geweben und Organen genau zu lokalisieren oder die Auswirkungen des Kontexts auf verschiedene Zelltypen im gesamten Körper auf der Makro- und Meso- Skala zu vergleichen.
Nächste Schritte und zukünftige Richtungen
In Abbildung 1 stellen wir eine stark vereinfachte und stilisierte Darstellung des vaskulären CCF vor, um das allgemeine Konzept vorzustellen. Die eigentlichen Gefäßwege sind weitaus komplexer, wobei der vollständige vaskuläre CCF schließlich aus Hunderten oder Tausenden von Strukturen sowie Verzweigungsmustern besteht, die keinem strengen Hub-and-Spoke-Layout folgen. Zum Beispiel würden die Venen im Leberportalsystem, die Blut von mehreren Organen zur Leber transportieren, und Kreislaufanastomosen, wie der Willis-Kreis im Gehirn, senkrecht zu den „Speichen“ in Abbildung 1 verlaufen und diese kreuzen.Der vaskuläre CCF muss auch normale anatomische Varianten des Gefäßsystems, wie die Thyroidea ima und die doppelten zystischen Arterien, auf die gleiche Weise einbeziehen, wie Einzelnukleotidpolymorphismen (SNPs) normale Variationen im Genom beschreiben. Wenn wir die Details des vaskulären CCF erweitern und ausfüllen, Es könnte ein Schneeflocken- oder webähnlicheres Aussehen annehmen, mit Wahrscheinlichkeiten, die verschiedenen Abschnitten zugewiesen sind, um die Wahrscheinlichkeit anzuzeigen, sie bei einer bestimmten Person zu finden.Der eigentliche vaskuläre CCF erfordert ein ausgefeilteres Codierungsschema für die Benennung von Gefäßen als in Abbildung 1 gezeigt, um seine Komplexität genauer darzustellen und durch Softwarealgorithmen „berechenbar“ zu machen. Ein Ansatz besteht darin, auf vorhandenen anatomischen Ontologien wie UBERON aufzubauen, die bereits eindeutige Uniform Resource Identifiers (URIs) für viele Gefäße enthalten und verschiedene Beziehungstypen wie „branching_part_of“ definieren, um zu beschreiben, wie sich Gefäße verbinden (25).
Eine Zelle kann sich in der Nähe von mehr als einem Gefäß befinden, in diesem Fall ist es möglich, jedem Gefäß eine separate Adresse zuzuweisen. Zukünftige Forschung ist erforderlich, um zu bestimmen, was der geeignete „Cutoff“ -Abstand sein sollte. Es kann wünschenswert sein, mehrere Adressen für Zellen zu speichern, um ihre Position im 3D-Raum zu triangulieren.Obwohl unsere anfängliche Motivation für ein vaskuläres CCF darin besteht, ein Koordinatensystem zur Angabe der Position von Zellen zu definieren, könnte die neuartige radiale Anordnung des menschlichen Körpers um das Gefäß herum, wie in Abbildung 1 dargestellt, andere wissenschaftliche Anwendungen haben. Zum Beispiel haben Positionsinformationen in diesem Rahmen Analogien zur embryologischen Entwicklung und könnten Einblicke in Mechanismen geben, die Krankheiten oder Dysregulationen verursachen, die von einer Gruppe von Zellen ausgehen. Beispielsweise sind im vaskulären CCF makrovaskuläre Erkrankungen, die mit Typ-2-Diabetes assoziiert sind (z. B. ischämische Herzkrankheit, periphere Gefäßerkrankung und zerebrovaskuläre Erkrankung), nahe dem Zentrum gruppiert, während die mikrovaskulären Erkrankungen (z. B. Retinopathie, Nephropathie und Neuropathie) einen Ring um die Außenseite bilden (26).
Zusammenfassung
Das Gefäßsystem hat mehrere Eigenschaften, die auf die Eigenschaften ansprechen, die zuvor als wünschenswert für einen CCF angesehen wurden, um die Kartierung aller Zellen im menschlichen Körper zu ermöglichen (7). (1) Es funktioniert über mehrere Skalen. Durch ein kontinuierliches Endothel macht es einen nahtlosen Übergang von großen anatomischen Strukturen bis auf die zelluläre Ebene. (2) Es gilt für alle Körpergewebe. Da sich Organe um Gefäße herum entwickeln, umrahmt das Gefäßsystem die Organarchitektur auf allen Ebenen. Gefäßmuster sind so unverwechselbar, dass Bilder von Gefäßen allein, mit allen anderen Zellen entfernt, kann leicht verwendet werden, um das Organ zu identifizieren. (3) Es berücksichtigt Spenderunterschiede. Die Vaskularisierung passt sich auf natürliche Weise den individuellen Veränderungen in Gewebe, Körpergröße und -form an. Anstatt die 3D-Koordinaten jedes Glomerulus in einer Person denen in einer anderen Person zuordnen zu müssen, würde der vaskuläre CCF jede Zelle innerhalb einer repräsentativen Glomeruluskapillare von jeder Person positionieren. (4) Das Gefäßsystem ist Praktikern vieler verschiedener klinischer Fachgebiete bekannt, hilft bei der Diagnose von Krankheiten und leitet Operationen und wird von Pathologen, Radiologen und anderen Klinikern als Orientierungspunkt verwendet. Dies würde die Positionierung von Gewebeproben im Körper und die Registrierung der Position einzelner Zellen erleichtern. Während kein einzelnes CCF für alle Anwendungsfälle ideal ist, definiert ein vaskuläres CCF ein natürliches Koordinatensystem, das es einfach macht, biomolekulare Daten von mehreren Personen zu kombinieren und biologisch relevante Forschungsfragen zu stellen.
Data Availability Statement
In dieser Studie wurden öffentlich zugängliche Datensätze analysiert. Diese Daten finden Sie hier: https://www.proteinatlas.org.
Autorenbeiträge
GW konzipierte diese Studie auf der Grundlage von Berichten des CCF-Meetings 2017 und des CCF-Workshops 2019. KB und YJ lieferten kritisches Feedback. GW schrieb den ersten Entwurf mit zusätzlichem Text, der von der CCFWS-01-Folienpräsentation transkribiert wurde. Alle Autoren trugen zur Bearbeitung des Manuskripts bei.
Finanzierung
Diese Forschung wurde vom National Institutes of Health (NIH) Award OT2OD026671 unterstützt. Diese Arbeit repräsentiert nicht die Meinung des NIH oder des National Heart, Lung, and Blood Institute (NHLBI).
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Dr. Zorina S. Galis von den National Institutes of Health für die Unterstützung bei der Entwicklung der Idee eines vaskulären Koordinatensystems auf dem CCF-Treffen 2017 und dem CCF-Workshop 2019, die Präsentationen dieser Veranstaltungen und die Teilnahme an zahlreichen Diskussionen, die die Grundlage dieses Manuskripts bildeten. Expertenkommentare der Gutachter halfen bei der Klärung und Detaillierung des vorgeschlagenen vaskulären gemeinsamen Koordinatensystems.
3. Hrsg. von Uhlén M, Björling E, Agaton C, Szigyarto CA, Amini B, Andersen E, et al. Ein menschlicher Proteinatlas für normales und Krebsgewebe basierend auf Antikörperproteomik. In: Mol Cell Proteomics. (2005) 4:1920–32. Ursprungsbezeichnung: 10.1074/mcp.M500279-MCP200
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
12. Vanlandewijck M, Er L, Mäe MA, Andrae J, Ando K, Del Gaudio F, et al. Ein molekularer Atlas der Zelltypen und Zonierung im Gehirngefäßsystem. Natur. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, Singer M. Überwachung der Gewebesauerstoffspannung der Organperfusion: Begründung, Methoden und Literaturübersicht. Br J Anaesth. (2015) 115:357–65. doi: 10.1093/bja/aev162
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
17. In: Koch CJ. Messung des absoluten Sauerstoffgehalts in Zellen und Geweben mit Sauerstoffsensoren und 2-Nitroimidazol EF5. Methoden Enzymol. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi E, Segars WP, Sturgeon GM, Roos JE, Ravin CE, Samei E. Modellierung der Lungenarchitektur in der XCAT-Reihe von Phantomen: physiologisch basierte Atemwege, Arterien und Venen. In: IEEE Trans Med Imaging. (2018) 37:693–702. Ursprungsbezeichnung: 10.1109/TMI.2017.2769640
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Anatomie der Leber: Eine Gliederung mit drei Komplexitätsstufen – ein weiterer Schritt zur maßgeschneiderten territorialen Leberresektion. J Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar