Refissa
Generischer Name: Tretinoin
Darreichungsform: Creme
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am 1. April 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professionell
- Wechselwirkungen
- Mehr
NUR ZUR TOPISCHEN ANWENDUNG IM GESICHT.
- Refissa Beschreibung
- Refissa – Klinische Pharmakologie
- Indikationen und Verwendung für Refissa
- DATEN aus KLINISCHEN STUDIEN
- Kontraindikationen
- Warnhinweise
- Vorsichtsmaßnahmen
- Allgemeines
- Informationen für Patienten
- Wechselwirkungen mit anderen Arzneimitteln
- Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
- Schwangerschaft
- Schwangerschaftskategorie C
- Stillende Mütter
- Pädiatrische Anwendung
- Geriatrische Anwendung
- Nebenwirkungen
- Überdosierung
- Refissa Dosierung und Anwendung
- Wie wird Refissa geliefert
- Lagerung
- PRINCIPAL DISPLAY PANEL – 40 g Tube Karton
- Mehr über Refissa (Tretinoin topisch)
- Verbraucher ressourcen
- Professionelle ressourcen
- Zugehörige Behandlungsleitfäden
Refissa Beschreibung
Refissa enthält den Wirkstoff Tretinoin (ein Retinoid) in einer weichmachenden Cremebasis. Tretinoin ist ein gelbes bis orangefarbenes kristallines Pulver mit einem charakteristischen Blütengeruch. Tretinoin ist löslich in Dimethylsulfoxid, leicht löslich in Polyethylenglykol 400, Octanol und 100% Ethanol. Es ist praktisch unlöslich in Wasser und Mineralöl, und es ist unlöslich in Glycerin. Der chemische Name für Tretinoin ist (all-E) -3,7-dimethyl-9-(2,6,6-trimethyl-1-cyclonexen-1-yl) -2,4,6,8-nonatetraensäure. Tretinoin wird auch als All-trans-Retinsäure bezeichnet und hat ein Molekulargewicht von 300,44. Die Strukturformel ist unten dargestellt.
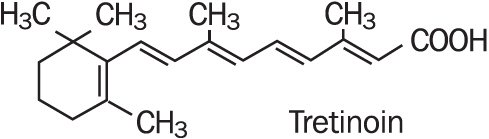
Refissa enthält Tretinoin in einer Konzentration von 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Klinische Pharmakologie
Der genaue Wirkungsmechanismus von Tretinoin ist unbekannt, obwohl angenommen wird, dass Retinoide eine Wirkung auf das Wachstum und die Differenzierung verschiedener Epithelzellen ausüben. Bei topischer Anwendung wurde jedoch kein Anstieg der Desmosin-, Hydroxyprolin- oder Elastin-mRNA in der menschlichen Haut festgestellt. Darüber hinaus ist die Rolle der irritativen Natur dieses Produkts bei der Wirkung der positiven Wirkungen, die diesem Produkt für seine Indikation zugeschrieben werden, noch nicht vollständig bestimmt.Die transdermale Resorption von Tretinoin aus verschiedenen topischen Formulierungen lag zwischen 1% und 31% der applizierten Dosis, je nachdem, ob es auf gesunde Haut oder dermatitische Haut aufgetragen wurde. Bei perkutaner Resorption von Tretinoincreme, USP (Emollient) 0,05% wurde bei gesunden männlichen Probanden (n = 14) nach einmaliger Anwendung sowie nach wiederholten täglichen Anwendungen über 28 Tage die Resorption von Tretinoin betrug weniger als 2% und die endogenen Konzentrationen von Tretinoin und seinen Hauptmetaboliten blieben unverändert.
Indikationen und Verwendung für Refissa
(Um die Indikation für dieses Produkt vollständig zu verstehen, lesen Sie bitte den gesamten Abschnitt INDIKATIONEN UND VERWENDUNG der Kennzeichnung.)
Refissa ist als Zusatzstoff (siehe zweiter Punkt unten) zur Anwendung bei der Milderung (Linderung) von feinen Falten, fleckiger Hyperpigmentierung und taktiler Rauheit der Gesichtshaut bei Patienten indiziert, die eine solche Linderung durch umfassende Hautpflege- und Sonnenvermeidungsprogramme nicht erreichen (siehe Punkt 3 für Populationen, bei denen die Wirksamkeit nicht nachgewiesen wurde). Refissa BESEITIGT KEINE FALTEN, REPARIERT SONNENGESCHÄDIGTE HAUT, KEHRT DIE LICHTALTERUNG UM oder STELLT EIN JUGENDLICHERES oder JÜNGERES DERMALES HISTOLOGISCHES MUSTER WIEDER HER. Viele Patienten erreichen gewünschte palliative Effekte auf feine Falten, fleckige Hyperpigmentierung und taktile Rauheit der Gesichtshaut mit der Verwendung von umfassenden Hautpflege- und Sonnenvermeidungsprogrammen, einschließlich Sonnenschutzmitteln, Schutzkleidung und erweichenden Cremes, die KEIN Tretinoin enthalten.
- Tretinoin-Creme, USP (Weichmacher) 0.05% hat keine MILDERNDE WIRKUNG auf signifikante Anzeichen chronischer Sonnenexposition wie grobe oder tiefe Faltenbildung, Hautvergilbung, Lentiginen, Teleangiektasien, Hautlaxheit, Keratinozytenatypie, Melanozytenatypie oder dermale Elastose gezeigt.
- Refissa sollte unter ärztlicher Aufsicht als Ergänzung zu einem umfassenden Hautpflege- und Sonnenvermeidungsprogramm angewendet werden, das die Verwendung wirksamer Sonnenschutzmittel (minimaler Lichtschutzfaktor von 15) und Schutzkleidung umfasst, wenn die gewünschten Ergebnisse bei feinen Falten, fleckiger Hyperpigmentierung und Rauheit der Gesichtshaut nicht mit einem umfassenden Hautpflege- und Sonnenvermeidungsprogramm allein erzielt wurden.
- Die Wirksamkeit von Refissa bei der Milderung feiner Falten, fleckiger Hyperpigmentierung und taktiler Rauheit der Gesichtshaut wurde bei Menschen über 50 Jahren ODER bei Menschen mit mäßig bis stark pigmentierter Haut nicht nachgewiesen. Darüber hinaus wurden Patienten mit sichtbaren aktinischen Keratosen und Patienten mit Hautkrebs in der Vorgeschichte von klinischen Studien mit Tretinoin-Creme, USP (Emollient) 0,05%, ausgeschlossen. Daher sind die Wirksamkeit und Sicherheit von Refissa in diesen Populationen derzeit nicht bekannt.
- Weder die Sicherheit noch die Wirksamkeit von Refissa zur Vorbeugung oder Behandlung von aktinischen Keratosen oder Hautneoplasmen wurde nachgewiesen.
- Weder die Sicherheit noch die Wirksamkeit der täglichen Anwendung von Refissa über einen Zeitraum von mehr als 48 Wochen wurde nachgewiesen, und die tägliche Anwendung über 48 Wochen hinaus wurde nicht systematisch und histologisch in angemessenen und gut kontrollierten Studien untersucht. (Siehe Abschnitt WARNUNGEN.)
DATEN aus KLINISCHEN STUDIEN
Es wurden zwei adäquate und gut kontrollierte Studien mit insgesamt 161 auswertbaren Patienten (unter 50 Jahren) durchgeführt, die mit Tretinoin-Creme, USP (Emollient) 0, 05% und 154 auswertbaren Patienten behandelt wurden, die 24 Wochen lang als Ergänzung zu einem umfassenden Hautpflege- und Sonnenvermeidungsprogramm mit derselben Emollient-Creme im Gesicht behandelt wurden, um die Auswirkungen auf feine Falten, fleckige Hyperpigmentierung und taktile rauheit der Haut. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | Reduktion von 2 Einheiten oder mehr |
In diesen Studien wurde angenommen, dass die feinen Falten, die fleckige Hyperpigmentierung und die taktile Rauheit der Gesichtshaut durch mehrere Faktoren verursacht wurden, darunter intrinsische Alterung oder Umweltfaktoren , wie chronische Sonnenexposition.
Die Ergebnisse dieser Bewertungen lauten wie folgt:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| Fahrzeug + CSP | 67% | 23% | 10% |
Der größte Teil der Verbesserung dieser Anzeichen wurde während der ersten 24 Wochen der Therapie festgestellt. Danach hielt die Therapie in erster Linie die in den ersten 24 Wochen erzielte Besserung aufrecht.Eine Mehrheit der Patienten verliert die meisten mildernden Wirkungen von Refissa auf feine Falten, fleckige Hyperpigmentierung und taktile Rauheit der Gesichtshaut mit Absetzen eines umfassenden Hautpflege- und Sonnenvermeidungsprogramms einschließlich Refissa; Die Sicherheit und Wirksamkeit der täglichen Anwendung von Refissa über einen Zeitraum von mehr als 48 Wochen wurde jedoch nicht nachgewiesen.
Kontraindikationen
Dieses Medikament ist bei Personen mit einer Vorgeschichte von Empfindlichkeitsreaktionen auf einen seiner Bestandteile kontraindiziert. Es sollte abgesetzt werden, wenn eine Überempfindlichkeit gegen einen seiner Bestandteile festgestellt wird.
Warnhinweise
- Refissa ist ein Hautreizmittel, und die Ergebnisse einer anhaltenden Reizung der Haut für mehr als 48 Wochen bei chronischer Langzeitanwendung sind nicht bekannt. Es gibt Hinweise auf atypische Veränderungen der Melanozyten und Keratinozyten sowie auf eine erhöhte dermale Elastose bei einigen Patienten, die länger als 48 Wochen mit Tretinoin-Creme, USP (Emollient) 0, 05%, behandelt wurden. Die Bedeutung dieser Befunde ist unbekannt.
- Sicherheit und Wirksamkeit von Refissa bei Personen mit mäßig oder stark pigmentierter Haut sind nicht erwiesen.
- Refissa sollte wegen der Möglichkeit einer erhöhten Phototoxizität nicht angewendet werden, wenn der Patient auch Arzneimittel einnimmt, von denen bekannt ist, dass sie Photosensibilisatoren sind (z. B. Thiazide, Tetracycline, Fluorchinolone, Phenothiazine, Sulfonamide).
Aufgrund der erhöhten Brennanfälligkeit sollte die Exposition gegenüber Sonnenlicht (einschließlich Sonnenlampen) während der Verwendung von Nachfüllungen vermieden oder minimiert werden. Die Patienten müssen gewarnt werden, bei der Anwendung von Refissa Sonnenschutzmittel (mindestens Lichtschutzfaktor 15) und Schutzkleidung zu verwenden. Patienten mit Sonnenbrand sollten angewiesen werden, Refissa nicht zu verwenden, bis sie sich vollständig erholt haben. Patienten, die z. B. berufsbedingt einer erheblichen Sonnenexposition ausgesetzt sein können, und Patienten mit einer inhärenten Empfindlichkeit gegenüber Sonnenlicht sollten bei der Anwendung von Refissa besondere Vorsicht walten lassen und sicherstellen, dass die in der Packungsbeilage beschriebenen Vorsichtsmaßnahmen eingehalten werden.
Tretinoin-Creme, USP (Emollient) 0,05% sollte von Augen, Mund, Nasenwinkeln und Schleimhäuten ferngehalten werden. Die topische Anwendung kann zu schweren lokalen Erythemen, Juckreiz, Brennen, Stechen und Abblättern an der Applikationsstelle führen. Wenn der Grad der lokalen Reizung dies rechtfertigt, sollten die Patienten angewiesen werden, weniger Medikamente zu verwenden, die Häufigkeit der Anwendung zu verringern, die Anwendung vorübergehend einzustellen oder die Anwendung vollständig einzustellen.
Es wurde berichtet, dass Tretinoin bei ekzematöser Haut schwere Reizungen verursacht und bei Patienten mit dieser Erkrankung nur mit Vorsicht angewendet werden sollte.Die Anwendung größerer Mengen an Medikamenten als empfohlen führt nicht zu schnelleren oder besseren Ergebnissen, und es können deutliche Rötungen, Peeling oder Beschwerden auftreten.
Vorsichtsmaßnahmen
Allgemeines
Refissa sollte nur als Ergänzung zu einem umfassenden Hautpflege- und Sonnenvermeidungsprogramm verwendet werden. (Siehe Abschnitt HINWEISE UND VERWENDUNG.)
Wenn sich eine Arzneimittelempfindlichkeit, eine chemische Reizung oder eine systemische Nebenwirkung entwickelt, sollte die Anwendung von Refissa abgebrochen werden.
Wetterextreme wie Wind oder Kälte können für Patienten, die Refissa anwenden, irritierender sein.
Informationen für Patienten
Siehe Packungsbeilage für Patienten.
Wechselwirkungen mit anderen Arzneimitteln
Begleitende topische Medikamente, medizinische oder abrasive Seifen, Shampoos, Reinigungsmittel, Kosmetika mit starker Trocknungswirkung, Produkte mit hohen Konzentrationen an Alkohol, Adstringenzien, Gewürzen oder Kalk, Dauerwellenlösungen, Elektrolyse, Haarenthaarungsmittel oder Wachse sowie Produkte, die die Haut reizen können, sollten bei Patienten, die mit Refissa behandelt werden, mit Vorsicht angewendet werden, da sie die Reizung mit Refissa verstärken können.
Refissa sollte nicht angewendet werden, wenn der Patient auch Arzneimittel einnimmt, von denen bekannt ist, dass sie Photosensibilisatoren sind (z., Thiazide, Tetracycline, Fluorchinolone, Phenothiazine, Sulfonamide) wegen der Möglichkeit einer erhöhten Phototoxizität.
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
In einer Lifetime-Hautstudie an CD-1-Mäusen mit dem 100- und 200-fachen der durchschnittlich empfohlenen topischen klinischen Humandosis wurden einige Hauttumoren bei weiblichen Mäusen und Lebertumoren bei männlichen Mäusen beobachtet. Die biologische Bedeutung dieser Befunde ist nicht klar, da sie bei Dosen auftraten, die die dermale maximal verträgliche Dosis (MTD) von Tretinoin überstiegen, und weil sie innerhalb der natürlichen Hintergrundrate für diese Tumoren in diesem Mäusestamm lagen. Es gab keine Hinweise auf ein kanzerogenes Potenzial, wenn Tretinoin topisch in einer Dosis verabreicht wurde, die das 5-fache der durchschnittlich empfohlenen topischen klinischen Humandosis betrug. Zum Zwecke des Vergleichs der Tierexposition mit der Humanexposition ist die „empfohlene topische klinische Dosis für den Menschen“ definiert als 500 mg Refissa täglich auf eine 50 kg schwere Person.
In einem chronischen, zweijährigen Bioassay von Vitamin-A-Säure bei Mäusen, durchgeführt von Tsubura und Yamamoto, wurde in allen Gruppen eine generalisierte Amyloidablagerung in der Basalschicht der mit Vitamin A behandelten Haut berichtet. Bei CD-1-Mäusen berichtete eine ähnliche Studie über eine Hyalinisierung der behandelten Hautstellen, und die Inzidenz dieses Befunds betrug 0/50, 3/50 und 2/50 bei männlichen Mäusen und 1/50, 0/50, 4/50 und 2/50 bei weiblichen Mäusen aus den Gruppen Vehikelkontrolle, 0,25 mg / kg, 0,5 mg / kg bzw. 1 mg / kg.Studien an haarlosen Albino-Mäusen legen nahe, dass Tretinoin das tumorigene Potenzial krebserregender Dosen von UVB- und UVA-Licht aus einem Sonnensimulator erhöhen kann. In anderen Studien, in denen leicht pigmentierte, haarlose Mäuse, die mit Tretinoin behandelt wurden, krebserzeugenden Dosen von UVB-Licht ausgesetzt waren, waren die Inzidenz und die Entwicklungsrate von Hauttumoren entweder verringert oder es wurde kein Effekt beobachtet. Aufgrund signifikant unterschiedlicher experimenteller Bedingungen ist derzeit kein strenger Vergleich dieser unterschiedlichen Daten möglich. Obwohl die Bedeutung dieser Studien beim Menschen nicht klar ist, sollten Patienten die Sonnenexposition minimieren.
Das mutagene Potenzial von Tretinoin wurde im Ames-Assay und im In-vivo-Maus-Mikronukleus-Assay bewertet, die beide negativ waren.
Studien des dermalen Segments I und III mit Tretinoin-Creme, USP (Emollient) 0,05% wurden bei keiner Spezies durchgeführt. In oralen Studien des Segments I und des Segments III an Ratten mit Tretinoin wurden ein vermindertes Überleben von Neugeborenen und eine Wachstumsverzögerung bei Dosen von mehr als 2 mg/kg / Tag beobachtet (>400-fache der durchschnittlichen topischen klinischen Dosis beim Menschen).
Schwangerschaft
Teratogene Wirkungen
Schwangerschaftskategorie C
Es wurde gezeigt, dass ORALES Tretinoin bei Ratten, Mäusen, Kaninchen, Hamstern und untermenschlichen Primaten teratogen ist. Es war bei Ratten teratogen und fetotoxisch, wenn es oral oder topisch in Dosen verabreicht wurde, die das 1000-fache der durchschnittlich empfohlenen topischen klinischen Dosis beim Menschen betrugen. Es wurden jedoch Variationen der teratogenen Dosen zwischen verschiedenen Rattenstämmen berichtet. Beim Cynomolgus-Affen, der metabolisch näher am Menschen für Tretinoin liegt als die anderen untersuchten Spezies, wurden fetale Missbildungen bei Dosen von 10 mg / kg / Tag oder mehr berichtet, aber keine wurden bei 5 mg / kg / Tag beobachtet (1000-fache der durchschnittlichen empfohlenen topischen klinischen Dosis beim Menschen), obwohl bei allen Dosen erhöhte Skelettvariationen beobachtet wurden. Es wurde über einen dosisabhängigen Anstieg der Embryoletalität und des Abbruchs berichtet. Ähnliche Ergebnisse wurden auch bei Pigtail-Makaken berichtet.
TOPISCHES Tretinoin in Teratogenitätstests an Tieren hat zu zweideutigen Ergebnissen geführt. Es gibt Hinweise auf Teratogenität (verkürzter oder geknickter Schwanz) von topischem Tretinoin bei Wistar-Ratten in Dosen von mehr als 1 mg / kg / Tag (das 200-fache der empfohlenen topischen klinischen Humandosis). Anomalien (Humerus: kurz 13%, gebogen 6%, os parietal unvollständig verknöchert 14%) wurden ebenfalls berichtet, wenn 10 mg / kg / Tag dermal appliziert wurden.Es gibt andere Berichte bei neuseeländischen weißen Kaninchen, die mit Dosen von etwa dem 80-fachen der empfohlenen topischen klinischen Humandosis verabreicht wurden, über eine erhöhte Inzidenz von gewölbtem Kopf und Hydrozephalie, typisch für Retinoid-induzierte fetale Missbildungen bei dieser Spezies.Im Gegensatz dazu haben mehrere gut kontrollierte Tierstudien gezeigt, dass dermal appliziertes Tretinoin in Dosen von 100 und 200 mal der empfohlenen topischen klinischen Humandosis bei Ratten bzw.
Bei weit verbreiteter Verwendung eines Arzneimittels wäre eine kleine Anzahl von Geburtsfehlerberichten, die zeitlich mit der Verabreichung des Arzneimittels verbunden sind, allein durch Zufall zu erwarten. Dreißig Fälle von zeitlich assoziierten angeborenen Fehlbildungen wurden während zwei Jahrzehnten klinischer Anwendung einer anderen Formulierung von topischem Tretinoin (Retin-A) berichtet. Obwohl aus diesen Fällen kein eindeutiges Teratogenitätsmuster und kein zufälliger Zusammenhang festgestellt wurde, beschreiben 5 der Berichte die seltene Geburtsfehlkategorie Holoprosencephalie (Defekte im Zusammenhang mit unvollständiger Mittellinienentwicklung des Vorderhirns). Die Bedeutung dieser Spontanberichte in Bezug auf das Risiko für den Fötus ist nicht bekannt.
Nicht teratogene Wirkungen
Es wurde gezeigt, dass dermales Tretinoin bei Kaninchen fetotoxisch ist, wenn es in Dosen verabreicht wird, die das 100-fache der empfohlenen topischen klinischen Humandosis betragen. Orales Tretinoin hat sich bei Ratten als fetotoxisch erwiesen, wenn es in Dosen verabreicht wurde, die dem 500-fachen der empfohlenen topischen klinischen Dosis beim Menschen entsprechen.
Es gibt jedoch keine adäquaten und gut kontrollierten Studien bei Schwangeren. Refissa sollte während der Schwangerschaft nicht angewendet werden.
Stillende Mütter
Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Da viele Arzneimittel in die Muttermilch übergehen, ist Vorsicht geboten, wenn Refissa einer stillenden Frau verabreicht wird.
Pädiatrische Anwendung
Sicherheit und Wirksamkeit bei Patienten unter 18 Jahren sind nicht belegt.
Geriatrische Anwendung
Sicherheit und Wirksamkeit bei Personen über 50 Jahren sind nicht belegt.
Nebenwirkungen
(Siehe Abschnitte WARNHINWEISE und VORSICHTSMAßNAHMEN.)
In doppelblinden, placebokontrollierten Studien mit 179 Patienten, die Tretinoin Cream, USP (Emollient) 0,05% auf ihr Gesicht auftraten, beschränkten sich Nebenwirkungen im Zusammenhang mit der Anwendung von Tretinoin Cream, USP (Emollient) 0,05% hauptsächlich auf die Haut. Während dieser Studien mussten 4% der Patienten die Anwendung von Tretinoin-Creme, USP (Emollient) 0, 05%, aufgrund von Nebenwirkungen abbrechen. Diese Abbrüche waren auf Hautreizungen oder damit verbundene kutane Nebenwirkungen zurückzuführen.
Lokale Reaktionen wie Peeling, trockene Haut, Brennen, Stechen, Erythem und Pruritus wurden von fast allen Probanden während der Therapie mit Tretinoin Cream, USP (Emollient) 0,05% berichtet. Diese Anzeichen und Symptome waren in der Regel von leichter bis mäßiger Schwere und traten im Allgemeinen zu Beginn der Therapie auf. Bei den meisten Patienten traten Trockenheit, Peeling und Rötung nach einer anfänglichen (24-wöchigen) Abnahme wieder auf.
Überdosierung
Es wurde nicht gezeigt, dass die Anwendung größerer Mengen von Medikamenten als empfohlen zu schnelleren oder besseren Ergebnissen führt, und es können deutliche Rötungen, Abblättern oder Beschwerden auftreten. Die orale Einnahme des Arzneimittels kann zu den gleichen Nebenwirkungen führen wie bei übermäßiger oraler Einnahme von Vitamin A.
Refissa Dosierung und Anwendung
- Verwenden Sie Refissa NICHT, wenn die Patientin schwanger ist oder versucht, schwanger zu werden oder ein hohes Schwangerschaftsrisiko hat
- Verwenden Sie Refissa NICHT, wenn die Patientin einen Sonnenbrand hat oder wenn die Patientin ein Ekzem oder andere chronische Hauterkrankungen hat
- Verwenden Sie Refissa NICHT, wenn die Patientin inhärent empfindlich auf Sonnenlicht reagiert
- Verwenden Sie Refissa NICHT, wenn die Patientin auch Arzneimittel einnimmt, von denen bekannt ist, dass sie Photosensibilisatoren (z. B. Thiazide, Tetracycline, Fluorchinolone, Phenothiazine, Sulfonamide) wegen der Möglichkeit einer erhöhten Phototoxizität.
Patienten benötigen detaillierte Anweisungen, um den maximalen Nutzen zu erzielen und alle Vorsichtsmaßnahmen zu verstehen, die erforderlich sind, um dieses Produkt mit größter Sicherheit zu verwenden. Der Arzt sollte die Packungsbeilage des Patienten überprüfen.
Refissa sollte einmal täglich vor dem Ruhestand auf das Gesicht aufgetragen werden, wobei nur so viel verwendet wird, dass der gesamte betroffene Bereich leicht bedeckt wird. Die Patienten sollten ihr Gesicht vorsichtig mit einer milden Seife waschen, die Haut trocken tupfen und 20 bis 30 Minuten warten, bevor sie Refissa auftragen. Der Patient sollte eine erbsengroße Menge Creme auftragen, um das gesamte Gesicht leicht zu bedecken. Beim Auftragen der Creme ist besondere Vorsicht geboten, um Augen, Ohren, Nasenlöcher und Mund zu meiden.
Die Anwendung von Refissa kann ein vorübergehendes Gefühl von Wärme oder leichtem Stechen verursachen.
Milderung (Palliation) von feinen Gesichtsfalten, fleckiger Hyperpigmentierung und taktiler Rauheit kann im Verlauf der Therapie allmählich auftreten. Bis zu sechs Monate Therapie können erforderlich sein, bevor die Auswirkungen sichtbar werden. Der größte Teil der mit Refissa festgestellten Verbesserung wird während der ersten 24 Wochen der Therapie beobachtet. Danach behält die Therapie in erster Linie die in den ersten 24 Wochen erzielte Besserung bei.
Bei Absetzen der Refissa-Therapie verliert die Mehrheit der Patienten die meisten mildernden Wirkungen von Refissa auf feine Falten, fleckige Hyperpigmentierung und taktile Rauheit der Gesichtshaut; Die Sicherheit und Wirksamkeit der täglichen Anwendung von Refissa über einen Zeitraum von mehr als 48 Wochen wurde jedoch nicht nachgewiesen.Die Anwendung größerer Mengen an Medikamenten als empfohlen führt möglicherweise nicht zu schnelleren oder besseren Ergebnissen, und es können deutliche Rötungen, Abblättern oder Beschwerden auftreten.
Patienten, die mit Refissa behandelt werden, können Kosmetika verwenden, aber die zu behandelnden Bereiche sollten gründlich gereinigt werden, bevor das Medikament angewendet wird. (Siehe Abschnitt VORSICHTSMAßNAHMEN.)
Wie wird Refissa geliefert
Refissa ist erhältlich in:
20 g Röhrchen NDC 42851-012-20
40 g Röhrchen NDC 42851-012-40
Lagerung
Bei 20-25°C (68-77°F) lagern. NICHT EINFRIEREN.
Nur Rx.
Gedruckt in den USA
140904-0118
Hergestellt von DPT Laboratories, San Antonio, TX 78215
Vertrieben von ZO Skin Health, Inc., Irvine, CA 92618
Refissa®
NUR ZUR TOPISCHEN ANWENDUNG IM GESICHT
Was sind die wichtigsten Informationen über Refissa ?
Refissa ist ein ernstes Medikament. Es beseitigt keine Falten oder repariert sonnengeschädigte Haut. Es kann helfen, feine Falten, fleckige Verfärbungen und raue Haut zu behandeln, aber es „heilt“ diese Zustände nicht. Refissa sollte nur unter Aufsicht Ihres Gesundheitsdienstleisters als Teil eines breiten Hautpflegeprogramms verwendet werden. Dieses Programm sollte die Vermeidung direkter Sonneneinstrahlung (durch Verwendung von Schutzkleidung und Sonnenschutzmitteln mit einem Lichtschutzfaktor von mindestens 15) und die Verwendung anderer feuchtigkeitsspendender Gesichtscremes, die kein Tretinoin enthalten, umfassen.
Sie sollten Refissa nur vor dem Schlafengehen verwenden. Verwenden Sie keine trocknenden Hautpflegeprodukte. Verwenden Sie die geringste Menge an Nachfüllen und vermeiden Sie es, es in Augen, Ohren, Nase oder Mund zu bekommen.WARNUNG: Verwenden Sie Refissa nicht, wenn Sie schwanger sind oder versuchen, schwanger zu werden. Vermeiden Sie Sonnenlicht und andere Arzneimittel, die Ihre Empfindlichkeit gegenüber Sonnenlicht erhöhen können (siehe unten).
Refissa wurde nicht bei Personen über 50 Jahren oder bei Personen mit mäßig oder dunkel pigmentierter Haut untersucht.
Was ist Refissa?
(Was kann ich von Refissa erwarten?)
Refissa ist ein ernstes Medikament, das helfen kann, feine Falten, fleckige Hautverfärbungen und raue Haut zu behandeln, aber nicht zu „heilen“.Studien zeigen, dass nach 24 Wochen etwa 30% der Menschen, die Tretinoin-Creme, USP (Emollient) 0,05% für feine Falten oder fleckige Verfärbungen verwendet hatten moderate Verbesserung, weitere 35% hatten minimale Verbesserung und 35% hatten keine Verbesserung. Etwa 16% der Menschen, die Tretinoin-Creme, USP (Emollient) 0,05% für raue Haut verwendet hatten moderate Verbesserung, 35% hatten minimale Verbesserung und 49% hatten keine Verbesserung. Es gibt keine Hinweise darauf, dass Refissa grobe Haut, tiefe Falten, Gelbfärbung der Haut oder andere Hautpflegeprobleme behandelt.
Refissa sollte als Teil eines breiten Hautpflegeprogramms verwendet werden. Dieses Programm sollte die Vermeidung direkter Sonneneinstrahlung (durch Verwendung von Schutzkleidung und Sonnenschutzmitteln mit einem Lichtschutzfaktor von mindestens 15) und die Verwendung anderer feuchtigkeitsspendender Gesichtscremes, die kein Tretinoin enthalten, umfassen. Viele Menschen können mit diesem Programm die gewünschten Effekte erzielen, ohne Refissa zu verwenden. Sie sollten Refissa nicht verwenden, bis Sie ein breites Hautbehandlungsprogramm ohne Refissa ausprobiert haben.
Wenn Sie Refissa verwenden, ist die Verbesserung von feinen Falten, fleckigen Hautverfärbungen und rauer Haut nicht sofort und tritt im Laufe der Zeit allmählich auf. Im Allgemeinen können Sie einige Effekte in 3 bis 4 Monaten bemerken. Die Effekte sind in der Regel am deutlichsten bei etwa 6 Monaten mit wenig zusätzliche Verbesserung nach dieser Zeit. Wenn Refissa gestoppt wird, nimmt die Verbesserung allmählich ab.
Die Sicherheit der täglichen Anwendung von Refissa über einen Zeitraum von mehr als 48 Wochen ist nicht erwiesen.
Wer sollte Refissa nicht verwenden?
Sie sollten Refissa nicht anwenden, wenn Sie einen Sonnenbrand haben oder sehr empfindlich auf die Sonne reagieren, wenn Sie ein Ekzem haben oder wenn Ihre Haut gereizt ist. Refissa kann zu erhöhten Hautreizungen und erhöhter Sonnenbrandanfälligkeit führen.Da Refissa Ihre Haut empfindlicher gegenüber Sonnenlicht machen kann, sollten Sie Ihren Arzt informieren, wenn Sie auch andere Arzneimittel anwenden, die die Empfindlichkeit gegenüber Sonnenlicht erhöhen, da Sie Refissa nicht zusammen mit diesen Arzneimitteln anwenden sollten. Dazu gehören unter anderem: Thiazide (zur Behandlung von Bluthochdruck), Tetracycline, Fluorchinolone oder Sulfonamide (zur Behandlung von Infektionen) und Phenothiazine (zur Behandlung schwerwiegender emotionaler Probleme). Wenn Sie verschreibungspflichtige Medikamente, nicht verschreibungspflichtige Medikamente oder Gesichtscremes einnehmen, wenden Sie sich an einen Arzt, um sicherzustellen, dass sie nicht mit Refissa interagieren.
Schwangerschaftswarnung: Die sichere Anwendung während der Schwangerschaft wurde nicht nachgewiesen. Es gibt Berichte über Geburtsfehler bei Labortieren und Menschen, denen Tretinoin oral verabreicht wurde. Sie sollten Refissa nicht anwenden, wenn Sie schwanger sind oder versuchen, schwanger zu werden.
Es ist nicht bekannt, ob Refissa über die Muttermilch an Säuglinge weitergegeben wird. Sichere Anwendung bei Kindern wurde nicht gezeigt.
Die Sicherheit und Wirksamkeit von Refissa für Menschen über 50 Jahre oder mit dunklerer Hautfärbung wurde nicht nachgewiesen.
Wie soll ich Refissa verwenden?
Sie sollten Refissa einmal täglich auf Ihr Gesicht auftragen, bevor Sie sich zurückziehen, und nur so viel verwenden, dass der gesamte betroffene Bereich leicht bedeckt ist. Waschen Sie Ihr Gesicht vorsichtig mit einer milden Seife, tupfen Sie die Haut trocken und warten Sie 20 bis 30 Minuten, bevor Sie Refissa auftragen. Tragen Sie eine erbsengroße Menge Creme auf, um Ihr gesamtes Gesicht zu bedecken. Sie können eine Wärme oder ein leichtes Stechen spüren, wenn Refissa zum ersten Mal angewendet wird.
Sie müssen beim Auftragen der Creme besonders vorsichtig sein, um Augen, Ohren, Nasenlöcher oder Mund zu vermeiden. Refissa kann zu starken Rötungen, Juckreiz, Brennen, Stechen und Abblättern führen, wenn es auf diese Bereiche aufgetragen wird.
Die Verwendung größerer als notwendiger Mengen von Refissa beschleunigt die Ergebnisse nicht und kann zu einer Überdosierung führen. Eine Überdosierung kann zu roter und schälender Haut sowie Schmerzen oder Beschwerden führen.
Nach dem Auftragen von Refissa können Sie Kosmetika verwenden. Reinigen Sie Ihr Gesicht gründlich, bevor Sie Refissa erneut auftragen.
Was sollte ich bei der Verwendung von Refissa vermeiden?
Refissa erhöht Ihre Empfindlichkeit gegenüber Sonnenlicht. Vermeiden Sie Sonnenlicht so weit wie möglich. Verwenden Sie Schutzkleidung und Sonnenschutzmittel mit einem Lichtschutzfaktor von mindestens 15. Sonnen Sie sich nicht und verwenden Sie keine Sonnenlampen. Wenn Sie empfindlich auf Sonnenlicht reagieren oder einen Job haben, bei dem Sie längere Zeit in der Sonne sein müssen, müssen Sie äußerste Vorsicht walten lassen.
Vermeiden Sie während der Anwendung von Refissa Produkte, die die Haut austrocknen oder reizen können. Vermeiden Sie beispielsweise Produkte, die auf die Haut aufgetragen werden und Alkohol, Gewürze oder Limetten enthalten. Vermeiden Sie auch Reinigungsmittel, Haarentfernung oder andere Produkte, die die Haut reizen können.
Was sind die möglichen Nebenwirkungen von Refissa?
Die häufigsten Nebenwirkungen sind Hautreaktionen. Juckreiz, Rötung und trockene Haut wurden berichtet. So haben brennen, stechen, und peeling haut. Diese sind meistens mild und treten am häufigsten zu Beginn der Behandlung auf.
Wie erhalte ich weitere Informationen?
Diese Packungsbeilage fasst die wichtigsten Informationen über Refissa zusammen. Wenn Sie weitere Informationen wünschen, sprechen Sie mit Ihrem Arzt oder einem anderen Gesundheitsdienstleister. Es gibt auch eine Broschüre für Angehörige der Gesundheitsberufe, die Ihr Apotheker Ihnen zur Verfügung stellen kann.
RUFEN SIE IHREN ARZT AN, UM ÄRZTLICHEN RAT ZU NEBENWIRKUNGEN ZU ERHALTEN. SIE KÖNNEN NEBENWIRKUNGEN BEI DER FDA UNTER 1-800-FDA-1088 MELDEN.
PRINCIPAL DISPLAY PANEL – 40 g Tube Karton
NDC 42851-012-40
117471-0118
Refissa ®
Tretinoin-Creme,
USP (Emollient) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
Mehr über Refissa (Tretinoin topisch)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Arzneimittelwechselwirkungen
- Preis & Gutscheine
- En Español
- Arzneimittelklasse: topische Aknemittel
Verbraucher ressourcen
- Patienten Informationen
- Refissa Topical (Erweiterte Lesen)
Professionelle ressourcen
- Verschreibung Informationen
- Tretinoin Gel Mikrosphäre (FDA)
Andere marken Retin-A, Renova, Atralin, Altreno,… +2 weitere
Zugehörige Behandlungsleitfäden
- Lichtalterung der Haut
Medizinischer Haftungsausschluss