19.11: Racemización
Los derivados bifenílicos ópticamente activos (Sección 13-5A) se racemizan si los dos anillos aromáticos en cualquier momento pasan a través de una configuración coplanar por rotación alrededor del enlace central. Esto puede ser provocado más o menos fácilmente por el calor, a menos que los sustituyentes orto de 2,2’sean muy grandes.
La forma en que los compuestos con átomos de carbono asimétricos se racemizan es más complicada. Una posibilidad sería que un carbono quiral tetraédrico unido a cuatro grupos se convirtiera en plano y aquiral sin romper ningún enlace. Los cálculos teóricos indican que este no es un proceso probable para el carbono tetravalente quiral, pero, como veremos, ocurre con carbono quiral y otros átomos quirales que están unidos a tres grupos:
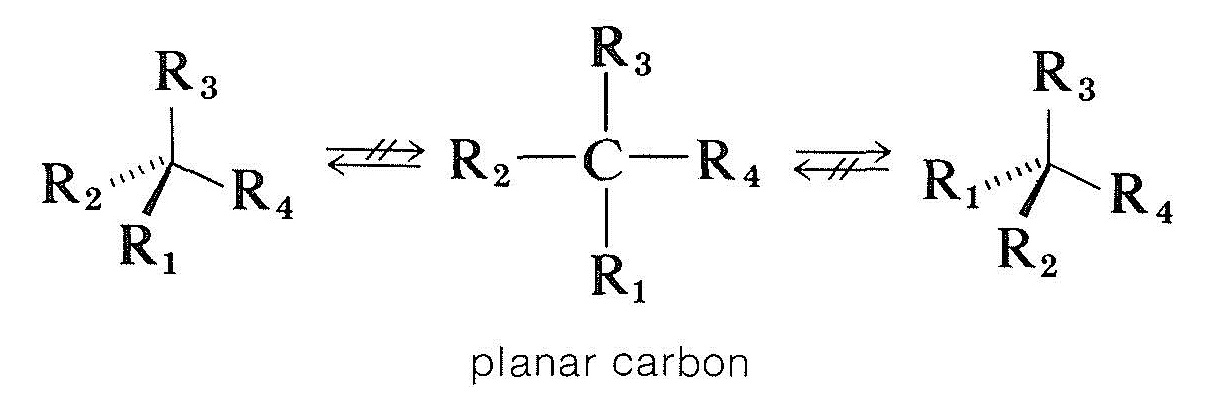
Compuestos carbonílicos ópticamente activos del tipo \(\ce{-CHC=O}\), en los que el carbono alfa es asimétrico, están racemizados por ácidos y bases, y de la sección 17-1 podemos estar seguros de que esto está relacionado con la enolización. La formación del enol o del anión enolato destruirá la asimetría del carbono \(\alfa\) de modo que, incluso si solo están presentes pequeñas cantidades de enol en un momento dado, eventualmente todo el compuesto se racemizará. Sin embargo, el mecanismo requiere que haya un hidrógeno \(\alfa\) y que el centro de simetría esté ubicado en este carbono \(\alfa\). De lo contrario, los ácidos y las bases son ineficaces para catalizar la racemización.
.jpg?revision=1)
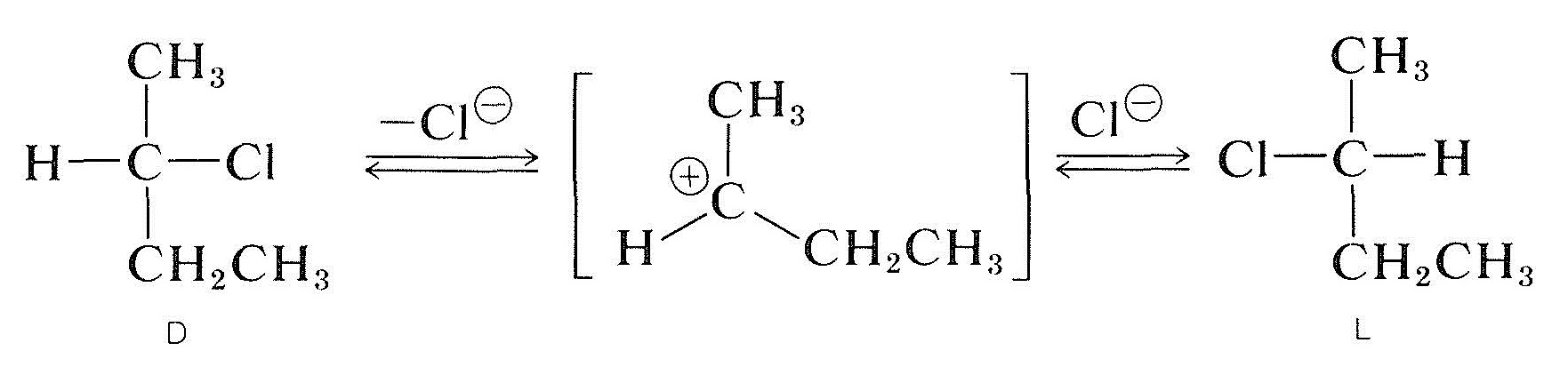
La racemización de un haluro secundario ópticamente activo con el carbono quiral que transporta el halógeno (p. ej., 2-clorobutano) puede ocurrir solución ih y, por lo general, cuanto más polar y mejor ionizante es el disolvente, más fácilmente se racemiza la sustancia. La ionización del haluro por un proceso \(S_\text{N}1\) probablemente es responsable, y esto ciertamente sería promovido por solventes polares (Sección 8-6). Todas las indicaciones son que un carbocatión alquilo una vez disociado de su anión acompañante es plano; y, cuando tal ion se recombina con el anión, tiene la misma probabilidad de formar los enantiómeros \(D\) y \(L\) :
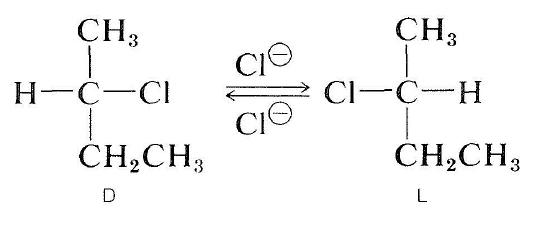
Los haluros ópticamente activos también se pueden racemizar mediante un mecanismo \(S_ \ text{N}2\). Una solución de 2-clorobutano activo en 2-propanona que contiene cloruro de litio disuelto se vuelve racémica. El desplazamiento del cloruro del haluro por iones cloruro invierte la configuración en el átomo sometido a sustitución (véase la sección 8-5). Una segunda sustitución regenera el enantiómero original. Eventualmente, este proceso de ida y vuelta produce números iguales de las formas \(D\) y \(L\); la sustancia entonces es racémica:
Los alcoholes asimétricos a menudo están racemizados por ácidos fuertes. Sin lugar a dudas, la ionización tiene lugar, y la recombinación de la carbocación con agua conduce a cualquiera de los enantiómeros:
.jpg?revision=1&size=bestfit&width=590&height=243)
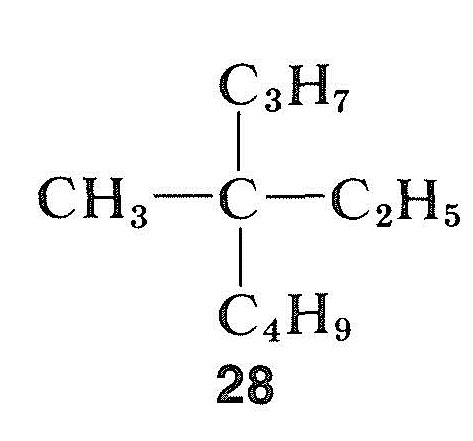
En contraste con los haluros, alcoholes y compuestos carbonílicos, los hidrocarburos pueden ser extremadamente difíciles de racemizar. Esto es particularmente cierto para un compuesto con un centro asimétrico cuaternario, como el metiletilpropilbutilmetano, \(28\), que no tiene «mango» para permitir convertir el carbono asimétrico a una condición simétrica por medios químicos simples:
Sin embargo, los hidrocarburos que tienen un átomo de hidrógeno en el carbono asimétrico pueden racemizarse si se pueden convertir en carbocaciones o por carbaniones. La facilidad de racemización de tipo carbanión dependerá de la acidez del hidrógeno unido y de la estabilidad estereoquímica del carbanión intermedio que se forma. Si la configuración del carbanión intermedio se invierte, el resultado será la racemización (véase también la sección 6-4E):
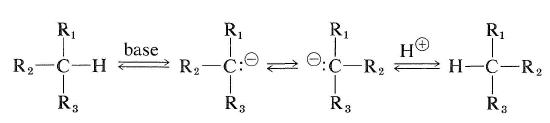
El tipo de racemización de carbocación de un hidrocarburo ópticamente activo puede ocurrir por la reacción de intercambio descrita en la Sección 10-9.
Colaboradores y atribuciones
- John D. Robert y Marjorie C. Caserio (1977) Principios Básicos de Química Orgánica, segunda edición. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Este contenido está protegido por derechos de autor bajo las siguientes condiciones: «Se le concede permiso para la reproducción, distribución, exhibición y ejecución individual, educativa, de investigación y no comercial de este trabajo en cualquier formato.»