7.18: Haluros de vinilo y Haluros de Arilo
Sustitución nucleofílica en los haluros de arilo
Veremos con cierto detalle la estructura del clorobenceno. El bromobenceno y el yodobenceno son lo mismo. La forma más sencilla de dibujar la estructura del clorobenceno es:
Para entender el clorobenceno correctamente, debe cava un poco más profundo que esto. Hay una interacción entre los electrones deslocalizados en el anillo de benceno y uno de los pares solitarios en el átomo de cloro. Esto se solapa con el sistema de electrones de anillo deslocalizado . . .
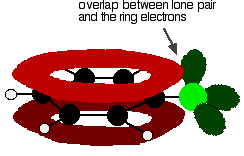
para dar una estructura más bien como este:
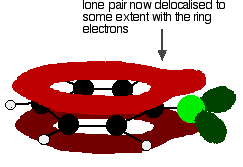
Esta deslocalización no es completo, pero tiene un efecto significativo sobre las propiedades del carbono-cloro bond y la polaridad de la molécula. La deslocalización introduce una unión adicional entre el carbono y el cloro, lo que hace que la unión sea más fuerte. Esto tiene un efecto importante en las reacciones de compuestos como el clorobenceno.
También hay un cierto movimiento de electrones desde el cloro hacia el anillo. El cloro es bastante electronegativo y generalmente atrae electrones en el enlace carbono-cloro hacia sí mismo. En este caso, esto se compensa en cierta medida por el movimiento de electrones hacia el anillo en la deslocalización. La molécula es menos polar de lo que hubiera esperado de otra manera.
Los haluros de arilo simples como el clorobenceno son muy resistentes a la sustitución nucleofílica. Es posible reemplazar el cloro por-OH, pero solo en condiciones industriales muy severas, por ejemplo a 200 ° C y 200 atmósferas. En el laboratorio, estas reacciones no ocurren. Hay dos razones para esto, dependiendo de cuál de los mecanismos anteriores esté hablando.
- La resistencia adicional del enlace carbono-halógeno en los haluros de arilo: El enlace carbono-cloro en el clorobenceno es más fuerte de lo que cabría esperar. Hay una interacción entre uno de los pares solitarios en el átomo de cloro y los electrones del anillo deslocalizado, y esto fortalece el enlace. Ambos mecanismos anteriores implican romper el enlace carbono-halógeno en algún momento. Cuanto más difícil sea romperse, más lenta será la reacción.
- Repulsión por los electrones del anillo: Esto solo se aplicará si el ion hidróxido atacó al clorobenceno por un mecanismo como el primero descrito anteriormente. En ese mecanismo, el ion hidróxido ataca el carbono ligeramente positivo al que está unido el átomo halógeno.Si el átomo halógeno está unido a un anillo de benceno, el ion hidróxido entrante se enfrentará con los electrones del anillo deslocalizado por encima y por debajo de ese átomo de carbono. El ion hidróxido negativo simplemente será repelido. ¡Ese mecanismo en particular es simplemente un mecanismo que no arranca!