El Solvente Universal
El Solvente Universal
Esta es, por supuesto, otra propiedad clave del agua porque más sustancias se disuelven en agua que cualquier otro líquido común. Esto se debe a que la molécula de agua polar aumenta el «Poder de Disolución». La «disolución implica romper «sales» en iones componentes.»Por ejemplo, el NaCl (sal común) se descompone en iones Na+ y Cl, debido a que la atracción de iones (átomos o grupos de átomos con una carga) a las moléculas de agua es alta.
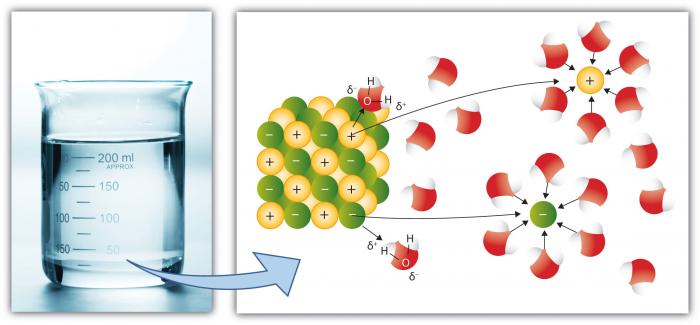
Los cationes, como el Na (Sodio) tienen una carga neta positiva, mientras que los aniones (como Cl, Cloruro) tienen una carga neta negativa. Hay muchos elementos y compuestos individuales que forman iones. Por lo tanto, el agua puede contener concentraciones considerables de varias especies químicas dependiendo de sus propiedades particulares. Observe cómo las moléculas de agua rodean a los iones individuales, manteniéndolos aislados de otros iones en solución. Esto ocurre hasta que se excede la capacidad del agua para aislar los iones, momento en el que la solución está «saturada» con esos iones y no puede disolverse más (la sal comenzará a precipitarse, formando un sólido).