Fronteras en Medicina Cardiovascular
Introducción
Al examinar sistemas de coordenadas que podrían usarse para diferentes entidades biológicas, se deben considerar características específicas. Por ejemplo, el número de cromosomas y la posición del par de bases forman un sistema de coordenadas lineales que es suficiente para definir la ubicación en el genoma de referencia (1). Sin embargo, un sistema de coordenadas para todo el cuerpo humano, que puede satisfacer las necesidades de HuBMAP, HCA, HPA y otros esfuerzos de mapeo, es mucho más complejo por varias razones (2-5). En primer lugar, las células viven en tres dimensiones; y se necesita información adicional para describir el tamaño y la orientación rotacional de cualquier muestra de tejido utilizada para generar los datos. En segundo lugar, mientras que la posición del par de bases genómicas no depende de cómo se pliega y empaqueta el ADN en el núcleo, las posiciones de los elementos individuales (p. ej. células, órganos) dentro del cuerpo son dinámicos, ya que pueden cambiar con los movimientos esqueléticos y musculares, la gravedad, la respiración, los latidos cardíacos y otras funciones y fuerzas que distorsionan el tejido. En tercer lugar, aunque la variabilidad del ADN entre las personas es <1%, la geometría del cuerpo humano abarca una amplia gama de alturas, pesos y formas, que varían según el sexo y la raza y cambian significativamente a lo largo de la vida de una persona.
Una opción es usar un sistema de coordenadas cartesianas 3D para describir la posición dentro del cuerpo. Los sistemas de coordenadas cartesianas tienen el beneficio de ser familiares y fáciles de entender. Con el cuerpo en posición anatómica estándar, de forma izquierda-derecha, caudal-craneal y posterior-anterior, tres ejes perpendiculares (x-y-z). Para análisis de menor escala, centrar el origen en un punto de referencia anatómico podría ser más útil y potencialmente menos variable entre diferentes personas. Por ejemplo, sería más fácil medir la distancia de una muestra de tejido desde el riñón hasta el polo superior del riñón que hasta la parte superior de la cabeza de una persona. La desventaja de las coordenadas cartesianas es que sus ejes no siguen la forma natural del cuerpo. Como resultado, la creación de un mapa corporal de referencia mediante la «unión» digital de muestras de tejido recolectadas de personas de diferentes tamaños requeriría un proceso complejo de deformación, rotación y alineación de los datos. Hacer esto de una manera que se escale a todo el cuerpo mientras se mantiene la precisión a nivel celular sería extremadamente difícil.
Se han desarrollado otros sistemas de coordenadas 3D para diferentes aplicaciones. Por ejemplo, las coordenadas esféricas, con ejes que representan latitud, longitud y elevación, describen convenientemente la ubicación en la superficie de la Tierra. Un camino simple en coordenadas esféricas, como «1 km al este», es mucho más difícil de comunicar usando coordenadas cartesianas. De manera similar, los sistemas de coordenadas para el cuerpo humano idealmente deben tener ejes que sigan estructuras anatómicas, patrones de expresión genética, gradientes químicos y/u otras vías biológicamente relevantes. Se han desarrollado varios sistemas de coordenadas de órganos específicos, como las coordenadas de Talairach para imágenes cerebrales funcionales, pero no se extienden a todo el cuerpo (6).
Sistema de Coordenadas Basado en Vasculares
En 2017, los Institutos Nacionales de Salud, el Instituto Broad, el Instituto Sanger y la Iniciativa Chan Zuckerberg organizaron una Reunión del Marco de Coordenadas Comunes (MCC). Los participantes de la reunión, que incluyeron anatomistas, patólogos, médicos clínicos y expertos en tecnología de todo el mundo, sugirieron varios enfoques para mapear las células del cuerpo humano, incluidos los sistemas de coordenadas anatómicos (7). Uno de ellos, que utiliza la vasculatura, se discutió más a fondo en un taller de CCF de 2019, específicamente para localizar células renales (8). En este manuscrito, presentamos una visión general conceptual de este sistema de coordenadas basado en vasculares y describimos sus beneficios y limitaciones (Figura 1).
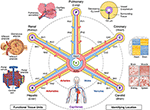
la Figura 1. La estructura de radio y eje de un sistema de coordenadas vasculares. El sistema de coordenadas vasculares consiste en bucles representativos de vasos que comienzan y terminan en las cámaras del corazón y se extienden a las unidades funcionales de cada órgano (en sentido antihorario desde la parte superior izquierda: alvéolos, glomérulos y lóbulos hepáticos). La » dirección «de una célula incluye el nombre del asa (por ejemplo,» R «para renal y» H «para hepática) y el nivel de ramificación del vaso más cercano (por ejemplo,» RA1 » para arteriolas aferentes en el asa renal). Tenga en cuenta que las paredes del corazón se encuentran a lo largo del bucle vascular coronario («C»), y las células de algunas estructuras internas del corazón están en realidad ubicadas en la periferia del sistema de coordenadas, cerca de los capilares que les proporcionan sangre. Hay múltiples maneras de identificar una posición «similar a un GPS» aún más precisa, incluyendo, yendo en el sentido de las agujas del reloj desde la parte superior derecha, la «huella dactilar de hipoxia» que resulta de la disminución de los niveles de oxígeno más lejos del vaso, la «huella dactilar histológica» única y la «huella dactilar de expresión génica» en diferentes tipos de células endoteliales vasculares, y la distintiva «huella dactilar de arquitectura vascular» que se encuentra en diferentes tipos de tejido. La vasculatura se extiende a todas las partes del cuerpo (parte inferior) y enmarca todos los órganos a todas las escalas. Archivos de Origen: Las imágenes de lóbulos hepáticos, glomérulos, alvéolos, mapa de calor de expresión génica y vasculatura de cuerpo entero están adaptadas de Wikimedia Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (Dominio público); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (licencia CC BY 3.0); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (Dominio público); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (licencia CC BY-SA 4.0); y, https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (Dominio público). Mapa de calor de expresión génica recreado a partir de Guo et al. (9) uso de datos simulados. Arquitectura vascular basada en Bosetti et al. (10) (licencia CC BY 4.0).
El objetivo de un vasculares del sistema de coordenadas no es la de construir un mapa de la vasculatura. Más bien, la idea es usar vías vasculares conocidas a través del cuerpo como un eje en un sistema de coordenadas que pueda describir la posición de elementos anatómicos, como las células, en el tejido que rodea la vasculatura. En este marco propuesto, las cámaras del corazón pueden verse como el origen en el mapa de todo el cuerpo. El eje vascular contiene bucles vasculares (comparables a los» caminos » en la metáfora del mapa de Google) que se extienden a través de la aorta o arteria pulmonar, se van reduciendo gradualmente al tamaño de una sola célula a medida que se acercan a todas las demás células de todos los órganos del cuerpo y regresan al corazón. A lo largo de estas vías, la vasculatura sigue la biología única de los diversos órganos y tejidos; y, del mismo modo, los órganos y tejidos del cuerpo no podrían existir sin las propiedades únicas de su vasculatura estrechamente integrada.
Al igual que el mapa del genoma despliega el ADN en una secuencia lineal, podemos imaginar el despliegue de los complejos giros y vueltas en 3D del eje de la vasculatura en una forma 2D más simple de «eje y radio» con las cámaras del corazón en el centro. Esta representación esquemática de la vasculatura facilita (1) describir la ubicación en el cuerpo; (2) alinear las vías vasculares con formas 3D variables pero con funciones equivalentes de diferentes personas; (3)identificar patrones como cambios en el tipo de célula y la expresión génica a medida que uno transita de vasos más grandes a vasos más pequeños dentro de un órgano (a lo largo de un radio); y, (4) comparar tejidos al mismo nivel (por ejemplo, capilares) en diferentes órganos (a través de radios).
Un órgano, como el riñón, tiene decenas de miles de vasculatura vías de si todos los capilares se considera claramente. Sin embargo, para que la construcción de un marco de cooperación con el país sea viable, asumiremos de manera simplificada que muchas de estas vías son indistinguibles entre sí. En particular, los vasos más pequeños (capilares) están en el centro de las pequeñas unidades funcionales especializadas en cada órgano (p.ej., lóbulos hepáticos en el hígado, glomérulos en el riñón y alvéolos en el pulmón). Un órgano completo requiere muchas de estas unidades funcionales centradas en los vasculares que son anatómica y fisiológicamente similares (11). Esta similitud puede utilizarse para colapsar numerosas vías vasculares en unas pocas representativas (Figura 2). En el futuro, a medida que aprendamos más sobre los perfiles biomoleculares de estas vías, podemos refinar el CCF dividiendo las vías en cualquier subtipo que se descubra.

la Figura 2. Desplegando la vía vascular renal hasta el nivel de una sola célula. Una vía vascular representativa ingresa al riñón a través de la arteria renal, pasa a través del glomérulo y regresa por la vena renal. En la macroescala (izquierda) y la mesoescala (centro), las etiquetas en cajas amarillas son estructuras anatómicas que corresponden a diferentes vasos a lo largo de este bucle. En la microescala (derecha), las etiquetas en cajas amarillas son diferentes tipos de células que se encuentran a poca distancia de un vaso cercano en el glomérulo. La posición de las celdas individuales se puede describir por la dirección del recipiente más cercano (p. ej., «RA0» para glomérulos capilares), la distancia en micrómetros o número de células del endotelio del vaso y un ángulo perpendicular a la longitud del vaso (por ejemplo, «RA0-10 µm-135°» o «RA0-1c-135°»). En el extremo derecho, cada vaso y su tejido circundante se han extraído de la imagen original y se han alineado verticalmente para que sea fácil ver cómo cambian los tipos de células y la distribución a lo largo de la vía vascular. En este ejemplo, las imágenes alineadas también se han girado para que el centro del glomérulo esté siempre a la derecha. Archivos de Origen: Las imágenes del riñón y el glomérulo están adaptadas de Wikimedia Commons: https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg(licencia CC BY 3.0); y, https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (licencia CC BY-SA 4.0).
Una «dirección» de una celda individual en un vasculares del sistema de coordenadas tiene cuatro componentes. (1) El primero es el vaso con nombre anatómico más cercano que identifica con mayor precisión un bucle vascular (el territorio vascular o «cuenca hidrográfica»), como la arteria renal derecha. (2) El siguiente componente representa el nivel de ramificación del recipiente. En el riñón, los ejemplos de proximal a distal incluyen las arterias interlobares, las arterias corticales radiadas, las arteriolas aferentes y los capilares glomerulares. El nivel de ramificación también se puede definir numéricamente, con capilares en el nivel cero, y niveles más altos con números más grandes. (3) El tercer componente es la distancia perpendicular en micrómetros o número de células de la capa endotelial del vaso. (4) Un cuarto componente opcional podría ser el ángulo de rotación perpendicular a la longitud del recipiente. Los grados cero se pueden definir de muchas maneras dependiendo de la aplicación. Por ejemplo, puede ser relativo a un marcador en la muestra de tejido, o puede apuntar hacia una estructura anatómica, como el centro del glomérulo más cercano en el riñón. La utilidad y la necesidad de estos componentes tendrían que confirmarse mediante pruebas experimentales.
Otro enfoque es el uso de células endoteliales como «células de anclaje» para identificar las posiciones relativas de las otras células de una manera similar al GPS. El endotelio recubre toda la vasculatura. Aparecen distintos tipos de células endoteliales (CE) en diferentes partes de la vasculatura, que se pueden detectar histológicamente a través de características celulares únicas y células vecinas (la «huella dactilar histológica»), así como a través del análisis de sus perfiles genéticos específicos (la «huella dactilar de expresión génica», Figura 1 mapa de calor) (9, 12, 13). Patrón organizativo vascular, complejidad de ramificación, diámetro, etc. proporcionar características reconocibles adicionales que forman una «huella dactilar de arquitectura vascular» para cada tejido (Figura 1 imágenes de vasculatura fluorescente de color falso) (10, 14). Cada tejido tiene gradientes de oxígeno específicos, que se pueden usar para determinar la distancia del vaso. Cuando la PO2 no se puede medir directamente, se puede inferir la distancia celular a partir de los gradientes de inducción/expresión de genes inducibles por hipoxia en varios tipos de células (la «huella dactilar de hipoxia», Figura 1 vista transversal de un vaso) (15-17).
Beneficios de un FCC vascular
Un sistema de coordenadas de vasculatura tiene sentido biológicamente. Cada célula viva debe estar dentro de un radio pequeño del vaso sanguíneo más cercano (100 µm a 1 mm, dependiendo del tejido) para recibir oxígeno (18); y, cada recipiente está revestido por la misma capa continua de endotelio (19). Por lo tanto, la vasculatura forma una vía ininterrumpida que llega a todas las partes del cuerpo, disminuyendo a la perfección a través de las escalas, desde la macroescala (cuerpo entero/clínica) hasta la mesoescala y la microescala (vasos capilares del tamaño de una sola célula). Como parte de esto, maneja la transición gradual de grandes arterias y venas, que se conservan en la mayoría de las personas, a los millones de vasos microscópicos que son reconocibles por categoría (por ejemplo, glomérulo capilar), pero no por nombres individuales. El sistema vascular se adapta al tamaño y la forma del cuerpo individual, teniendo en cuenta las variaciones interindividuales (20, 21). Define la forma de unidades funcionales en diferentes órganos, como lóbulos hepáticos, glomérulos renales y alvéolos pulmonares. El desarrollo normal de tejido nuevo comienza con la formación de vasos antes de que puedan crecer tipos celulares adicionales a su alrededor (22).
El sistema vascular también llega a todos los órganos, tejidos y células de forma contigua. Otras estructuras anatómicas no parecen tener una versatilidad similar. Por ejemplo, el sistema esquelético se extiende a todo el cuerpo; sin embargo, la distancia de una célula dentro de un órgano al hueso más cercano puede ser de varios centímetros, y es poco probable que ese hueso sea parte del órgano, e incluso menos probable que sea parte de una muestra de tejido. El sistema nervioso sigue muchas de las mismas vías que los vasos más grandes investidos de propiedades contráctiles, pero no se sabe si se extienden para seguir a los vasos más pequeños que llegan a todas las células tisulares. Por lo tanto, a diferencia de la dependencia de oxígeno de las células, no hay garantía de que cada célula esté cerca de un nervio. Los sistemas de referencia de órganos específicos se basan en características estructurales únicas que existen solo en ese órgano individual (por ejemplo, regiones específicas del cerebro) y es poco probable que sean útiles para representar ubicaciones celulares en otras partes del cuerpo.
Hay muchos beneficios prácticos de un sistema de coordenadas vasculares. Las vías vasculares en todos los órganos se han estudiado ampliamente y se describen en detalle en la literatura. Son útiles, conocidos y tienen nombres estandarizados en muchos dominios especializados. Los patrones de vascularización de tejidos se utilizan clínicamente para diagnosticar la enfermedad; y, los vasos se utilizan en cirugía y biopsias como los principales puntos de referencia anatómicos y para definir «territorios vasculares» (23, 24). Aunque la posición exacta en el espacio cartesiano 3D puede ser difícil de determinar para una muestra de tejido resecada, el cirujano generalmente podrá indicar qué cuenca vascular incluyó la muestra.
Limitaciones de un FCC vascular
Solo conocer los pares de bases en una secuencia genómica no proporciona suficiente información para determinar cómo se pliega el ADN en una célula en particular. De manera similar, aunque el sistema de coordenadas vasculares desplegadas puede describir la relación espacial en 3D de las células cercanas a la microescala, se pierden las trayectorias sinuosas que toman los vasos y la distancia relativa entre las células a escalas más grandes. Se podría obtener información sobre estructuras a mayor escala integrando imágenes clínicas y patrones histológicos y moleculares.
Se pierde alguna información posicional adicional al colapsar las vías vasculares. Por ejemplo, un sistema de coordenadas vasculares podría tratar inicialmente todos los capilares de los glomérulos en el riñón como la misma estructura, lo que podría enmascarar las diferencias en los glomérulos en los polos renal superior e inferior. Sin embargo, a medida que aprendemos más sobre los perfiles biomoleculares de estas vías, podemos refinar iterativamente el FCC vascular con el tiempo dividiendo las vías en cualquier subtipo que se descubra.
A pesar de estas limitaciones, un sistema de coordenadas vasculares retiene suficiente información posicional para responder a muchos tipos de preguntas de investigación, al permitir a los investigadores localizar con precisión células individuales dentro de unidades funcionales, tejidos y órganos, o comparar los efectos del contexto en varios tipos de células en todo el cuerpo en las escalas macro y mesoescala.
Próximos pasos y Direcciones Futuras
En la Figura 1 presentamos una representación altamente simplificada y estilizada del FCC vascular para introducir el concepto general. Las vías vasculares reales son mucho más complejas, con el CCF vascular completo que finalmente consta de cientos o miles de estructuras, así como patrones de ramificación que no siguen un diseño estricto de eje y radio. Por ejemplo, las venas del sistema portal hepático, que transportan sangre de múltiples órganos al hígado, y las anastomosis circulatorias, como el círculo de Willis en el cerebro, correrían perpendiculares y cruzarían los «radios» de la Figura 1.
El FCC vascular también necesitará incorporar variantes anatómicas normales de la vasculatura, como la tiroides ima y las arterias quísticas dobles, de la misma manera que los polimorfismos de un solo nucleótido (SNP) describen variaciones normales en el genoma. A medida que ampliamos y completamos los detalles del CCF vascular, podría tomar un aspecto más parecido a un copo de nieve o una tela, con probabilidades asignadas a diferentes secciones para indicar la probabilidad de encontrarlos en una persona determinada.
El FCC vascular real requerirá un esquema de codificación más sofisticado para nombrar los vasos que el que se muestra en la Figura 1, con el fin de representar su complejidad con mayor precisión y hacerla «computable» por algoritmos de software. Un enfoque es basarse en ontologías anatómicas existentes, como UBERON, que ya contiene Identificadores Uniformes únicos de Recursos (URI) para muchos vasos y define varios tipos de relaciones ,como «ramificación», para describir cómo se conectan los vasos (25).
Una celda puede estar cerca de más de un recipiente, en cuyo caso es posible asignarle una dirección separada relativa a cada recipiente. Se necesitan investigaciones futuras para determinar cuál debe ser la distancia de «corte» adecuada. Podría ser deseable almacenar varias direcciones para las celdas para ayudar a triangular su posición en el espacio 3D.
Aunque nuestra motivación inicial para un FCC vascular es definir un sistema de coordenadas para especificar la ubicación de las células, el nuevo diseño radial del cuerpo humano alrededor del vascular, como se muestra en la Figura 1, podría tener otras aplicaciones científicas. Por ejemplo, la información posicional dentro de este marco tiene analogías con el desarrollo embriológico y podría proporcionar información sobre los mecanismos que causan enfermedades o desregulaciones que surgen de un grupo de células. Por ejemplo, en el FCC vascular, las enfermedades macrovasculares asociadas con la diabetes tipo 2 (por ejemplo, cardiopatía isquémica, enfermedad vascular periférica y enfermedad cerebrovascular) se agrupan cerca del centro, mientras que las enfermedades microvasculares (por ejemplo, retinopatía, nefropatía y neuropatía) forman un anillo alrededor del exterior (26).
Resumen
El sistema vascular tiene varias propiedades que responden a las características que antes se consideraban deseables para un CCF para permitir el mapeo de todas las células del cuerpo humano (7). (1) Funciona a través de varias escalas. A través de un endotelio continuo, hace una transición sin fisuras desde grandes estructuras anatómicas hasta el nivel celular. (2) Es aplicable a todos los tejidos corporales. Debido a que los órganos se desarrollan alrededor de los vasos, la vasculatura enmarca la arquitectura de los órganos en todas las escalas. Los patrones vasculares son tan distintivos que las imágenes de los vasos por sí solos, con todas las demás células eliminadas, se pueden usar fácilmente para identificar el órgano. (3) Tiene en cuenta las diferencias entre donantes. La vascularización se adapta naturalmente a las variaciones individuales de tejido, tamaño corporal y forma. En lugar de tener que mapear las coordenadas 3D de cada glomérulo en una persona con las de otra persona, el FCC vascular colocaría cada célula dentro de un glomérulo capilar representativo de cada persona. (4) La vasculatura es bien conocida por los profesionales de muchas especialidades clínicas diferentes, ayudando tanto a diagnosticar enfermedades como a guiar cirugías, y utilizada como punto de referencia por patólogos, radiólogos y otros médicos. Esto facilitaría el posicionamiento de las muestras de tejido en el cuerpo y el registro de la ubicación de las células individuales. Si bien ningún FCC es ideal para todos los casos de uso, un FCC vascular define un sistema de coordenadas natural que facilitaría la combinación de datos biomoleculares de varias personas y la formulación de preguntas de investigación biológicamente relevantes.
Declaración de disponibilidad de datos
En este estudio se analizaron conjuntos de datos disponibles públicamente. Estos datos se pueden encontrar aquí: https://www.proteinatlas.org.
Contribuciones de los autores
GW concibió este estudio a partir de los informes de la Reunión del Marco de Cooperación de 2017 y del Taller del Marco de Cooperación de 2019. KB e YJ proporcionaron comentarios críticos. GW escribió el borrador inicial, con texto adicional transcrito de la presentación de diapositivas CCFWS-01. Todos los autores contribuyeron a la edición del manuscrito.
Financiación
Esta investigación fue apoyada por el premio OT2OD026671 de los Institutos Nacionales de Salud (NIH). Este trabajo no representa la opinión de la NIH o el National Heart, Lung, and blood Institute (NHLBI).
Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un conflicto de intereses potencial.
Agradecimientos
Agradecemos a la Dra. Zorina S. Galis de los Institutos Nacionales de la Salud por ayudar a desarrollar la idea de un sistema de coordenadas basado en vasculares en la Reunión del CCF de 2017 y el Taller del CCF de 2019, proporcionándonos presentaciones de estos eventos y participando en numerosas discusiones que formaron la base de este manuscrito. Los comentarios de los expertos por parte de los revisores ayudaron a aclarar y detallar el sistema de coordenadas comunes basado en vasculares propuesto.
3. Uhlén M, Björling E, Agaton C, Szigyarto CA, Amini B, Andersen E, et al. Atlas de proteínas humanas para tejidos normales y cancerosos basado en proteómica de anticuerpos. Proteómica de Células Mol. (2005) 4:1920–32. doi: 10.1074 / mcp.M500279-MCP200
PubMed Abstract | CrossRef Texto Completo | Google Scholar
12. Vanlandewijck M, He L, Mäe MA, Andrae J, Ando K, Del Gaudio F, et al. Atlas molecular de tipos celulares y zonificación en la vasculatura cerebral. Naturaleza. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, Singer M. Monitorización de tensión de oxígeno tisular de la perfusión de órganos: justificación, metodologías y revisión de la literatura. Hermano Anaesth. (2015) 115:357–65. doi: 10.1093/bja/aev162
PubMed Abstract | CrossRef Texto Completo | Google Scholar
17. Koch CJ. Medición de los niveles absolutos de oxígeno en células y tejidos mediante sensores de oxígeno y 2-nitroimidazol EF5. Métodos Enzymol. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi E, Segars WP, Sturgeon GM, Roos JE, Ravin CE, Samei E. Modelado de la arquitectura pulmonar en la serie XCAT de fantasmas: vías respiratorias, arterias y venas de base fisiológica. Imágenes Médicas Trans. (2018) 37:693–702. doi: 10.1109 / TMI.2017.2769640
PubMed Abstract | CrossRef Texto Completo | Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Anatomía del hígado: un esquema con tres niveles de complejidad, un paso más hacia resecciones territoriales de hígado a medida. J Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar