Refissa
Nombre genérico: tretinoína
Forma de dosificación: crema
Revisado médicamente por Drugs.com. Última actualización: 1 de abril de 2020.
- Visión general
- Efectos Secundarios
- Dosis
- Profesional
- Interacciones
- Más
PARA USO TÓPICO EN LA CARA.
- Refissa Descripción
- Refissa-Farmacología clínica
- Indicaciones y uso de Refissa
- DATOS DE ENSAYOS CLÍNICOS
- Contraindicaciones
- Advertencias
- Precauciones
- General
- Información para Pacientes
- Interacciones medicamentosas
- Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
- Embarazo
- La tretinoína ORAL de categoría C
- Madres lactantes
- Uso pediátrico
- Uso geriátrico
- Reacciones adversas
- Sobredosis
- Dosis y administración de Refissa
- Cómo se suministra Refissa
- Almacenamiento
- PANEL DE VISUALIZACIÓN PRINCIPAL-Caja de tubo de 40 g
- Más información sobre Refissa (tretinoína tópica)
- Recursos para el consumidor
- Recursos profesionales
- Guías de tratamiento relacionadas
Refissa Descripción
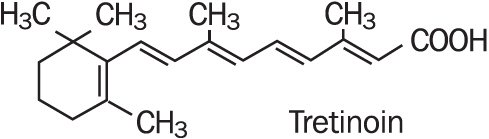
Refissa, contiene el principio activo tretinoína (un retinoide) en una base de crema emoliente. La tretinoína es un polvo cristalino de color amarillo a naranja que tiene un olor floral característico. La tretinoína es soluble en dimetilsulfóxido, ligeramente soluble en polietilenglicol 400, octanol y etanol al 100%. Es prácticamente insoluble en agua y aceite mineral, y es insoluble en glicerina. El nombre químico de la tretinoína es ácido (all-E)-3,7-dimetil-9-(2,6,6-trimetil-1-ciclonexen-1-il)-2,4,6,8-nonatetraenoico. La tretinoína también se conoce como ácido transretinoico y tiene un peso molecular de 300,44. La fórmula estructural se representa a continuación.
Refissa contiene tretinoína a una concentración de 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa-Farmacología clínica
Se desconoce el mecanismo de acción exacto de la tretinoína, aunque se cree que los retinoides ejercen un efecto sobre el crecimiento y la diferenciación de varias células epiteliales. Sin embargo, cuando se aplicó tópicamente, no se observó un aumento de desmosina, hidroxiprolina o ARNm de elastina en la piel humana. Además, aún no se ha determinado plenamente el papel de la naturaleza irritativa de este producto en los efectos positivos atribuidos a este producto para su indicación.
La absorción transdérmica de la tretinoína a partir de diversas formulaciones tópicas osciló entre el 1% y el 31% de la dosis aplicada, dependiendo de si se aplicó en piel sana o dermatitis. Cuando se evaluó la absorción percutánea de Tretinoína en crema, USP (emoliente) al 0,05% en hombres sanos (n=14) después de una sola aplicación, así como después de aplicaciones diarias repetidas durante 28 días, la absorción de tretinoína fue inferior al 2% y las concentraciones endógenas de tretinoína y sus metabolitos principales no se modificaron.
Indicaciones y uso de Refissa
(Para comprender completamente la indicación de este producto, lea la sección completa de INDICACIONES Y USO de la etiqueta.)
Refissa está indicado como agente coadyuvante (véase el segundo punto a continuación) para su uso en la mitigación (paliación) de arrugas finas, hiperpigmentación moteada y rugosidad táctil de la piel facial en pacientes que no logran tal paliación utilizando programas integrales de cuidado de la piel y prevención del sol (véase el punto 3 para poblaciones en las que no se ha establecido la eficacia). Refissa NO ELIMINA LAS ARRUGAS, REPARA LA PIEL DAÑADA POR EL SOL, REVIERTE EL FOTOENVEJECIMIENTO ni RESTAURA UN PATRÓN HISTOLÓGICO DÉRMICO MÁS JOVEN O JUVENIL. Muchos pacientes logran los efectos paliativos deseados sobre las arrugas finas, la hiperpigmentación moteada y la rugosidad táctil de la piel facial con el uso de programas integrales de cuidado de la piel y prevención del sol, que incluyen protectores solares, ropa protectora y cremas emolientes QUE NO contienen tretinoína.
- Crema de tretinoína, USP (emoliente) 0.el 05% no ha demostrado ningún EFECTO ATENUANTE sobre los signos significativos de exposición crónica al sol, como arrugas gruesas o profundas, coloración amarillenta de la piel, lentigos, telangiectasia, laxitud de la piel, atipia queratinocítica, atipia melanocítica o elastosis dérmica.
- Refissa debe usarse bajo supervisión médica como complemento de un programa integral de cuidado de la piel y prevención del sol que incluya el uso de protectores solares eficaces (FPS mínimo de 15) y ropa protectora cuando no se hayan logrado los resultados deseados en arrugas finas, hiperpigmentación moteada y rugosidad de la piel facial con un programa integral de cuidado de la piel y prevención del sol por sí solo.
- La eficacia de Refissa en la mitigación de arrugas finas, hiperpigmentación moteada y rugosidad táctil de la piel facial no se ha establecido en personas mayores de 50 años O en personas con piel de pigmentación moderada a fuerte. Además, los pacientes con queratosis actínicas visibles y los pacientes con antecedentes de cáncer de piel se excluyeron de los ensayos clínicos de Tretinoína en crema, USP (emoliente) 0,05%. Por lo tanto, en este momento se desconoce la eficacia y seguridad de Refissa en estas poblaciones.
- No se ha establecido la seguridad ni la eficacia de Refissa para la prevención o el tratamiento de queratosis actínicas o neoplasias cutáneas.
- No se ha establecido la seguridad ni la eficacia del uso diario de Refissa durante más de 48 semanas, y el uso diario después de 48 semanas no se ha investigado sistemática e histológicamente en ensayos adecuados y bien controlados. (Consulte la sección ADVERTENCIAS.)
DATOS DE ENSAYOS CLÍNICOS
Se llevaron a cabo dos ensayos adecuados y bien controlados en los que participaron un total de 161 pacientes evaluables (menores de 50 años) tratados con Crema de Tretinoína, USP (emoliente) al 0,05% y 154 pacientes evaluables tratados con la crema emoliente de vehículo en la cara durante 24 semanas como complemento de un programa integral de cuidado de la piel y prevención del sol, para evaluar los efectos sobre las arrugas finas, la hiperpigmentación moteada y rugosidad de la piel. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | Reducción de 2 unidades o más |
En estos ensayos, se pensó que las arrugas finas, la hiperpigmentación moteada y la rugosidad táctil de la piel facial factores que incluían el envejecimiento intrínseco o factores ambientales, como la exposición crónica al sol.
Los resultados de estas evaluaciones son los siguientes:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| Vehículo + CSP | 67% | 23% | 10% |
la Mayoría de la mejora en estas señales se observó durante las primeras 24 semanas de terapia. A partir de entonces, el tratamiento mantuvo principalmente la mejoría observada durante las primeras 24 semanas.
La mayoría de los pacientes perderán la mayoría de los efectos atenuantes de Refissa sobre las arrugas finas, la hiperpigmentación moteada y la rugosidad táctil de la piel facial con la interrupción de un programa integral de cuidado de la piel y prevención del sol que incluye Refissa; sin embargo, no se ha establecido la seguridad y la eficacia del uso diario de Refissa durante más de 48 semanas.
Contraindicaciones
Este medicamento está contraindicado en personas con antecedentes de reacciones de sensibilidad a cualquiera de sus componentes. Debe interrumpirse si se observa hipersensibilidad a alguno de sus componentes.
Advertencias
- Refissa es un irritante dérmico, y se desconocen los resultados de la irritación continua de la piel durante más de 48 semanas en el uso crónico a largo plazo. Hay evidencia de cambios atípicos en melanocitos y queratinocitos, y de aumento de la elastosis dérmica en algunos pacientes tratados con Crema de Tretinoína, USP (emoliente) 0,05% durante más de 48 semanas. Se desconoce la importancia de estos hallazgos.
- No se ha establecido la seguridad y eficacia de Refissa en individuos con piel moderada o muy pigmentada.
- Refissa no debe administrarse si el paciente también está tomando medicamentos conocidos por ser fotosensibilizadores (por ejemplo, tiazidas, tetraciclinas, fluoroquinolonas, fenotiazinas, sulfonamidas) debido a la posibilidad de fototoxicidad aumentada.
Debido a la mayor susceptibilidad a la quemadura, se debe evitar o minimizar la exposición a la luz solar (incluidas las lámparas solares) durante el uso de Refissa. Se debe advertir a los pacientes que utilicen protectores solares (FPS mínimo de 15) y ropa protectora cuando utilicen Refissa. Se debe aconsejar a los pacientes con quemaduras solares que no utilicen Refissa hasta que se recuperen completamente. Los pacientes que puedan tener una exposición considerable al sol, por ejemplo, debido a su ocupación y aquellos pacientes con sensibilidad inherente a la luz solar, deben tener especial precaución al usar Refissa y asegurarse de que se observan las precauciones descritas en el Prospecto para el paciente.
Crema de tretinoína, USP (emoliente) 0,05% debe mantenerse fuera de los ojos, la boca, los ángulos de la nariz y las membranas mucosas. El uso tópico puede causar eritema local severo, prurito, ardor, escozor y descamación en el sitio de aplicación. Si el grado de irritación local lo justifica, se debe indicar a los pacientes que usen menos medicamentos, disminuyan la frecuencia de aplicación, interrumpan el uso temporalmente o interrumpan el uso por completo.
Se ha notificado que la tretinoína causa irritación grave en la piel eccematosa y se debe utilizar sólo con precaución en pacientes con esta afección.
La aplicación de cantidades mayores de medicamento que las recomendadas no dará lugar a resultados más rápidos o mejores, y puede ocurrir un marcado enrojecimiento, descamación o malestar.
Precauciones
General
Refissa solo debe usarse como complemento de un programa integral de cuidado de la piel y prevención del sol. (Consulte la sección INDICACIONES Y USO.)
Si se desarrolla una sensibilidad al medicamento, irritación química o una reacción adversa sistémica, se debe interrumpir el uso de Refissa.
Los extremos climáticos, como el viento o el frío, pueden ser más irritantes para los pacientes que usan Refissa.
Información para Pacientes
Consulte el Paciente prospecto.
Interacciones medicamentosas
Los medicamentos tópicos concomitantes, jabones medicinales o abrasivos, champús, limpiadores, cosméticos con un fuerte efecto secante, productos con altas concentraciones de alcohol, astringentes, especias o cal, soluciones onduladas permanentes, electrólisis, depilatorios o ceras capilares y productos que puedan irritar la piel deben utilizarse con precaución en pacientes tratados con Refissa, ya que pueden aumentar la irritación con Refissa.
Refissa no debe administrarse si el paciente también está tomando medicamentos conocidos por ser fotosensibilizadores (p. ej., tiazidas, tetraciclinas, fluoroquinolonas, fenotiazinas, sulfonamidas) debido a la posibilidad de fototoxicidad aumentada.
Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad
En un estudio dérmico de por vida en ratones CD-1 a dosis de 100 y 200 veces la dosis clínica tópica humana promedio recomendada, se observaron algunos tumores de piel en ratones hembra y tumores de hígado en ratones macho. La importancia biológica de estos hallazgos no está clara porque ocurrieron a dosis que excedieron la dosis dérmica tolerada máxima (DMT) de tretinoína y porque estuvieron dentro de la tasa de ocurrencia natural de fondo de estos tumores en esta cepa de ratones. No hubo evidencia de potencial carcinogénico cuando la tretinoína se administró por vía tópica a una dosis 5 veces superior a la dosis clínica tópica media recomendada en humanos. A efectos de comparación de la exposición animal con la exposición humana, la «dosis clínica tópica humana recomendada» se define como 500 mg de Refissa aplicados diariamente a una persona de 50 kg.
En un bioensayo crónico de dos años de ácido de vitamina A en ratones realizado por Tsubura y Yamamoto, se reportó deposición generalizada de amiloide en todos los grupos en la capa basal de la piel tratada con vitamina A. En ratones CD-1, un estudio similar reportado hialinización de los tratados sitios de la piel y la incidencia de este hallazgo fue 0/50, 3/50, y 2/50 en ratones machos y 1/50, 0/50, 4/50 y 2/50 en ratones hembra de la el control del vehículo, 0.25 mg/kg 0.5 mg/kg y 1 mg/kg, respectivamente.
Los estudios en ratones albinos sin pelo sugieren que la tretinoína puede aumentar el potencial tumorígeno de las dosis cancerígenas de luz UVB y UVA de un simulador solar. En otros estudios, cuando ratones sin pelo ligeramente pigmentados tratados con tretinoína fueron expuestos a dosis carcinogénicas de luz UVB, la incidencia y la tasa de desarrollo de tumores de piel se redujeron o no se observaron efectos. Debido a las condiciones experimentales significativamente diferentes, no es posible una comparación estricta de estos datos dispares en este momento. Aunque la importancia de estos estudios en seres humanos no está clara, los pacientes deben minimizar la exposición al sol.
El potencial mutagénico de la tretinoína se evaluó en el ensayo de Ames y en el ensayo de micronúcleos de ratón in vivo, ambos negativos.
No se han realizado estudios de segmento Dérmico I y III con Crema de Tretinoína, USP (emoliente) al 0,05% en ninguna especie. En estudios de los Segmentos oral I y III en ratas con tretinoína, se observó una disminución de la supervivencia de los neonatos y retraso del crecimiento a dosis superiores a 2 mg/kg/día (>400 veces la dosis clínica tópica media en humanos).
Embarazo
Efectos teratogénicos
La tretinoína ORAL de categoría C
ha demostrado ser teratogénica en ratas, ratones, conejos, hámsters y primates infrahumanos. Fue teratogénico y fetotóxico en ratas cuando se administró por vía oral o tópica en dosis 1000 veces la dosis clínica tópica media recomendada en humanos. Sin embargo, se han notificado variaciones en las dosis teratogénicas entre varias cepas de ratas. En el mono cynomolgus, que, metabólicamente, es más cercano a los humanos para la tretinoína que en las otras especies examinadas, se notificaron malformaciones fetales a dosis de 10 mg/kg/día o superiores, pero no se observó ninguna a dosis de 5 mg/kg/día (1000 veces la dosis clínica tópica media recomendada en humanos), aunque se observaron variaciones óseas aumentadas a todas las dosis. Se notificó un aumento de la embrioletalidad y del aborto relacionado con la dosis. También se han reportado resultados similares en macacos de cola flexible.
La tretinoína tópica en pruebas de teratogenicidad en animales ha generado resultados equívocos. Existe evidencia de teratogenicidad (cola corta o torcida) de la tretinoína tópica en ratas Wistar a dosis superiores a 1 mg/kg/día (200 veces la dosis clínica tópica recomendada en humanos). También se han notificado anomalías (húmero: corto 13%, doblado 6%, sg parietal incompleto osificado 14%) cuando se aplicaron 10 mg/kg/día por vía cutánea.
Hay otros informes en conejos blancos de Nueva Zelanda administrados con dosis de aproximadamente 80 veces la dosis clínica tópica humana recomendada de un aumento de la incidencia de cabeza abovedada e hidrocefalia, típica de malformaciones fetales inducidas por retinoides en esta especie.
Por el contrario, varios estudios en animales bien controlados han demostrado que la tretinoína aplicada dérmicamente no era teratogénica, a dosis de 100 y 200 veces la dosis clínica tópica humana recomendada, en ratas y conejos, respectivamente.
Con el uso generalizado de cualquier medicamento, se esperaría un pequeño número de informes de defectos de nacimiento asociados temporalmente con la administración del medicamento solo por casualidad. Se han notificado treinta casos de malformaciones congénitas asociadas temporalmente durante dos décadas de uso clínico de otra formulación de tretinoína tópica (Retin-A). Aunque no se ha establecido un patrón definido de teratogenicidad ni una asociación casual a partir de estos casos, 5 de los informes describen la categoría rara de defectos congénitos holoprosencefalia (defectos asociados con el desarrollo incompleto de la línea media del cerebro anterior). Se desconoce la importancia de estos informes espontáneos en términos de riesgo para el feto.
Efectos no teratogénicos
Se ha demostrado que la tretinoína dérmica es fetotóxica en conejos cuando se administra en dosis 100 veces superiores a la dosis clínica tópica humana recomendada. Se ha demostrado que la tretinoína oral es fetotóxica en ratas cuando se administra en dosis 500 veces superiores a la dosis clínica tópica humana recomendada.
No existen, sin embargo, estudios adecuados y bien controlados en mujeres embarazadas. Refissa no debe utilizarse durante el embarazo.
Madres lactantes
No se sabe si este medicamento se excreta en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna, se debe tener precaución cuando se administre Refissa a una mujer lactante.
Uso pediátrico
No se ha establecido la seguridad y eficacia en pacientes menores de 18 años.
Uso geriátrico
No se ha establecido la seguridad y eficacia en personas mayores de 50 años.
Reacciones adversas
(Consulte las secciones ADVERTENCIAS y PRECAUCIONES.)
En estudios doble ciego controlados con vehículos en los que participaron 179 pacientes que aplicaron Tretinoin Cream, USP (Emoliente) 0,05% en la cara, las reacciones adversas asociadas con el uso de Tretinoin Cream, USP (Emoliente) 0,05% se limitaron principalmente a la piel. Durante estos ensayos, el 4% de los pacientes tuvieron que suspender el uso de Tretinoína en crema, USP (emoliente) 0,05% debido a reacciones adversas. Estas interrupciones se debieron a irritación cutánea o reacciones adversas cutáneas relacionadas.
Casi todos los sujetos notificaron reacciones locales como descamación, sequedad de la piel, ardor, escozor, eritema y prurito durante el tratamiento con Crema de Tretinoína, USP (emoliente) al 0,05%. Estos signos y síntomas fueron, por lo general, de gravedad leve a moderada y, por lo general, se produjeron al comienzo del tratamiento. En la mayoría de los pacientes, la sequedad, la descamación y el enrojecimiento reaparecieron después de una disminución inicial (24 semanas).
Sobredosis
No se ha demostrado que la aplicación de cantidades mayores de medicamento que las recomendadas produzca resultados más rápidos o mejores, y se pueden presentar rojeces, descamaciones o molestias marcadas. La ingestión oral del medicamento puede provocar los mismos efectos secundarios que los asociados con la ingesta oral excesiva de vitamina A.
Dosis y administración de Refissa
- NO use Refissa si la paciente está embarazada, intenta quedarse embarazada o tiene un alto riesgo de embarazo
- NO use Refissa si la paciente está quemada por el sol o si la paciente tiene eccema u otras afecciones crónicas de la piel
- NO use Refissa si la paciente es inherentemente sensible a la luz solar
- NO use Refissa si la paciente también está tomando medicamentos conocidos por ser fotosensibilizadores(por ejemplo, tiazidas, tetraciclinas, fluoroquinolonas, fenotiazinas, sulfonamidas) debido a la posibilidad de fototoxicidad aumentada.
Los pacientes requieren instrucciones detalladas para obtener los máximos beneficios y comprender todas las precauciones necesarias para usar este producto con la mayor seguridad. El médico debe revisar el Prospecto para el paciente.
Refissa debe aplicarse en la cara una vez al día antes de retirarse, utilizando solo lo suficiente para cubrir ligeramente toda la zona afectada. Los pacientes deben lavarse suavemente la cara con un jabón suave, secar la piel con palmaditas y esperar de 20 a 30 minutos antes de aplicar Refissa. El paciente debe aplicar una cantidad de crema del tamaño de un guisante para cubrir ligeramente toda la cara. Se debe tener especial precaución al aplicar la crema para evitar los ojos, oídos, fosas nasales y boca.
La aplicación de Refissa puede causar una sensación transitoria de calor o un ligero escozor.
La mitigación (paliación) de arrugas finas faciales, hiperpigmentación moteada y rugosidad táctil puede ocurrir gradualmente durante el curso de la terapia. Pueden requerirse hasta seis meses de terapia antes de que se observen los efectos. La mayor parte de la mejoría observada con Refissa se observa durante las primeras 24 semanas de tratamiento. A partir de entonces, la terapia mantiene principalmente la mejoría observada durante las primeras 24 semanas.
Con la interrupción del tratamiento con Refissa, la mayoría de los pacientes perderán la mayoría de los efectos atenuantes de Refissa sobre las arrugas finas, la hiperpigmentación moteada y la rugosidad táctil de la piel facial; sin embargo, no se ha establecido la seguridad y la eficacia del uso diario de Refissa durante más de 48 semanas.
La aplicación de cantidades mayores de medicamento que las recomendadas puede no conducir a resultados más rápidos o mejores resultados, y puede ocurrir un marcado enrojecimiento, descamación o malestar.
Los pacientes tratados con Refissa pueden usar cosméticos, pero las áreas a tratar deben limpiarse a fondo antes de aplicar el medicamento. (Consulte la sección PRECAUCIONES.)
Cómo se suministra Refissa
Refissa está disponible en:
Tubos de 20 g NDC 42851-012-20
Tubos de 40 g NDC 42851-012-40
Almacenamiento
Almacenar a 20-25°C (68-77°F). NO CONGELAR.
Solo Rx.Impreso en EE. UU. 140904-0118 Fabricado por DPT Laboratories, San Antonio, TX 78215 Distribuido por ZO Skin Health, Inc., Irvine, CA 92618
Refissa®
SOLO PARA USO TÓPICO EN LA CARA
¿Cuál es la información más importante sobre Refissa ?
Refissa es un medicamento serio. No elimina las arrugas ni repara la piel dañada por el sol. Puede ayudar a tratar las arrugas finas, la decoloración irregular y la piel con sensación áspera, pero no «cura» estas afecciones. Refissa solo debe usarse bajo la supervisión de su proveedor de atención médica como parte de un programa amplio de cuidado de la piel. Este programa debe incluir evitar la luz solar directa (usando ropa protectora y protectores solares con un FPS mínimo de 15) y usar otras cremas faciales hidratantes que no contengan tretinoína.
Debe usar Refissa solo a la hora de acostarse. No utilice productos para el cuidado de la piel que se secan. Use la menor cantidad de Refissa necesaria y evite que entre en contacto con los ojos, oídos, nariz o boca.
ADVERTENCIA: No use Refissa si está embarazada o intenta quedarse embarazada. Evite la luz solar y cualquier otro medicamento que pueda aumentar su sensibilidad a la luz solar (ver más abajo).
Refissa no se ha estudiado en personas mayores de 50 años ni en personas con piel de pigmentación moderada u oscura.
¿Qué es Refissa?
(¿Qué puedo esperar de Refissa?)
Refissa es un medicamento serio que puede ayudar a tratar, pero no «curará» las arrugas finas, la decoloración de la piel manchada y la piel con sensación áspera.
Los estudios muestran que después de 24 semanas, aproximadamente el 30% de las personas que usaron Tretinoin Cream, USP (emoliente) 0.05% para arrugas finas o decoloración manchada, tuvieron una mejoría moderada, otro 35% tuvo una mejoría mínima y el 35% no tuvo mejoría. Aproximadamente el 16% de las personas que usaron Tretinoin Cream, USP (emoliente) 0.05% para la piel áspera, tuvieron una mejoría moderada, el 35% tuvo una mejoría mínima y el 49% no tuvo mejoría. No hay evidencia de que Refissa trate la piel gruesa, las arrugas profundas, la piel amarillenta u otros problemas de cuidado de la piel.
Refissa debe utilizarse como parte de un programa amplio de cuidado de la piel. Este programa debe incluir evitar la luz solar directa (usando ropa protectora y protectores solares con un FPS mínimo de 15) y usar otras cremas faciales hidratantes que no contengan tretinoína. Muchas personas pueden lograr los efectos deseados usando este programa sin usar Refissa. No debe usar Refissa hasta que haya probado un programa amplio de tratamiento de la piel sin Refissa.
Cuando usa Refissa, la mejora de las arrugas finas, la decoloración de la piel con manchas y la piel áspera no es inmediata y se produce gradualmente con el tiempo. Por lo general, puede notar algunos efectos en 3 a 4 meses. Los efectos son generalmente más notables a los 6 meses aproximadamente, con poca mejora adicional después de ese tiempo. Si se detiene Refissa, la mejora disminuirá gradualmente.
No se ha establecido la seguridad del uso diario de Refissa durante más de 48 semanas.
¿Quién No Debe Usar Refissa?
No debe usar Refissa si está quemado por el sol o muy sensible al sol, si tiene eccema o si su piel está irritada. Refissa puede causar una mayor irritación de la piel y una mayor susceptibilidad a las quemaduras solares.
Dado que Refissa puede hacer que su piel sea más sensible a la luz solar, debe informar a su profesional de la salud si también está utilizando otros medicamentos que aumentan la sensibilidad a la luz solar, ya que no debe usar Refissa con estos medicamentos. Estos incluyen, entre otros: tiazidas (utilizadas para tratar la presión arterial alta), tetraciclinas, fluoroquinolnes o sulfonamidas (utilizadas para tratar infecciones) y fenotiazinas (utilizadas para tratar problemas emocionales graves). Si está tomando medicamentos con receta, medicamentos sin receta o cremas faciales, consulte con un profesional de la salud para asegurarse de que no interactúen con Refissa.
Advertencia de embarazo: No se ha demostrado un uso seguro durante el embarazo. Hay informes de defectos de nacimiento en animales de laboratorio y seres humanos a los que se les administró tretinoína por vía oral. No debe usar Refissa si está embarazada o está intentando quedarse embarazada.
Se desconoce si Refissa se transmite a los lactantes a través de la leche materna. No se ha demostrado un uso seguro en niños.
No se ha demostrado la seguridad y eficacia de Refissa para personas mayores de 50 años o con coloración de piel más oscura.
¿Cómo debo usar Refissa?
Debe aplicar Refissa en su cara una vez al día antes de retirarse, usando solo lo suficiente para cubrir ligeramente toda el área afectada. Lávese suavemente la cara con un jabón suave, seque la piel con palmaditas y espere de 20 a 30 minutos antes de aplicar Refissa. Aplique una cantidad de crema del tamaño de un guisante para cubrir toda la cara. Es posible que sienta un calor o un ligero escozor cuando se aplique Refissa por primera vez.
Debe tener especial cuidado al aplicar la crema para evitar los ojos, oídos, fosas nasales o boca. Refissa puede causar enrojecimiento severo, picazón, ardor, escozor y descamación si se aplica en estas áreas.
El uso de cantidades mayores de las necesarias de Refissa no acelerará los resultados y puede causar una sobredosis. Una sobredosis puede provocar enrojecimiento y descamación de la piel, así como algo de dolor o malestar.
Puede usar cosméticos después de aplicar Refissa. Asegúrese de limpiarse bien la cara antes de volver a aplicar Refissa.
¿Qué debo Evitar Mientras Uso Refissa?
Refissa aumenta su sensibilidad a la luz solar. Evite la luz solar tanto como sea posible. Use ropa protectora y protector solar con un FPS mínimo de 15. No tome el sol ni use lámparas solares. Si es sensible a la luz solar o tiene un trabajo que requiere que esté al sol durante largos períodos, debe tener extrema precaución.
Mientras use Refissa, evite cualquier producto que pueda secar o irritar la piel. Por ejemplo, evite aplicar productos sobre la piel que contengan alcohol, especias o lima. Además, evite los limpiadores, la depilación u otros productos que puedan irritar la piel.
¿Cuáles son los Posibles Efectos Secundarios de Refissa?
Los efectos secundarios más comunes son las reacciones cutáneas. Se han notificado picazón, enrojecimiento y sequedad de la piel. Lo mismo ocurre con la piel quemada, escozor y descamación. En la mayoría de los casos, estos son leves y son más comunes cuando se inicia el tratamiento.
¿Cómo Puedo Obtener Información Adicional?
Este prospecto resume la información más importante sobre Refissa. Si desea más información, hable con su médico u otro proveedor de atención médica. También hay un folleto escrito para profesionales de la salud que su farmacéutico puede proporcionarle.
LLAME A SU MÉDICO PARA OBTENER ASESORAMIENTO MÉDICO SOBRE LOS EFECTOS SECUNDARIOS. PUEDE INFORMAR DE LOS EFECTOS SECUNDARIOS A LA FDA AL 1-800-FDA-1088.
PANEL DE VISUALIZACIÓN PRINCIPAL-Caja de tubo de 40 g
NDC 42851-012-40
117471-0118
Refissa ®
Crema de Tretinoína,
USP (emoliente) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
Más información sobre Refissa (tretinoína tópica)
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información de dosis
- Interacciones con medicamentos
- Precios & Cupones
- En español
- Clase de medicamentos: Agentes tópicos para el acné
Recursos para el consumidor
- Información para el paciente
- Refissa Tópico (Lectura avanzada)
Recursos profesionales
- Información de prescripción
- Microesferas en gel de Tretinoína (FDA)
Otras marcas Retin-A, Renova, Atralin, Altreno, … + 2 más
Guías de tratamiento relacionadas
- Fotoenvejecimiento de la piel
Exención de responsabilidad médica