Un azúcar especial: cómo el ácido siálico impacta en el metabolismo, la salud y las enfermedades
Estamos llenos de microbios que viven en superficies fuera y dentro de nuestros cuerpos. Nuestra comprensión del microbioma intestinal en particular está mejorando rápidamente a medida que comenzamos a descubrir cómo interactúan las comunidades microbianas complejas con nuestra dieta, con otros microbios y con nuestras superficies celulares. Si bien muchos productos químicos son importantes en este entorno, aquí nos centramos en los ácidos siálicos como un conjunto crítico de moléculas que sustentan muchas de estas interacciones e impactan en el metabolismo, la salud y la enfermedad.
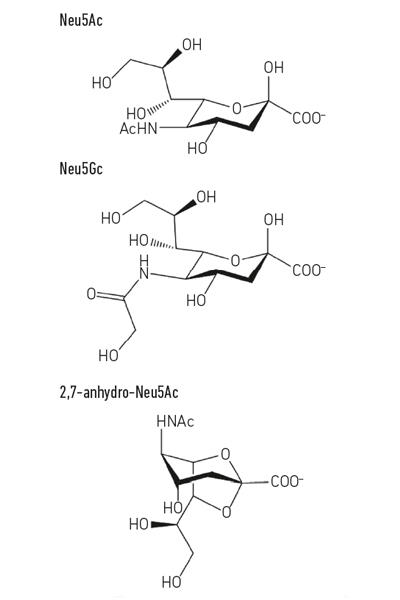
El ácido siálico más común, el ácido N-acetil-neuramínico (Neu5Ac) (Fig. 1) es un ácido de azúcar relativamente simple que, aparte de su carga, no tiene nada intrínsecamente inusual. Sin embargo, cuando las células entran en contacto con otras células, a menudo usan moléculas que se muestran en la superficie, y aquí es donde los ácidos siálicos se vuelven tan importantes, ya que generalmente son los azúcares terminales en los glicanos hospedantes que sazonan las proteínas y los lípidos que se encuentran en las superficies celulares. Las glicoproteínas de mucina secretadas o de superficie celular son buenos ejemplos de estructuras recubiertas de ácido siálico que los microbios podrían encontrar en las superficies de la mucosa, como el tracto respiratorio o gastrointestinal (GI). Esta posición única como molécula de «encuentro y bienvenida» para otras células humanas, células bacterianas y virus pone a los ácidos siálicos en el centro de la escena para muchos procesos importantes.
- Fig. 1. Ejemplo de derivados del ácido siálico. Tenga en cuenta que el ácido N-glicolil-neurnamínico (Neu5Gc) no puede ser producido por los seres humanos, una diferencia bioquímica que nos distingue de otros grandes simios, pero puede incorporarse a nuestras superficies celulares cuando se adquiere de la dieta.
- Patógenos recubiertos de azúcar
- Alimentación cruzada: compartiendo los dulces alrededor de
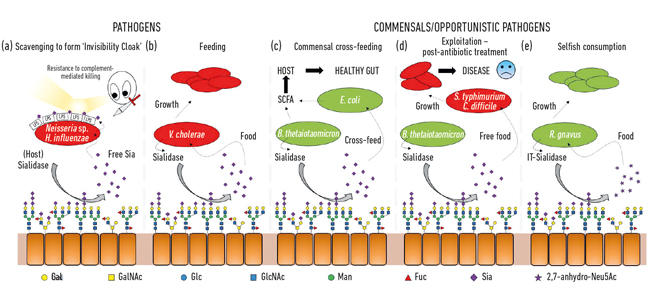
- Fig. 2. Ilustración de dibujos animados de las diversas interacciones entre bacterias y ácidos siálicos presentes como azúcares terminales en una gama de glicanos huéspedes. Estos son escindidos por sialidasas y generalmente convertidos en Neu5Ac libre con la excepción de la IT-sialidasa que libera 2,7-anhidro-Neu5Ac. El ácido siálico libre liberado por el huésped o las sialidasas patógenas puede ser utilizado por los patógenos como capa de invisibilidad (a), o para la alimentación (b). La alimentación cruzada puede ocurrir entre miembros de la microbiota intestinal o entre bacterias comensales y patógenas que comparten el mismo nicho (c, d), mientras que otras bacterias han desarrollado mecanismos egoístas para reservar ácido siálico para su propio consumo (e).
- Mantener sus propios dulces
- Los virus entran en acción
- Más información
- Andrew Bell
- Emmanuele Severi
- Nathalie Juge
- Gavin H. Thomas
- ¿Por qué importa la microbiología?
- ¿Qué consejo le darías a alguien que esté empezando en este campo?
Fig. 1. Ejemplo de derivados del ácido siálico. Tenga en cuenta que el ácido N-glicolil-neurnamínico (Neu5Gc) no puede ser producido por los seres humanos, una diferencia bioquímica que nos distingue de otros grandes simios, pero puede incorporarse a nuestras superficies celulares cuando se adquiere de la dieta.
Patógenos recubiertos de azúcar
Una de las primeras funciones microbianas de los ácidos siálicos se relacionó con la capacidad de algunos patógenos para colonizar y luego causar enfermedades en humanos. De hecho, el ex Presidente de la Sociedad de Microbiología, el profesor Harry Smith FRS, que trabaja en la Universidad de Birmingham, fue pionero en este trabajo con Neisseria gonorrea. Cuando los científicos de su grupo aislaron el insecto directamente del cuerpo, era resistente a la muerte por suero humano (muerte mediada por complemento), pero si los insectos se cultivaban en el laboratorio durante unas pocas generaciones, esta protección se perdía y las células se mataban por el suero. Su grupo había descubierto que estos patógenos roban ácido siálico del huésped y lo usan para cubrir su propia superficie celular para humanizarlos. Sin embargo, como solo pueden eliminar este ácido siálico, su ausencia en medios de crecimiento significa que no se agrega más ácido siálico, por lo que pierden rápidamente esta «protección del suero» y mueren. Resulta que una serie de otros insectos furtivos utilizan estrategias similares para generar su propia capa de invisibilidad utilizando ácido siálico, como Neisseria meningitidis, Campylobacter jejuni o Haemophilus influenzae (Fig. 2a)
Alimentación cruzada: compartiendo los dulces alrededor de
Además de ser utilizados por patógenos como capa de invisibilidad, los ácidos siálicos son un alimento bastante bueno para las bacterias, ya que proporcionan carbono y nitrógeno, y se pueden usar como fuente de energía. Trabajos anteriores mostraron que patógenos como Vibrio cholerae estaban felices de comer solo ácidos siálicos y que eso en sí mismo era importante para la colonización exitosa del huésped (Fig. 2b).
En el intestino, una fuente importante de ácidos siálicos proviene de las mucinas, que son los principales componentes estructurales de la capa de moco que cubre la superficie del epitelio. La capa de moco más expuesta es el hábitat de varias bacterias comensales, que han aprendido a alimentarse de proteínas de mucina, donde los azúcares forman el 80% de su masa. Desde una perspectiva topológica simple, los ácidos siálicos, como azúcares terminales, se cosechan primero, exponiendo los azúcares subyacentes que también pueden liberarse y comerse posteriormente. Con el advenimiento de la secuenciación de próxima generación, hemos adquirido conocimiento sobre los microbios que viven en este nicho, y muchos tienen genes para la absorción de ácido siálico y el catabolismo posterior. Lo que fue emocionante fue el descubrimiento de que algunos de los anaerobios comensales, como Bacteroides thetaiotaomicron, secretan sialidasas para liberar el ácido siálico, pero carecen de transportadores y genes catabólicos para usarlo realmente. Este gesto aparentemente altruista es necesario para que las bacterias accedan a los azúcares subyacentes y sustenta un proceso de alimentación cruzada metabólica con otros insectos que viven en el nicho de moco, como las cepas comensales de Escherichia coli que no tienen una sialidasa pero son buenas para comer ácido siálico libre (Fig. 2c). Este concepto se reconoce ahora como un aspecto importante de la colonización y la adaptación de nichos. Un ejemplo brillante de esto fue descrito por el grupo de Justin Sonnenburg de la Universidad de Stanford, utilizando un modelo de ratón con una microbiota intestinal definida simple. Después del tratamiento con antibióticos, muchas de las bacterias que se alimentan de ácido siálico fueron eliminadas, lo que resultó en la acumulación de ácido siálico libre en el intestino. Cuando se enfrentan a patógenos como Salmonella typhimurium o Clostridium difficile, estos patógenos se beneficiarían del ácido siálico libre como nutriente (Fig. 2d). Las cepas mutantes de patógenos que carecían de transportadores o genes catabólicos no tenían una ventaja, haciendo una conexión directa con el crecimiento de patógenos cuando se interrumpe la comunidad microbiana intestinal. Por lo tanto, se propusieron mecanismos para reducir el depósito de ácido siálico libre en el intestino como parte de una nueva estrategia antiinfecciosa.
Fig. 2. Ilustración de dibujos animados de las diversas interacciones entre bacterias y ácidos siálicos presentes como azúcares terminales en una gama de glicanos huéspedes. Estos son escindidos por sialidasas y generalmente convertidos en Neu5Ac libre con la excepción de la IT-sialidasa que libera 2,7-anhidro-Neu5Ac. El ácido siálico libre liberado por el huésped o las sialidasas patógenas puede ser utilizado por los patógenos como capa de invisibilidad (a), o para la alimentación (b). La alimentación cruzada puede ocurrir entre miembros de la microbiota intestinal o entre bacterias comensales y patógenas que comparten el mismo nicho (c, d), mientras que otras bacterias han desarrollado mecanismos egoístas para reservar ácido siálico para su propio consumo (e).
Mantener sus propios dulces
Mientras que la sialomicrobiología temprana se centró en los patógenos, el trabajo más reciente se ha centrado en las bacterias comensales que habitan el mismo nicho. Los estudios de hoy en día en el campo de la microbiota intestinal están revelando cuán feroz es la competencia por el Neu5Ac en nuestro intestino y cómo puede inclinar el equilibrio entre patógenos y comensales. ¿Qué pasaría si una bacteria en particular pudiera liberar ácido siálico en una forma a la que solo ella pudiera acceder? El trabajo en el Grupo Juge en Norwich mostró que el simbionte intestinal Ruminococcus gnavus ha evolucionado para hacerlo, utilizando un tipo especial de sialidasa llamada trans-sialidasa intramolecular (IT-sialidasa) que libera 2,7-anhidro-Neu5Ac (ver Fig. 1) en lugar de Neu5Ac. Al desarrollar un método para sintetizar 2,7-anhidro-Neu5Ac puro, demostraron que las cepas de R. gnavus podían crecer con 2,7-anhidro-Neu5Ac como única fuente de carbono. Además del dominio que cataliza la reacción enzimática, las IT-sialidasas comprenden un dominio de unión a carbohidratos que ayuda a mediar la unión de la IT-sialidasa a mucinas ricas en ácido siálico. In vivo, esto puede favorecer un mecanismo que ayuda a dirigir las bacterias hacia las regiones ricas en ácido siálico del tracto gastrointestinal, promoviendo así la colonización bacteriana dentro de la capa de moco. Una vez ubicada en el lugar correcto, la IT-sialidasa escinde el ácido siálico de las cadenas terminales de mucinas y lo libera en una forma, 2,7-anhidro-Neu5Ac, que R. gnavus puede usar como su propia fuente de alimento, en lugar de compartir Neu5Ac con otras bacterias que habitan en el nicho de moco, incluidos los patógenos (Fig. 2e). Este mecanismo proporciona una ventaja competitiva sobre otras bacterias que comen ácido siálico que habitan en el nicho de moco, al proporcionar una fuente de nutrientes a la que puede acceder preferentemente. Además, R. gnavus también puede ayudar a reducir el crecimiento de patógenos entéricos al reducir el nivel de Neu5Ac en el entorno de la mucosa, abriendo caminos a una nueva estrategia terapéutica en una era de creciente resistencia a los antibióticos.
Los virus entran en acción
Los virus también usan ácidos siálicos como moléculas clave durante su ciclo de infección, el más famoso de los virus de la gripe. La unión inicial es el primer paso clave, ya que los ácidos siálicos funcionan como receptores del virus en las células epiteliales respiratorias. El tipo de enlace del ácido siálico con los azúcares subyacentes en los glicanos a menudo controla la gama de virus de la gripe del huésped, y las cepas pandémicas a menudo tienen una proteína de adhesión (hemaglutinina) que reconoce las formas similares a las humanas de la unión del ácido siálico y, por lo tanto, son particularmente virulentas. El ácido siálico es importante en la última etapa del ciclo de vida viral, ya que la liberación de la célula infectada requiere la escisión de los ácidos siálicos de la superficie de la célula huésped. Esto es catalizado por una enzima viral llamada sialidasa (o neuraminidasa). La inhibición de esta enzima por análogos estructurales del ácido siálico, formulado en Tamiflu® (fosfato de Oseltamivir) y Zanamivir, es nuestro tratamiento de primera línea para la gripe y es un triunfo del diseño de medicamentos inspirado en la estructura y la función.
En conclusión, está claro que los ácidos siálicos son moléculas críticas en muchos procesos donde las células microbianas y los virus interactúan con las superficies celulares de los mamíferos. En este breve artículo, hemos tocado algunos de estos para dar una idea de las funciones centrales de estos azúcares en la comunicación, el sigilo, la colonización y el metabolismo en diferentes aspectos de la salud y la enfermedad. Los ácidos siálicos han sido descritos como los productos químicos más importantes del mundo y sin duda continuarán revelando más sobre la evolución de los seres humanos y su interacción con sus microbios.
Más información
Thomas, GH. Adquisición de ácido siálico en bacterias: un sustrato, muchos transportadores. Biochem Soc Trans 2016; 44: 760-765.
Ng KM, Ferreyra JA, Higginbottom SK, Lynch JB, Kashyap PC et al. Los azúcares huéspedes liberados de la microbiota facilitan la expansión post-antibiótica de los patógenos entéricos. Nature 2013; 502: 96-99.Owen CD, Tailford LE, Monaco S, Šuligoj T, Vaux L et al. Desentrañar la especificidad y el mecanismo del reconocimiento de ácido siálico por el simbionte intestinal Ruminococcus gnavus. Nat Commun 2017; 8:2196.
Tailford LE, Owen CD, Walshaw J, Crost EH, Hardy-Goddard J, Le Gall G, de Vos WM, Taylor GL, Juge N. El descubrimiento de transsialidasas intramoleculares en la microbiota intestinal humana sugiere nuevos mecanismos de adaptación de la mucosa. Nat Commun 2015; 6: 7624.Juge N, Tailford L, Owen CD. Sialidases from gut bacteria: a mini-review (en inglés). Biochem Soc Trans 2016; 44: 166-175.

Andrew Bell
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, Reino Unido
Andrew Bell es un estudiante de posgrado en el Departamento de Microbios Intestinales y Salud en el Quadram Institute que estudia el impacto de un nuevo mecanismo del metabolismo del ácido siálico en la homeostasis intestinal. Obtuvo su licenciatura en Bioquímica de la Universidad de East Anglia y pasó 2 años trabajando en el John Innes Centre on chlorophyll metabolism in pea (Pisum sativum) antes de unirse al grupo de Nathalie Juge en el Quadram Institute en 2015 para su trabajo de doctorado.

Emmanuele Severi
Departamento de Biología, Universidad de York, Wentworth Way, York YO10 5DD, Reino Unido
@emm_severi
Emmanuele Severi es investigadora asociada postdoctoral en el Departamento de Biología de la Universidad de York que trabaja en el laboratorio del profesor Gavin Thomas. Ha trabajado en el transporte y metabolismo del ácido siálico en diferentes momentos de su carrera, y ha sido miembro de la Sociedad desde 2002.

Nathalie Juge
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, Reino Unido
Nathalie Juge es Líder de Investigación en el Quadram Institute Bioscience (QIB) en Norwich, Líder Adjunta del Programa Estratégico del Instituto, Microbios Intestinales y Salud (GMH), y Profesora Honoraria en la Escuela de Ciencias Biológicas de la Universidad de East Anglia. Dirige un Grupo de Investigación sobre la glicobiología de las interacciones huésped-microbio en el intestino con un enfoque en el metabolismo del ácido siálico derivado de mucina por la microbiota intestinal (https://quadram.ac.uk/nathalie-juge).

Gavin H. Thomas
Departamento de Biología de la Universidad de York, Wentworth Way, York YO10 5DD, Reino Unido
@GavinHThomas
Gavin H. Thomas es Profesor de Microbiología en el Departamento de Biología de la Universidad de York y ha trabajado en el transporte y catabolismo de ácido siálico bacteriano durante más de una década. Ha sido miembro de la Sociedad desde 1995, fue Editor de Microbiology Today (2003-2006), miembro del Consejo en el mismo período, miembro del comité de Comunicaciones (2012-2015) y del comité de Diversidad de Igualdad & (2013-2015). Ha sido Editor, Editor Senior y ahora es Editor Adjunto en Jefe de la revista líder de la Sociedad Microbiology (http://thomaslabyork.weebly.com).
¿Por qué importa la microbiología?
Gavin: Es importante para nuestra salud: solo ahora estamos empezando a comprender la composición molecular y la función de nuestro microbioma, que probablemente impacta en nuestro cuerpo de formas múltiples.
¿Qué consejo le darías a alguien que esté empezando en este campo?
Gavin: Lea ampliamente y más allá de ‘ su insecto–: ¡los microbios pueden hacer prácticamente todo y, por lo general, han inventado múltiples formas diferentes de hacerlo!
Imágenes: Partículas del virus de la gripe H3N2. CDC / Biblioteca Fotográfica Científica.
Fig. 1. Andrew Bell.
Fig. 2. Emmanuele Severi.