Vitamina C: Un agente antioxidante
Metabolismo redox y propiedades antioxidantes de la vitamina C
Los radicales libres y oxidantes desempeñan un doble papel como compuestos tóxicos y beneficiosos, en los procesos metabólicos y en respuesta a estímulos exógenos. Se producen a partir de actividades metabólicas normales o de factores ambientales (contaminación, humo de cigarrillo y radiación). Cuando no se puede eliminar una sobrecarga de radicales libres, su acumulación en el cuerpo genera estrés oxidativo . El estrés oxidativo ocurre cuando la formación de radicales libres excede la capacidad de protección contra ellos. Este proceso conduce al desarrollo de enfermedades crónicas y degenerativas como el cáncer, trastornos autoinmunes, envejecimiento, cataratas, artritis reumatoide, enfermedades cardiovasculares y neurodegenerativas . Un antioxidante es una molécula que previene la oxidación de otras moléculas. El proceso de oxidación es una reacción química que produce radicales libres, dando lugar a reacciones en cadena que pueden dañar las células. El efecto antioxidante de la vitamina C ha sido bien documentado . La vitamina C es un poderoso antioxidante que tiene la capacidad de donar un átomo de hidrógeno y formar un radical libre de ascorbilo relativamente estable. La vitamina E, la vitamina C y el β-caroteno se conocen como vitaminas antioxidantes que se sugieren para disminuir el daño oxidativo y disminuir el riesgo de ciertas enfermedades crónicas. Las enfermedades, como los trastornos cardiovasculares, están asociadas con concentraciones inadecuadas de ácido l-ascórbico, tocoferol y β-caroteno en estudios epidemiológicos. La vitamina C también mejora la absorción de hierro al reducir el Fe3 + a Fe2 + de fuentes de hierro no hemo . En presencia de iones activos redox (hierro, cobre), la vitamina C actúa como un prooxidante, contribuyendo a la formación de radicales hidroxilo, que pueden conducir a la oxidación de lípidos, ADN u proteínas . Existen diferentes mecanismos para aliviar el estrés oxidativo y reparar macromoléculas dañadas. Los antioxidantes enzimáticos y no enzimáticos tienen un papel importante en la eliminación de radicales libres y especies reactivas de oxígeno (ROS). Se ha demostrado que las enzimas antioxidantes catalasa (CAT), superóxido dismutasa (SOD), glutatión reductasa (GR), glutatión peroxidasa (GSHpx) y, en las plantas, ascorbato peroxidasa (AA-px) y los antioxidantes no enzimáticos, incluidos el glutatión (GSH) y el ascorbato (ASC), se ven significativamente afectados por el estrés oxidativo . Los compuestos antioxidantes pueden prevenir la formación incontrolada de radicales libres o inhibir su reacción con sitios biológicos; además, la destrucción de la mayoría de los radicales libres depende de la oxidación de antioxidantes endógenos principalmente al eliminar y reducir moléculas . Se cree que la vitamina C es un importante antioxidante soluble en agua que neutraliza las ERO y reduce el estrés oxidativo .
La vitamina C es un potente agente reductor y eliminador de radicales libres en sistemas biológicos . Participa en la primera línea de defensa antioxidante, protegiendo las membranas lipídicas y las proteínas del daño oxidativo. Como molécula soluble en agua, la vitamina C puede funcionar tanto dentro como fuera de las células, y puede neutralizar los radicales libres y prevenir el daño de los radicales libres. La vitamina C es una excelente fuente de electrones para los radicales libres que buscan un electrón para recuperar su estabilidad. La vitamina C puede donar electrones a los radicales libres y apagar su reactividad .
Se ha demostrado que la vitamina C es un eliminador eficaz contra las especies de óxido de oxígeno y nitrógeno, como el ion radical superóxido, el peróxido de hidrógeno, el radical hidroxilo y el oxígeno singlete. Esta propiedad de la vitamina C tiene procesos vitales en la protección de los componentes celulares del daño inducido por radicales libres. Además, la vitamina C es eficaz para regenerar la forma antioxidante de la vitamina E al reducir los radicales tocoferoxilo. Este proceso protege las membranas y otros compartimentos de la célula del daño inducido por radicales libres (Figura 2). La ascorbato peroxidasa (APX) es una enzima que reduce el H2O2 a agua mediante el uso de ascorbato como donante de electrones. El monodehidroascorbato es un ascorbato oxidado que es regenerado por la monodehidroascorbato reductasa (MDAR). El radical monodehidroascorbato rápidamente se descompone en ascorbato y deshidroascorbato. Dehydroascorbate is reduced to ascorbate by dehydroascorbate reductase in the presence of GSH, yielding oxidized glutathione (GSSG). It is reduced by glutathione reductase (GR) using nicotinamide adenine dinucleotide phosphate hydrogen (NADPH) as an electron donor. Dehydroascorbate may be reduced nonenzymatically or catalyzed by proteins with dehydroascorbate reductase (DHAR) activity.
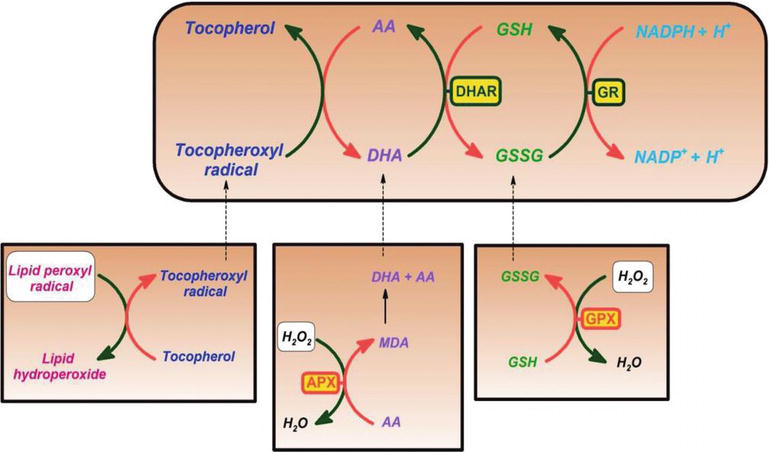
Figure 2.
xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceAscorbate and redox cycling antioxidants. AA, ascorbate; DHA, dehydroascorbate; DHAR, semidehydroascorbate reductase; GSH, glutathione; GSSG, semi-glutathione reductase; GR, glutathione reductase; APX, ascorbate peroxidase; and GPX, glutathione peroxidase .
Glutathione-ascorbate cycle operates in the cytosol, mitochondria, plastids, and peroxisomes in plants . Se sugiere que el ciclo glutatión-ascorbato juega un papel clave para la desintoxicación del H2O2, debido a las altas concentraciones de glutatión, ascorbato y NADPH en las células vegetales. Otras enzimas, como el ascorbato y las glutatión peroxidasas, que utilizan tioredoxinas o glutaredoxinas como sustratos reductores, también desempeñan un papel en la eliminación del H2O2 en las plantas (Figura 2).
La vitamina C también forma el radical semidehidroascorbilo, un radical de vida relativamente larga, en la regeneración de la vitamina E a partir de su forma radical, así como en la eliminación de radicales. Las células vegetales y animales contienen una enzima semidehidroascorbato reductasa dependiente de NADH (EC 1.6.5.4), que reduce el radical a vitamina C mediante el uso de NADH como fuente de agente reductor (Figura 2). Tanto enzimáticamente como no enzimáticamente, puede descomponerse irreversiblemente en ácido dicetoglucónico o puede convertirse en ascorbato en una reacción dependiente del glutatión .
Al ser una sustancia reductora y un donante de electrones, durante la eliminación de radicales libres, la vitamina C dona electrones de alta energía para neutralizar los radicales libres, y se oxida a ácido deshidroascórbico. El ácido deshidroascórbico puede ser convertido de nuevo en ácido ascórbico para su reutilización o puede ser metabolizado, liberando más electrones. Aunque la vitamina C se absorbe en el intestino a través de un transportador de vitamina C dependiente de sodio, la mayoría de las células transportan la vitamina C en forma oxidada (ácido deshidroascórbico) a través del transportador de glucosa 1. El ácido deshidroascórbico se reduce para generar ácido ascórbico dentro de la célula, protegiendo las mitocondrias del daño oxidativo inducido por radicales libres (Figuras 2 y 3). Radicales libres altamente reactivos (p. ej., RO -, RO2 -, OH -,, NO2) se reducen por el ascorbato, y el radical ascorbilo recién generado es poco reactivo. El ascorbato también puede eliminar especies reactivas no radicales, derivadas del peroxinitrito, como el ácido hipocloroso, el ozono y los agentes nitrantes. La vitamina C es un catalizador de reducción de oxidación de monosacáridos (redox) que se encuentra tanto en animales como en plantas. El efecto antioxidante de la vitamina C se debe a su capacidad para donar electrones del segundo y tercer carbono. Durante la evolución de los primates, una de las enzimas necesarias para producir ácido ascórbico se ha perdido por mutación, los humanos deben obtenerlo de la dieta ; la mayoría de los animales pueden sintetizar esta vitamina en sus cuerpos y no la requieren en sus dietas . La vitamina C es necesaria en la conversión del procolágeno en colágeno oxidando los residuos de prolina en hidroxiprolina. En otras células, se mantiene en su forma reducida por reacción con glutatión . Como se muestra en las Figuras 2 y 3, el ácido ascórbico es un catalizador redox que puede reducir, y por lo tanto neutralizar, ROS como el peróxido de hidrógeno (H2O2) (Figuras 2 y 3).
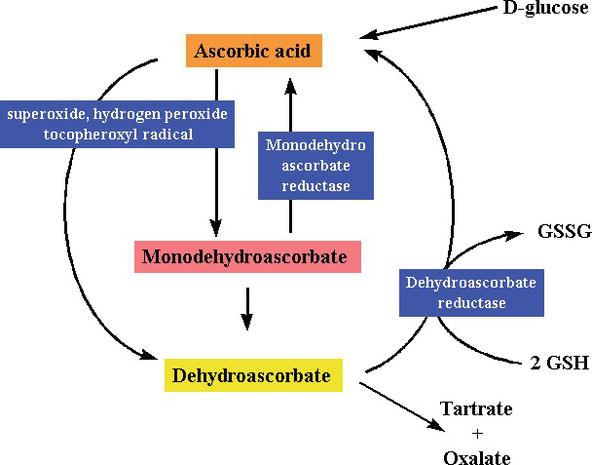
Figure 3.
xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceSynthesis and degradation ofl-ascorbic acid in plant tissues .
Ascorbic acid has direct antioxidant effects, and also it is a substrate for the redox enzyme ascorbate peroxidase, that is particularly important in stress resistance in plants. El ácido ascórbico está presente en altos niveles en todas las partes de las plantas, especialmente en cloroplastos que alcanzan concentraciones de 20 mm allí . El deshidroascorbato (DHA) y el radical libre de ascorbato (AFR), como intermediario, el radical libre de ascorbato (AFR), que son reversibles, se generan oxidaciones de un electrón a partir del ascorbato (Figura 4). De acuerdo con el modelo generalmente asumido de eliminación enzimática de ROS, SOD cataliza el anión superóxido a H2O2 y oxígeno; luego el H2O2 se reduce a agua y oxígeno molecular por CAT. CAT turnover number is very high, but its affinity for H2O2 is relatively low, and consequently a certain amount of H2O2 remains in the cell.
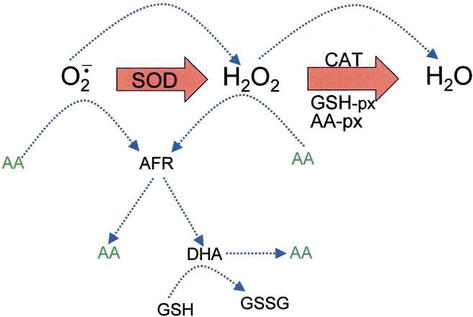
Figure 4.
xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceThe role of AA in the detoxification of ROS. Blue dotted lines indicate nonenzymatic reactions.
H2O2 can react with superoxide anion formed in oxidative metabolism generating the highly reactive hydroxyl radical. GSH peroxidases (GSH-px) and AA peroxidases (AA-px) are capable of scavenging H2O2 due to their high affinity for H2O2. The cooperativity of SOD, CAT, and peroxidases ensures low amounts of superoxide anion and H2O2 and limiting the risk of hydroxyl radical formation (Figure 5).

Figure 5.
xmlns:mml=»http://www.w3.org/1998/Math/MathML» xmlns:xlink=»http://www.w3.org/1999/xlink» xmlns:xsi=»http://www.w3.org/2001/XMLSchema-instanceFoyer-Halliwell-Asada cycle .