VoLumen
Nombre genérico: sulfato de bario
Forma de dosificación: suspensión oral
Revisado médicamente por Drugs.com. Última actualización el 1 de octubre de 2020.
- Descripción General
- Efectos secundarios
- Dosis
- Profesional
- Embarazo
- Más
Descargo de responsabilidad: La FDA no ha encontrado que este medicamento sea seguro y efectivo, y esta etiqueta no ha sido aprobada por la FDA. Para obtener más información sobre los medicamentos no aprobados, haga clic aquí.
- VoLumen Descripción
- FARMACOLOGÍA CLÍNICA
- INDICACIONES Y USO
- Contraindicaciones
- Advertencias
- Precauciones
- General
- Información para pacientes
- Interacciones medicamentosas
- El uso en el embarazo
- Las madres lactantes
- REACCIONES ADVERSAS
- REACCIONES ALÉRGICAS
- Sobredosis
- DOSIFICACIÓN Y ADMINISTRACIÓN
- Para Administración oral: Marcado del Tracto Gastrointestinal
- Almacenamiento
- Cómo se suministra VoLumen
- More about Volumen (barium sulfate)
- Recursos para el consumidor
- Recursos profesionales
- Guías de tratamiento relacionadas
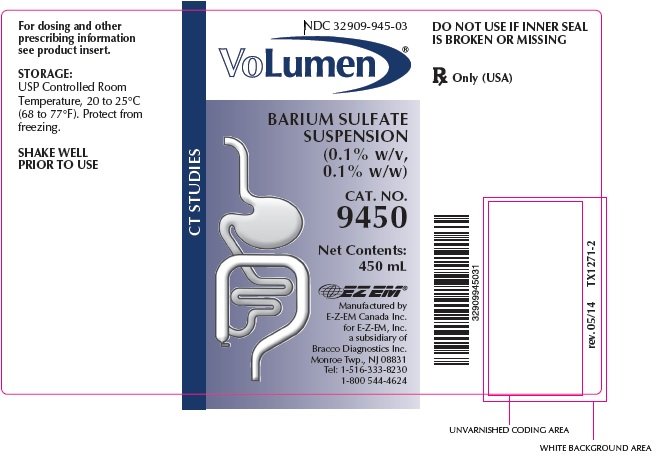
VoLumen Descripción
VoLumen® es una suspensión de sulfato de bario 0,1% p/v, 0,1% p / p para administración oral. Cada 100 mL contiene 0,1 g de sulfato de bario. El sulfato de bario, debido a su alta densidad molecular, es opaco a los rayos X y, por lo tanto, actúa como agente de contraste positivo para estudios radiográficos. El ingrediente activo es sulfato de bario y su fórmula estructural es BaSO4. El sulfato de bario se presenta como un polvo fino, blanco, inodoro, insípido y voluminoso que está libre de arenosidad. Sus suspensiones acuosas son neutras al tornasol. Es prácticamente insoluble en agua, soluciones de ácidos y álcalis y disolventes orgánicos.
Ingredientes inactivos: ácido cítrico, goma natural, ácido benzoico, citrato de sodio, sabor a arándano natural y artificial, sorbato de potasio, agua purificada, sacarina sódica, emulsión de simeticona, benzoato de sodio y sorbitol.
FARMACOLOGÍA CLÍNICA
El sulfato de bario, debido a su alta densidad molecular, es opaco a los rayos X y, por lo tanto, actúa como agente de contraste positivo para estudios radiográficos. El sulfato de bario es biológicamente inerte y, por lo tanto, no es absorbido ni metabolizado por el cuerpo, y se elimina del tracto GASTROINTESTINAL sin cambios.
INDICACIONES Y USO
Para uso en Tomografía Computarizada para opacificar el tracto gastrointestinal.
Contraindicaciones
Este producto no debe utilizarse en pacientes con perforación gastrointestinal conocida o sospechada o hipersensibilidad al sulfato de bario o a cualquier componente de esta formulación de sulfato de bario.
Advertencias
En raras ocasiones, se han notificado reacciones alérgicas graves de naturaleza anafilactoide tras la administración de agentes de contraste de sulfato de bario. Se debe disponer de personal e instalaciones debidamente capacitados para el tratamiento de emergencia de las reacciones graves y deben permanecer disponibles durante al menos 30 a 60 minutos después de la administración, ya que pueden producirse reacciones retardadas.
Precauciones
General
Los procedimientos de diagnóstico que impliquen el uso de agentes de contraste radiopacos deben llevarse a cabo bajo la dirección de personal con la formación necesaria y con un conocimiento profundo del procedimiento particular que se vaya a realizar. Una historia de asma bronquial, atopia, como lo demuestran la fiebre del heno y el eccema, o una reacción previa a un agente de contraste, merecen una atención especial. Se debe tener precaución con el uso de medios radiopacos en pacientes gravemente debilitados y en aquellos con hipertensión marcada o enfermedad cardíaca avanzada. No se recomienda la ingestión de bario en pacientes con antecedentes de aspiración de alimentos. Si se requieren estudios con bario en estos pacientes o en pacientes en los que se desconoce la integridad del mecanismo de deglución, se debe proceder con precaución. Si se aspira bario en la laringe, se debe interrumpir inmediatamente la administración posterior.
Información para pacientes
Antes de la administración de este producto, se debe indicar a las pacientes que reciben agentes diagnósticos de sulfato de bario que:
- Informen a su médico si están embarazadas.
- Informe a su médico si es alérgico a algún medicamento o alimento, o si ha tenido alguna reacción previa a productos de sulfato de bario u otros agentes de contraste utilizados en procedimientos de rayos X (consulte PRECAUCIONES generales).
- Informe a su médico sobre cualquier otro medicamento que esté tomando actualmente.
- Busque atención médica inmediata si experimenta una reacción alérgica después de usar este producto.
Interacciones medicamentosas
La presencia de formulaciones de sulfato de bario en el tracto gastrointestinal puede alterar la absorción de agentes terapéuticos tomados concomitantemente. Para minimizar cualquier posible cambio en la absorción, se debe considerar la administración separada de sulfato de bario de la de otros agentes.
El uso en el embarazo
Se sabe que la radiación causa daño al feto no nacido expuesto en el útero. Por lo tanto, los procedimientos radiográficos solo deben utilizarse cuando, a juicio del médico, su uso se considere esencial para el bienestar de la paciente embarazada.
Las madres lactantes
Se pueden utilizar productos de sulfato de bario durante la lactancia.
REACCIONES ADVERSAS
Las reacciones adversas, como náuseas, vómitos, diarrea y calambres abdominales, que acompañan al uso de formulaciones de sulfato de bario son infrecuentes y generalmente leves. Se han producido reacciones graves (aproximadamente 1 de cada 1.000.000) y muertes (aproximadamente 1 de cada 10.000.000). Las complicaciones del procedimiento son poco frecuentes, pero pueden incluir neumonitis por aspiración, formación de granulomas, intravasación, embolización y peritonitis después de perforación intestinal, episodios vasovagales y sincopales y muertes.
REACCIONES ALÉRGICAS
Debido a la mayor probabilidad de reacciones alérgicas en pacientes atópicos, es importante obtener una historia completa de alergias conocidas y sospechosas, así como de síntomas de tipo alérgico, por ejemplo, rinitis, asma bronquial, eccema y urticaria, antes de cualquier procedimiento médico que utilice estos productos. Una reacción alérgica leve probablemente incluiría prurito generalizado, eritema o urticaria (aproximadamente 1 de cada 250.000). Estas reacciones generalmente responden a un antihistamínico como 50 mg de difenhidramina o su equivalente. En las reacciones más raras y graves (aproximadamente 1 de cada 1.000.000), se podrían desarrollar edema laríngeo, broncoespasmo o hipotensión. Las reacciones graves que pueden requerir medidas de emergencia a menudo se caracterizan por vasodilatación periférica, hipotensión, taquicardia refleja, disnea, agitación, confusión y cianosis, que progresan a inconsciencia. El tratamiento debe iniciarse inmediatamente con 0,3 a 0,5 cc de epinefrina 1:1000 por vía subcutánea. Si predomina el broncoespasmo, se deben administrar lentamente de 0,25 a 0,50 gramos de aminofilina intravenosa. Es posible que se requieran vasopresores adecuados. Los corticosteroides adrenérgicos, incluso si se administran por vía intravenosa, no ejercen un efecto significativo sobre las reacciones alérgicas agudas durante unas horas. La administración de estos agentes no debe considerarse una medida de emergencia para el tratamiento de reacciones alérgicas. Los pacientes preocupados pueden desarrollar debilidad, palidez, tinnitus, diaforesis y bradicardia tras la administración de cualquier agente diagnóstico. Tales reacciones son generalmente de naturaleza no alérgica y se tratan mejor haciendo que el paciente se acueste en posición plana durante 10 a 30 minutos adicionales bajo observación.
Sobredosis
En raras ocasiones después de la administración repetida, pueden producirse calambres estomacales graves, náuseas, vómitos, diarrea o estreñimiento. Estas respuestas indicadas pueden estar presentes tanto en procedimientos fluoroscópicos como en TC. Son de naturaleza transitoria y no se consideran graves. Los síntomas pueden tratarse de acuerdo con los estándares de atención médica aceptados actualmente.
DOSIFICACIÓN Y ADMINISTRACIÓN
El volumen de la suspensión de sulfato de bario por TC que se administrará dependerá del grado y la extensión del contraste requerido en el área o áreas bajo examen y de la técnica empleada.
Para Administración oral: Marcado del Tracto Gastrointestinal
El paciente debe comenzar a beber VoLumen® aproximadamente 20-30 minutos antes del procedimiento programado. Se recomienda que el paciente consuma múltiples frascos, aproximadamente de 900 mL a 1.350 ml de volumen total antes del examen o el uso según las indicaciones del médico. Para mejorar el marcado gástrico, el paciente debe consumir los 200 ml finales inmediatamente antes de la exploración. El marcado intestinal es consistente debido a la uniformidad de la concentración de 0,1% de BaSO4. El marcado de la luz intestinal se puede mejorar aumentando el volumen de VoLumen® consumido (ver a continuación). Se pueden seguir otros regímenes posológicos, según proceda. En pacientes en los que el marcado es problemático, como la obesidad y el retraso en el tránsito, es posible mejorar el marcado aumentando el volumen total de VoLumen® administrado hasta 1.800 mL o cuatro (4) frascos.
Almacenamiento
Temperatura ambiente controlada por USP, de 20 a 25 ° C (68 a 77°F). Proteger de la congelación.
Cómo se suministra VoLumen
VoLumen® se suministra en la siguiente cantidad: frascos de 450 mL,
Cat. No. 9450, NDC 32909-945-03
Solo Rx (EE.UU.)
AGITAR BIEN ANTES DE USAR
Patente pendiente
Fabricado por
E-Z-EM Canada Inc.para E-Z-EM, Inc.una filial de Bracco Diagnostics Inc.Monroe Township, NJ 08831 Tel: 1-516-333-8230 1-800 544-4624 rev.05/14 TX1272-3 ©2006 E-Z-EM, Inc.
Suspensión de sulfato de bario y volumen
NDC: 32909-945-03
| VoLumen barium sulfate suspension |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Labeler – E-Z-EM Canada Inc (204211163)
Registrant – E-Z-EM, INC. (002041226)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| E-Z-EM Canada Inc | 204211163 | PACK(32909-945), ANALYSIS(32909-945), LABEL(32909-945), MANUFACTURE(32909-945) | |
More about Volumen (barium sulfate)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Pricing & Cupones
- En Español
- 1 Revisión
- Clase de medicamentos: medios de contraste no yodados
Recursos para el consumidor
- Lectura avanzada
Recursos profesionales
- Información de prescripción
Otras marcas NeuLumEX, Liquid E-Z Paque, HD 200 Plus, Entrobar, … + 30 más
Guías de tratamiento relacionadas
- Tomografía computarizada
Exención de responsabilidad médica