19.11 : Les dérivés biphényles optiquement actifs de racémisation
(Section 13-5A) sont racémisés si les deux cycles aromatiques traversent à tout moment une configuration coplanaire par rotation autour de la liaison centrale. Ceci peut être réalisé plus ou moins facilement par la chaleur, à moins que les substituants 2,2′-ortho ne soient très importants.
La façon dont les composés à atomes de carbone asymétriques sont racémisés est plus compliquée. Une possibilité serait qu’un carbone chiral tétraédrique attaché à quatre groupes devienne planaire et achiral sans rompre les liaisons. Les calculs théoriques indiquent qu’il ne s’agit pas d’un processus probable pour le carbone tétravalent chiral, mais, comme nous le verrons, il se produit avec du carbone chiral et d’autres atomes chiraux qui sont attachés à trois groupes:
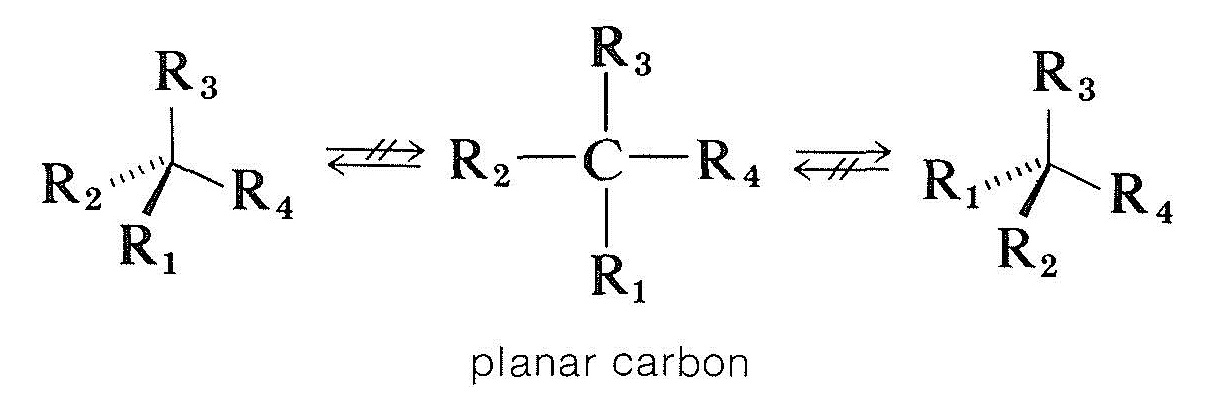
Les composés carbonylés optiquement actifs du type \(\ce{-CHC=O}\), dans lesquels le carbone alpha est asymétrique, sont racémisés à la fois par des acides et des bases, et à partir de la section 17-1 nous pouvons être sûrs que cela est lié à l’énolisation. La formation de l’énol ou de l’anion énolate détruira l’asymétrie du carbone \(\alpha\) de sorte que, même si seules des traces d’énol sont présentes à un moment donné, la totalité du composé sera éventuellement racémisée. Cependant, le mécanisme nécessite à la fois qu’il y ait un \(\alpha\) hydrogène et que le centre de symétrie soit situé à ce \(\alpha\) carbone. Sinon, les acides et les bases sont inefficaces pour catalyser la racémisation.
.jpg?revision=1)
La racémisation d’un halogénure secondaire optiquement actif avec le carbone chiral portant l’halogène (p.ex., 2-chlorobutane) peut se produire en solution d’ih et, généralement, plus le solvant est polaire et mieux ionisant, plus la substance est racémisée facilement. L’ionisation de l’halogénure par un processus \(S_\text{N}1\) est probablement responsable, et cela serait certainement favorisé par les solvants polaires (section 8-6). Toutes les indications sont qu’un carbocation d’alkyle une fois dissocié de son anion qui l’accompagne est planaire; et, lorsqu’un tel ion se recombine avec l’anion, il a la même probabilité de former les énantiomères \(D\) et \(L\):
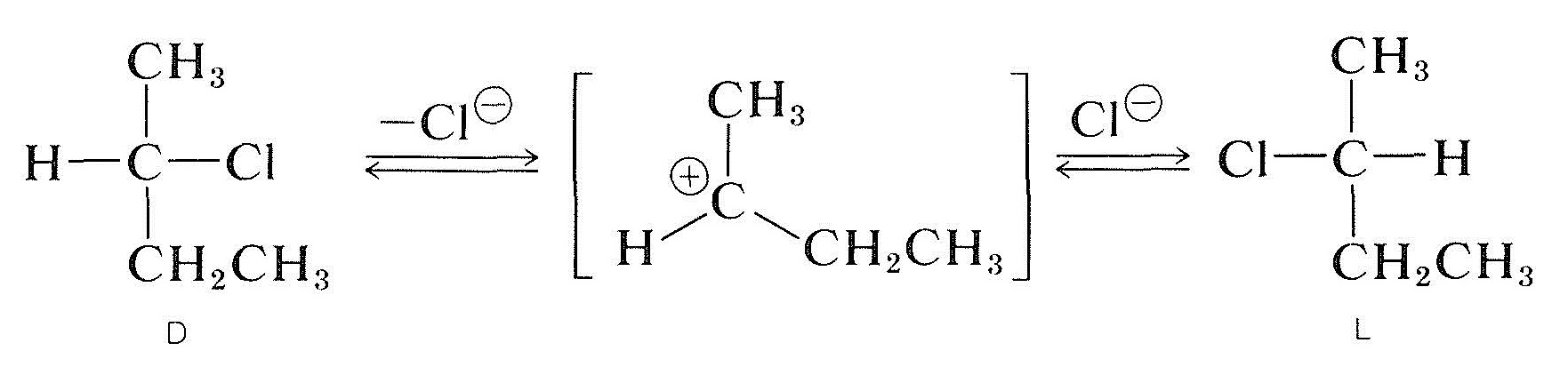
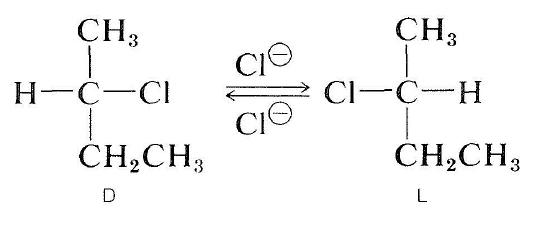
Les halogénures optiquement actifs peuvent également être racémisés par un mécanisme \(S_\text{N}2\). Une solution de 2-chlorobutane actif dans de la 2-propanone contenant du chlorure de lithium dissous devient racémique. Le déplacement du chlorure de l’halogénure par l’ion chlorure inverse la configuration au niveau de l’atome en cours de substitution (voir Section 8-5). Une seconde substitution régénère l’énantiomère d’origine. Finalement, ce processus de va-et-vient produit un nombre égal des formes \(D\) et \(L\); la substance est alors racémique:
Les alcools asymétriques sont souvent racémisés par des acides forts. Sans aucun doute, l’ionisation a lieu et la recombinaison du carbocation avec de l’eau conduit à l’un ou l’autre énantiomère:
.jpg?revision=1&size=bestfit&width=590&height=243)
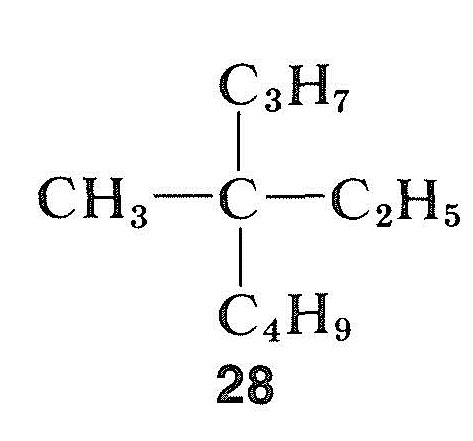
Contrairement aux halogénures, aux alcools et aux composés carbonylés, les hydrocarbures peuvent être extrêmement difficiles à racémiser. Ceci est particulièrement vrai pour un composé à centre asymétrique quaternaire, tel que le méthyléthylpropylbutylméthane, \(28\), qui n’a pas de « poignée » permettant de convertir le carbone asymétrique en une condition symétrique par des moyens chimiques simples :
Cependant, les hydrocarbures qui ont un atome d’hydrogène au carbone asymétrique peuvent être racémisés s’ils peuvent être convertis soit en carbocations, soit en carbocations. carbanions. La facilité de racémisation de type carbanion dépendra de l’acidité de l’hydrogène attaché et de la stabilité stéréochimique du carbanion intermédiaire formé. Si la configuration de l’intermédiaire carbanion s’inverse, il en résultera une racémisation (voir également Section 6-4E) :
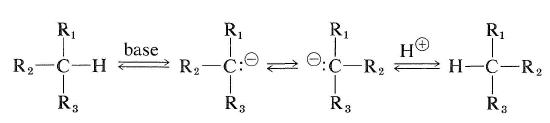
Le type de racémisation par carbocation d’un hydrocarbure optiquement actif peut se produire par la réaction d’échange décrite dans la section 10-9.
Contributeurs et attributions
- John D. Robert et Marjorie C. Caserio (1977) Principes de base de la chimie organique, deuxième édition. W.A. Benjamin, Inc. , Parc de Menlo, CA. ISBN 0-8053-8329-8. Ce contenu est protégé par le droit d’auteur dans les conditions suivantes: « Vous êtes autorisé à la reproduction, à la distribution, à l’affichage et à l’exécution individuelles, éducatives, de recherche et non commerciales de cette œuvre dans n’importe quel format. »