7.18: Halogénures de vinyle et Halogénures d’Aryle
Substitution nucléophile dans les halogénures d’aryle
Nous examinerons en détail la structure du chlorobenzène. Le bromobenzène et l’iodobenzène sont identiques. Le moyen le plus simple de dessiner la structure du chlorobenzène est:
Pour comprendre correctement le chlorobenzène, vous devez creuser un peu plus profond que ça. Il y a une interaction entre les électrons délocalisés dans le cycle benzénique et l’une des paires isolées sur l’atome de chlore. Cela chevauche le système d’électrons en anneau délocalisé. . .
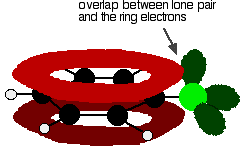
pour donner une structure plutôt comme ceci:
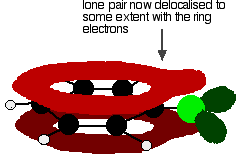
Cette délocalisation n’est en aucun cas complète, mais elle a un effet significatif sur les propriétés à la fois de la liaison carbone-chlore et la polarité de la molécule. La délocalisation introduit une liaison supplémentaire entre le carbone et le chlore, rendant la liaison plus forte. Cela a un effet majeur sur les réactions de composés comme le chlorobenzène.
Il y a aussi un certain mouvement des électrons loin du chlore vers l’anneau. Le chlore est assez électronégatif et attire généralement les électrons de la liaison carbone-chlore vers lui-même. Dans ce cas, cela est compensé dans une certaine mesure par le mouvement des électrons vers l’anneau lors de la délocalisation. La molécule est moins polaire que ce à quoi vous vous attendiez autrement.
Les halogénures d’aryle simples comme le chlorobenzène sont très résistants à la substitution nucléophile. Il est possible de remplacer le chlore par -OH, mais uniquement dans des conditions industrielles très sévères – par exemple à 200°C et 200 atmosphères. En laboratoire, ces réactions ne se produisent pas. Il y a deux raisons à cela – selon lequel des mécanismes ci-dessus vous parlez.
- La force supplémentaire de la liaison carbone-halogène dans les halogénures d’aryle: La liaison carbone-chlore dans le chlorobenzène est plus forte que prévu. Il y a une interaction entre l’une des paires isolées sur l’atome de chlore et les électrons du cycle délocalisé, ce qui renforce la liaison. Les deux mécanismes ci-dessus impliquent la rupture de la liaison carbone-halogène à un moment donné. Plus il est difficile de casser, plus la réaction sera lente.
- Répulsion par les électrons du cycle: Ceci ne s’appliquera que si l’ion hydroxyde attaque le chlorobenzène par un mécanisme comme le premier décrit ci-dessus. Dans ce mécanisme, l’ion hydroxyde attaque le carbone légèrement positif auquel l’atome d’halogène est attaché.Si l’atome d’halogène est attaché à un cycle benzénique, l’ion hydroxyde entrant va être confronté aux électrons du cycle délocalisés au-dessus et au-dessous de cet atome de carbone. L’ion hydroxyde négatif sera simplement repoussé. Ce mécanisme particulier est tout simplement un non-démarreur!