Cardiologie
- Anomalies septales ventriculaires
- Anatomie
- Physiopathologie
- Présentations cliniques
- Faire le diagnostic
- Histoire naturelle
- Prise en charge
- Anatomie du canal artériel patent
- Anatomie
- Physiopathologie
- Présentations cliniques
- Poser le diagnostic
- Histoire naturelle et gestion
- Les défauts septaux auriculaires (TSA)
- Anatomie
- Physiopathologie
- Présentation clinique
- Poser le diagnostic
- Prise en charge
- Défaut auriculo-ventriculaire (AVSD)
- Anatomie
- Physiopathologie
- Présentations cliniques
- Poser le diagnostic
- Prise en charge
Anomalies septales ventriculaires
Les anomalies septales ventriculaires isolées (VSD) constituent 25 à 30% de toutes les cardiopathies congénitales (CHD) chez les enfants. Le VSD peut être présent dans 50% des maladies coronariennes telles que la tétralogie de Fallot, le ventricule droit à double sortie, le tronc artériel et autres.
Anatomie
Environ 70% de tous les VSD sont présents dans la partie membraneuse du septum inter-ventriculaire, environ 20% sont dans la partie musculaire et les défauts restants se trouvent soit à l’entrée, soit à la sortie du septum ventriculaire. Le VSD d’entrée fait généralement partie d’un défaut septal auriculo-ventriculaire (canal AV). La sortie (supra-cristal) VSD est plus fréquente (environ 20%) dans la population orientale (ou population d’Asie de l’Est).
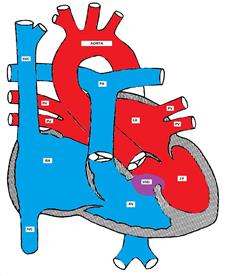
Figure montrant un défaut septal ventriculaire
Physiopathologie
Avec un VSD de petite taille, « VSD restrictif », la direction et l’amplitude du shunt dépendent sur la taille du VSD et le gradient de pression entre les ventricules gauche et droit. Le caractère restrictif du VSD maintient le gradient de pression entre les deux ventricules.
Avec un grand VSD, le trou n’est pas restrictif et la pression dans les deux ventricules est presque égale. La direction et l’amplitude du shunt dépendent de la différence relative entre les résistances vasculaires pulmonaires et systémiques. Dans la vie fœtale, la résistance pulmonaire est supérieure à la résistance systémique. Lorsque les poumons se dilatent au premier souffle, la résistance pulmonaire diminue de manière significative et le flux pulmonaire augmente. La résistance pulmonaire continue de diminuer jusqu’à atteindre le rapport adulte normal de 1: 10 d’ici 4 à 8 semaines (voir figure).
Un shunt prolongé de gauche à droite entraîne une augmentation progressive de la pression pulmonaire et une hypertension pulmonaire se développe éventuellement. Lorsque la différence de pression entre les systèmes systémique et pulmonaire diminue, le débit à travers le shunt diminue également. Si la résistance vasculaire pulmonaire dépasse la résistance vasculaire systémique, la direction du shunt s’inverse et une cyanose se développe (syndrome d’Eisenmenger). Cela peut se développer dans les deux ans chez les enfants autrement en bonne santé et dans l’année chez les patients atteints du syndrome de Down.
Présentations cliniques
Les enfants atteints d’un petit VSD sont généralement asymptomatiques. Un souffle cardiaque holosystolique ou decrescendo découvert par hasard est la présentation la plus courante. Le murmure est généralement découvert à l’âge de 2 à 4 semaines lorsque la résistance vasculaire pulmonaire diminue et que la différence de pression entre les deux ventricules devient remarquable (Figure). L’intensité du murmure est inversement proportionnelle à la taille du VSD en raison de la turbulence et de la vitesse d’écoulement accrues produites par un défaut plus petit. Un frisson peut être palpable dans certains cas. Le défaut peut être suffisamment petit pour presque se refermer à la fin d’un souffle decrescendo systolique.
Un nourrisson avec un grand VSD peut être asymptomatique dans les premiers jours / semaines de vie jusqu’à ce que la résistance vasculaire pulmonaire diminue. Lorsque la résistance pulmonaire diminue, le shunt de gauche à droite augmente. Le ventricule droit est ainsi soumis à une pression élevée et devient hypertrophié tandis que l’oreillette gauche et le ventricule gauche reçoivent plus de volume et se dilatent. L’oreillette droite n’est généralement pas affectée. L’insuffisance cardiaque congestive (ICC) peut se développer et se présenter sous forme de tachycardie, de tachypnée, de dyspnée d’effort, d’essoufflement et de transpiration pendant l’alimentation. La croissance de l’enfant est également souvent retardée en raison d’un mauvais apport calorique. Chez certains nourrissons, en particulier ceux atteints du syndrome de Down, la résistance vasculaire pulmonaire peut ne pas baisser de manière significative. Ces nourrissons peuvent ne pas développer d’ICC, mais courent un risque accru de développer une hypertension pulmonaire. Ils peuvent nécessiter une intervention chirurgicale plus précoce pour prévenir l’aggravation de l’hypertension pulmonaire et le développement précoce du syndrome d’Eisenmenger.
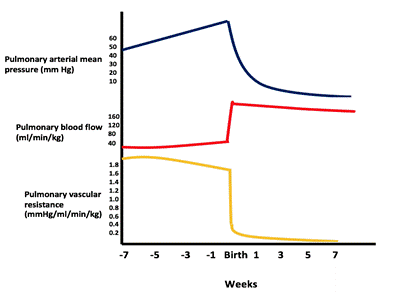
Figure montrant la baisse de la pression / résistance vasculaire pulmonaire et l’augmentation du flux sanguin pulmonaire après la naissance
Faire le diagnostic
- Un murmure holosystolique se fait entendre à la frontière sternale gauche en raison de turbulences à travers le VSD. L’intensité du murmure est inversement proportionnelle à l’ampleur du shunt; plus le shunt est petit, plus le murmure est fort et vice versa.
- Un souffle systolique decrescendo (précoce) peut indiquer un VSD petit et fermant. Il y a une diminution du débit dans la dernière partie de la systole et aucun murmure n’est entendu.
- Un murmure apical mi-diastolique (grondement) peut être entendu en raison de l’augmentation du débit à travers la valve mitrale (sténose mitrale relative). Cela indique que le VSD est suffisamment grand pour provoquer un flux sanguin pulmonaire excessif, ce qui indique cliniquement une insuffisance cardiaque congestive (ICC). Cet ICC n’est pas dû à un dysfonctionnement de la pompe comme chez l’adulte mais à l’augmentation du flux sanguin pulmonaire.
- Un murmure diastolique précoce entendu à la bordure sternale supérieure gauche en position assise pouvait être entendu dans un petit VSD membraneux ou supra-cristal. Cela indique une insuffisance aortique due à un prolapsus de l’une des cuspides de la valve aortique dans le VSD secondaire à l’aspiration créée par le jet à haute vitesse (effet Venturi).
- Un P2 fort avec une division étroite de S2 indique une augmentation de la pression vasculaire pulmonaire et de la résistance qui provoquerait une fermeture précoce de la valve pulmonaire.
- Un souffle diastolique précoce dû à une insuffisance pulmonaire peut être entendu si une hypertension pulmonaire se développe.
- L’hypertension pulmonaire diminue le flux sanguin pulmonaire et rend l’ICC peu probable (lune de miel avant le développement du syndrome d’Eisenmenger).
- Une cardiomégalie et une hépatomégalie peuvent être présentes si l’ICC est présente.
- Les radiographies thoraciques peuvent montrer une cardiomégalie et une vascularisation pulmonaire accrue.
- L’ECG reflète l’état hémodynamique et peut présenter une RVH, une hypertrophie de l’auriculaire gauche et une hypertrophie du ventricule gauche (l’ECG n’est pas très sensible pour différencier la LVH de la dilatation du LV). L’oreillette droite n’est généralement pas affectée.
- L’échocardiogramme montre l’emplacement, le type et la taille du VSD. Il peut également estimer le gradient de pression à travers le VSD. Les effets hémodynamiques du VSD sur différentes chambres peuvent être élucidés. Il est également important de rechercher une insuffisance aortique (en particulier dans la VSD membraneuse et supra-cristalline) qui peut indiquer une lésion précoce de la valve aortique.
- Un cathétérisme cardiaque est rarement nécessaire mais pourrait mesurer la pression / résistance pulmonaire et aider à déterminer la réactivité (et donc l’opérabilité) du système vasculaire pulmonaire en cas d’hypertension pulmonaire.
Histoire naturelle
Alors que plus de la moitié des VSD de petite et moyenne taille ferment spontanément, seulement environ 10% des VSD de grande taille ferment spontanément. Le VSD musculaire se ferme par la croissance musculaire. Le VSD membraneux se ferme par le tissu valvulaire tricuspide voisin qui forme un anévrisme qui s’endothélialise progressivement. Il est peu probable que les VSD d’entrée et de sortie supra-cristallines se ferment spontanément. Chez les patients non opérés avec un grand VSD, le syndrome d’Eisenmenger peut se développer dans les deux ans, mais peut se développer dès un an chez les patients atteints du syndrome de Down. Cela pourrait être attribué à l’augmentation de la densité vasculaire / alvéolaire et à l’augmentation de la sécrétion d’endostatine chez les patients atteints du syndrome de Down.
Prise en charge
Les enfants asymptomatiques atteints d’un VSD de petite ou moyenne taille n’ont besoin que de soins de soutien, dans l’espoir que le VSD fermera dans les premières années de leur vie. Si l’ICC se développe, le traitement consiste en des diurétiques, des agents réducteurs de postcharge tels que les inhibiteurs de l’ECA et éventuellement de la digoxine. L’insuffisance cardiaque dans les shunts de gauche à droite est due à une surcharge volumique de la circulation pulmonaire. Cela contraste avec les adultes atteints d’infarctus du myocarde chez lesquels l’insuffisance cardiaque est due à un dysfonctionnement de la pompe. Chez les adultes souffrant d’insuffisance cardiaque, la digoxine est utilisée pour améliorer la fonction de la pompe. Cependant, si la digoxine est utilisée dans le traitement de l’ICC en raison d’un shunt de gauche à droite, son effet cholinergique diminue principalement la fréquence cardiaque. La restriction hydrique doit être évitée car elle réduit l’apport calorique et retarde la croissance.
L’oxygénothérapie doit également être évitée car il s’agit d’un vasodilatateur pulmonaire et d’un vasoconstricteur systémique. Cela aggraverait le shunt de gauche à droite et les symptômes de CHF. Les patients atteints d’ICC persistante ou ceux qui développent une hypertension pulmonaire nécessitent une fermeture chirurgicale du VSD. Si un patient n’est pas un candidat approprié pour une intervention chirurgicale, le baguage des artères pulmonaires doit être envisagé jusqu’à ce que la chirurgie puisse être pratiquée (généralement au cours de la première année de vie). Récemment, des techniques de trans-cathéter ont été utilisées pour fermer les VSD (en particulier les VSD musculaires).
Anatomie du canal artériel patent
Anatomie
Le canal artériel, formé à partir du 6ème arc aortique embryonnaire, relie l’aorte à l’artère pulmonaire. Il se ferme normalement quelques jours après la naissance. Une tension élevée en oxygène et une diminution des prostaglandines endogènes sont des facteurs importants pour induire la fermeture canalaire. Pour la même raison, les inhibiteurs de la prostaglandine synthétase tels que l’indométacine sont efficaces pour induire la fermeture canalaire et sont couramment utilisés pendant la période néonatale, en particulier chez les prématurés.
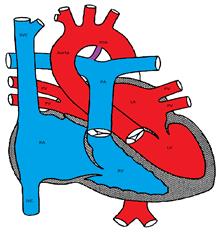
Figure montrant un Canal Artériel breveté
Physiopathologie
L’échec de la fermeture du canal artériel entraîne des modifications hémodynamiques similaires à ceux vus dans VSD. La direction et l’étendue du shunt dans le PDA dépendent de la taille du PDA et des résistances vasculaires systémiques et pulmonaires relatives.
Présentations cliniques
Le PDA est plus fréquent chez les femmes, les prématurés, les patients atteints du syndrome de Down et du syndrome de rubéole congénitale. Les symptômes sont similaires à ceux trouvés dans VSD et dépendent de la taille du shunt et de la direction de l’écoulement. Alors qu’un petit PDA est généralement asymptomatique, un grand PDA avec un shunt important de gauche à droite peut entraîner une ICC et éventuellement une hypertension pulmonaire.
Poser le diagnostic
- Chez les enfants plus âgés, le PDA produit classiquement un murmure continu ou « mécanique » dû à l’écoulement à travers le shunt tout au long du cycle cardiaque. Chez les nouveau-nés, en particulier ceux nés prématurément, le murmure ne peut être entendu que pendant la systole car la pression artérielle pulmonaire plus élevée diminue le débit pendant la diastole.
- Un souffle apical mi-diastolique peut être entendu en raison de l’augmentation du débit à travers la valve mitrale (sténose mitrale relative). Cela signifie généralement un PDA important et est souvent associé à CHF.
- La pression d’impulsion large indique un shunt important de gauche à droite dû à une chute soudaine de la pression diastolique.
- Dans un petit PDA, l’ECG est généralement normal. Dans un grand PDA, l’ECG démontrera une hypertrophie ventriculaire droite, une hypertrophie ventriculaire gauche et auriculaire gauche due à une surcharge volumique.
- Les radiographies thoraciques peuvent montrer une vascularisation pulmonaire accrue et une cardiomégalie due à une hypertrophie auriculaire gauche et ventriculaire gauche. La taille du cœur peut être normale si le shunt est petit.
Histoire naturelle et gestion
Les PDA de petite et moyenne taille se ferment souvent spontanément, en particulier chez les nourrissons nés à terme. Le PDA chez les prématurés peut nécessiter un traitement à l’indométacine (au cours des 2 à 4 premières semaines de vie) ou une ligature chirurgicale. La fermeture du dispositif transcathéter du PDA est couramment utilisée chez les enfants plus âgés.
Les défauts septaux auriculaires (TSA)
Anatomie
Les défauts septaux auriculaires impliquent de nombreuses parties différentes du septum auriculaire. Le défaut de septum secundum est le plus fréquent et comprend 6 à 10% de tous les MC. Il est situé dans la fosse ovale, à l’emplacement du foramen ovale. Le défaut septal primum est considéré comme une forme partielle de défaut septal auriculo-ventriculaire. Les autres types de TSA « moins courants » sont le sinus venosus et le non-toiture du sinus coronaire.
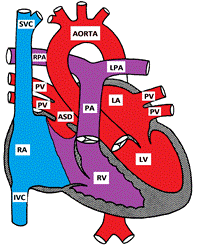
Figure montrant un défaut Septal auriculaire Secundum
Physiopathologie
Étant donné que la différence de pression entre les deux oreillettes est faible, aucune turbulence n’est générée par le flux à travers le TSA. Dans les TSA modérés à importants, la direction et l’ampleur du shunt à travers le TSA dépendent des conformités ventriculaires droite et gauche relatives. Au début de la petite enfance, la compliance ventriculaire droite est faible et le shunt à travers le TSA est faible. Lorsque la compliance ventriculaire droite augmente, le shunt de gauche à droite augmente. Si la compliance ventriculaire droite diminue, plus tard dans la vie, le shunt diminue. Le shunt peut éventuellement s’inverser si le patient développe une hypertension pulmonaire et un syndrome d’Eisenmenger. Cela prend généralement quelques décennies à se développer.
Présentation clinique
Les TSA sont généralement asymptomatiques et se manifestent généralement par un souffle cardiaque à l’âge préscolaire. L’CHF se développe rarement chez les patients présentant un TSA important. L’étirement de l’auriculaire droit peut provoquer des arythmies auriculaires. Une surcharge volumique prolongée des poumons provoque éventuellement une hypertension pulmonaire, qui peut prendre de 4 à 5 décennies à se développer.
Poser le diagnostic
- Un souffle d’éjection systolique peut être entendu dans la région pulmonaire en raison de l’augmentation du débit à travers la valve pulmonaire (sténose pulmonaire relative).
- Un souffle diastolique moyen peut être entendu à la bordure sternale inférieure gauche en raison de l’augmentation du débit à travers la valve tricuspide. Ce murmure est rarement entendu car l’anneau valvulaire tricuspide est plus grand que l’anneau valvulaire pulmonaire. Un murmure de valve tricuspide indique que le patient est en CHF en raison d’un grand shunt de gauche à droite.
- Aucun murmure ne se développe en raison de l’écoulement à travers le TSA car il n’y a qu’un gradient de pression minimal entre les deux oreillettes et aucune turbulence n’est générée.
- Une large division de S2 est due à une fermeture retardée de P2 secondaire à une augmentation du débit à travers la valve pulmonaire.
- La division de S2 est « fixe » et ne varie pas avec la respiration. Cela est dû à une diminution des effets du cycle respiratoire sur le volume ventriculaire droit. En inspiration, le retour veineux vers l’oreillette droite augmente et entrave le shunt gauche à droite à travers le TSA. À l’expiration, le retour veineux vers l’oreillette droite diminue et le shunt à travers le TSA augmente. Dans les deux cas, le volume de sang dans le ventricule droit est augmenté et reste inchangé à la fois en inspiration et en expiration.
- L’ECG peut démontrer une hypertrophie auriculaire droite, un retard de conduction ventriculaire droite (bloc de branche incomplet du faisceau droit), une dilatation ventriculaire droite et une déviation de l’axe droit.
- La radiographie thoracique montre une vascularisation pulmonaire accrue, une hypertrophie auriculaire droite et ventriculaire droite.
Prise en charge
La plupart des patients atteints de TSA sont asymptomatiques et aucune prise en charge médicale spécifique n’est nécessaire. Une prise en charge médicale (comme dans VSD) peut être nécessaire en cas de CHF. La fermeture du trans-cathéter est la méthode préférée pour fermer le secundum ASDs. Une fermeture chirurgicale peut être nécessaire chez les patients présentant un TSA secundum important qui ne se prête pas à la fermeture du trans-cathéter ou à d’autres types de TSA car il est peu probable qu’ils se ferment spontanément.
Défaut auriculo-ventriculaire (AVSD)
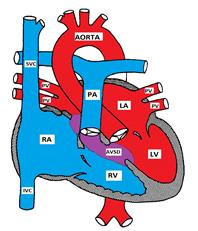
Figure Montrant un Défaut Septal auriculo-ventriculaire
L’AVSD survient dans 2% de toutes les maladies coronariennes et est plus prévalent chez les patients atteints du syndrome de Down. Quarante pour cent des enfants atteints du syndrome de Down ont une coronaropathie et 40% des défauts sont des formes d’AVSD
Anatomie
Un défaut septal auriculo-ventriculaire est également appelé défaut du coussin endocardique (ECD) et canal auriculo-ventriculaire (AVC). Il se compose d’une variété de défauts dans les coussins endocardiques qui forment la partie inférieure du septum auriculaire, la partie supérieure (entrée) du septum ventriculaire et les parties médiales des valves AV.
Il y a 4 types possibles:
a) L’AVSD partiel (TSA primum) consiste en un défaut dans la partie inférieure du septum auriculaire et est généralement associé à une fente dans la foliole mitrale antérieure provoquant une insuffisance mitrale. Le septum ventriculaire est généralement intact.
b) L’AVSD complet présente un défaut qui s’étend de la partie inférieure du septum auriculaire à la partie supérieure (entrée) du septum ventriculaire. Les valves mitrale et tricuspide perdent leurs points d’ancrage dans le septum ventriculaire et sont plutôt attachées l’une à l’autre, formant une valve AV commune qui surplombe le septum ventriculaire.
c) L’AVSD intermédiaire est similaire à l’AVSD complet mais dispose de 2 vannes AV avec un TSA primum et un VSD à grande entrée.
d) L’AVSD transitoire est similaire à l’AVSD intermédiaire mais le VSD est petit.
Physiopathologie
La physiopathologie dépend de la lésion prédominante (auriculaire vs ventriculaire). Il y a un shunt de gauche à droite au niveau de l’oreillette en raison d’une augmentation de la compliance ventriculaire droite relative conduisant à une hypertrophie de l’oreillette droite. L’élargissement de l’auriculaire gauche se produit en raison d’une insuffisance mitrale secondaire à la fente de la valve mitrale. Il existe un degré variable d’hypertension pulmonaire car le système vasculaire pulmonaire est exposé à un volume sanguin excessif à des pressions plus élevées. L’hypertension pulmonaire peut se développer au cours des deux premières années chez les patients normaux et la première année chez les patients atteints du syndrome de Down.
Présentations cliniques
La présentation clinique de l’AVSD est variable et dépend de la taille du défaut et du degré du shunt gauche à droite. Les patients atteints d’AVSD complet présentent généralement une insuffisance cardiaque congestive au cours des premières semaines de vie, tandis que ceux atteints d’AVSD partiel (TSA primum) peuvent être complètement asymptomatiques.
Les symptômes de l’ICC comprennent une mauvaise alimentation, un essoufflement, une diaphorèse pendant l’alimentation et une faible prise de poids. Une cyanose légère peut rarement se développer en raison d’un shunt de droite à gauche dû à une résistance pulmonaire accrue ou à un flux préférentiel du sang veineux de l’IVC vers l’oreillette gauche.
Poser le diagnostic
- Les résultats physiques sont variables et dépendent de la présence ou de l’absence d’insuffisance cardiaque congestive. Le précordium peut être hyper-dynamique et l’apex cardiaque peut être déplacé en dessous et vers la gauche.
- Les résultats auscultatoires sont également variables et peuvent inclure un souffle d’éjection systolique dû à un débit accru à travers la valve pulmonaire avec une division large et fixe de S2 comme dans les TSA. Un S2 fort et unique indique une hypertension pulmonaire.
- D’autres résultats auscultatoires incluent un souffle mi-diastolique à la bordure sternale inférieure gauche en raison d’un écoulement accru à travers la valve tricuspide, un souffle holosystolique apical rayonnant vers l’aisselle gauche en raison d’une insuffisance mitrale et un souffle holosystolique de VSD.
- L’ECG est caractérisé par une déviation de l’axe gauche due au déplacement inférieur et postérieur du nœud AV (anatomique). Il peut également présenter une hypertrophie ventriculaire droite (due à une pression accrue), une hypertrophie auriculaire droite et une HVG. Un intervalle PR prolongé (bloc cardiaque au premier degré) probablement dû à une conduction anormale du nœud AV peut être présent.
- La radiographie thoracique montre des degrés variables de cardiomégalie et une vascularisation pulmonaire accrue.
- L’échocardiographie est utile pour démontrer les lésions anatomiques et les anomalies associées. Il est essentiel d’évaluer l’intégrité des vannes AV.
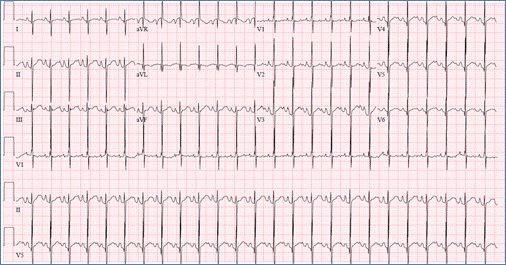
ECG montrant une déviation supérieure de l’axe QRS (négative en avF) et ventriculaire droit
l’hypertrophie de l’AVSD
Prise en charge
L’CHF, si elle est présente, est prise en charge par des diurétiques, des inhibiteurs de l’ECA et occasionnellement par la digoxine. Une formule à haute densité calorique doit être utilisée sans restriction de liquide.
Presque tous les patients atteints d’AVSD auront besoin d’une intervention chirurgicale. Le moment de la chirurgie dépend de la taille du patient, de la présence d’ICC, de la réponse à la prise en charge médicale et de la présence ou de l’absence d’hypertension pulmonaire. Chez les patients asymptomatiques atteints d’AVSD partiel, la chirurgie peut être retardée jusqu’à l’âge préscolaire. La chirurgie corrective est généralement pratiquée chez des patients symptomatiques présentant une CHF intraitable au cours des premiers mois de la vie. Même chez les patients qui répondent à une prise en charge médicale, la présence du syndrome de Down nécessite une intervention chirurgicale précoce pour prévenir le développement d’une hypertension pulmonaire. Si la chirurgie ne peut pas être pratiquée chez un patient symptomatique, le baguage artériel pulmonaire peut aider à limiter le flux sanguin pulmonaire jusqu’à ce qu’une réparation chirurgicale soit possible.