Frontières en Médecine cardiovasculaire
Introduction
Lors de l’examen des systèmes de coordonnées pouvant être utilisés pour différentes entités biologiques, des caractéristiques spécifiques doivent être prises en compte. Par exemple, le nombre de chromosomes et la position de la paire de bases forment un système de coordonnées linéaires suffisant pour définir l’emplacement dans le génome de référence (1). Cependant, un système de coordonnées pour l’ensemble du corps humain, qui peut répondre aux besoins de HuBMAP, HCA, HPA et d’autres efforts de cartographie, est beaucoup plus complexe pour plusieurs raisons (2-5). Premièrement, les cellules vivent en trois dimensions; et des informations supplémentaires sont nécessaires pour décrire la taille et l’orientation de rotation de tout échantillon de tissu utilisé pour générer les données. Deuxièmement, alors que la position des paires de bases du génome ne dépend pas de la façon dont l’ADN est plié et emballé dans le noyau, les positions des éléments individuels (p. ex., cellules, organes) dans le corps sont dynamiques, car ils peuvent changer avec les mouvements squelettiques et musculaires, la gravité, la respiration, le battement du cœur et d’autres fonctions et forces qui déforment les tissus. Troisièmement, bien que la variabilité de l’ADN entre les personnes soit < de 1%, la géométrie du corps humain couvre une large gamme de hauteurs, de poids et de formes, qui varient selon le sexe et la race et changent de manière significative au cours de la durée de vie d’une personne.
Une option consiste à utiliser un système de coordonnées cartésiennes 3D pour décrire la position dans le corps. Les systèmes de coordonnées cartésiennes ont l’avantage d’être familiers et faciles à comprendre. Avec le corps en position anatomique standard, les axes gauche-droite, caudal-crânien et postérieur-antérieur forment trois axes perpendiculaires (x-y-z). Pour les analyses à plus petite échelle, centrer l’origine sur un repère anatomique pourrait être le plus utile et potentiellement moins variable entre différentes personnes. Par exemple, il serait plus facile de mesurer la distance d’un échantillon de tissu entre le rein et le pôle supérieur du rein que le sommet de la tête d’une personne. L’inconvénient des coordonnées cartésiennes est que ses axes ne suivent pas la forme naturelle du corps. En conséquence, la création d’une carte corporelle de référence en « assemblant » numériquement des échantillons de tissus collectés auprès de personnes de différentes tailles nécessiterait un processus complexe de déformation, de rotation et d’alignement des données. Faire cela d’une manière qui s’adapte à l’ensemble du corps tout en maintenant une précision au niveau cellulaire serait extrêmement difficile.
D’autres systèmes de coordonnées 3D ont été développés pour différentes applications. Par exemple, les coordonnées sphériques, avec des axes représentant la latitude, la longitude et l’altitude, décrivent commodément l’emplacement à la surface de la Terre. Un chemin simple en coordonnées sphériques, tel que « 1 km à l’est », est beaucoup plus difficile à communiquer en utilisant des coordonnées cartésiennes. De même, les systèmes de coordonnées du corps humain devraient idéalement avoir des axes qui suivent des structures anatomiques, des modèles d’expression génétique, des gradients chimiques et / ou d’autres voies biologiquement pertinentes. Plusieurs systèmes de coordonnées spécifiques aux organes ont été développés, tels que les coordonnées de Talairach pour l’imagerie cérébrale fonctionnelle, mais ceux-ci ne s’étendent pas à l’ensemble du corps (6).
Système de coordonnées vasculaires
En 2017, une réunion du Cadre de coordonnées commun (CCF) a été organisée par les National Institutes of Health, le Broad Institute, le Sanger Institute et l’Initiative Chan Zuckerberg. Les participants à la réunion, qui comprenaient des anatomistes, des pathologistes, des cliniciens et des experts en technologie du monde entier, ont suggéré plusieurs approches pour cartographier les cellules du corps humain, y compris des systèmes de coordonnées anatomiques (7). L’un d’eux, qui utilise le système vasculaire, a été discuté lors d’un atelier CCF 2019, spécifiquement pour la localisation des cellules rénales (8). Dans ce manuscrit, nous présentons un aperçu conceptuel de ce système de coordonnées vasculaire et décrivons ses avantages et ses limites (figure 1).
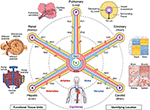
Figure 1. La structure de moyeu et de rayon d’un système de coordonnées vasculaires. Le système de coordonnées vasculaires se compose de boucles de vaisseaux représentatives qui commencent et se terminent dans les chambres du cœur et s’étendent aux unités fonctionnelles de chaque organe (dans le sens antihoraire en haut à gauche: alvéoles, glomérules et lobules hépatiques). L' »adresse » d’une cellule comprend le nom de la boucle (par exemple, « R » pour rénale et « H » pour hépatique) et le niveau de ramification du vaisseau le plus proche (par exemple, « RA1 » pour les artérioles afférentes dans la boucle rénale). Notez que les parois du cœur se trouvent le long de la boucle vasculaire coronaire (« C ») et que les cellules de certaines structures internes au cœur sont en fait positionnées à la périphérie du système de coordonnées, près des capillaires qui leur fournissent du sang. Il existe plusieurs façons d’identifier une position « semblable à celle du GPS » encore plus précise, y compris, en allant dans le sens des aiguilles d’une montre en haut à droite, l ‘ »empreinte d’hypoxie » qui résulte de la diminution des niveaux d’oxygène plus loin du vaisseau, l ‘ »empreinte histologique » unique et l' »empreinte d’expression génique » dans différents types de cellules endothéliales vasculaires, et l' »empreinte d’architecture vasculaire » distinctive trouvée dans différents types de tissus. Le système vasculaire s’étend à toutes les parties du corps (en bas) et encadre tous les organes à toutes les échelles. Fichiers Sources: Les images des lobules hépatiques, des glomérules, des alvéoles, de la carte thermique de l’expression génique et du système vasculaire du corps entier sont adaptées de Wikimedia Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (Domaine public); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (licence CC BY 3.0); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (Domaine public); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (licence CC BY-SA 4.0); et, https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (Domaine public). Carte thermique de l’expression génique recréée à partir de Guo et al. (9) en utilisant des données simulées. Architecture vasculaire basée sur Bosetti et al. (10) (licence CC BY 4.0).
Le but d’un système de coordonnées vasculaires n’est pas de construire une carte du système vasculaire. L’idée est plutôt d’utiliser les voies vasculaires connues à travers le corps comme axe dans un système de coordonnées pouvant décrire la position des éléments anatomiques, tels que les cellules, dans le tissu entourant le système vasculaire. Dans ce cadre proposé, les cavités du cœur peuvent être considérées comme l’origine de la carte du corps entier. L’axe vasculaire contient des boucles vasculaires (comparables aux « routes » dans la métaphore de Google Map) qui s’étendent à travers l’aorte ou l’artère pulmonaire, se rétrécissent progressivement pour atteindre la taille d’une seule cellule à mesure qu’elles s’approchent de toutes les autres cellules de chaque organe du corps et retournent au cœur. Le long de ces voies, le système vasculaire suit la biologie unique des divers organes et tissus; et, de même, les organes et les tissus du corps ne pourraient exister sans les propriétés uniques de leur système vasculaire étroitement intégré.
Tout comme la carte du génome déplie l’ADN en une séquence linéaire, nous pouvons imaginer dérouler les torsions 3D complexes de l’axe du système vasculaire en une forme 2D plus simple en « hub-and-spoke » avec les chambres du cœur au centre. Cette représentation schématique du système vasculaire facilite (1) la description de l’emplacement dans le corps; (2) l’alignement des voies vasculaires avec des formes 3D variables mais une fonction équivalente de différentes personnes; (3) l’identification de modèles tels que des changements de type cellulaire et d’expression génique lorsque l’on passe de vaisseaux plus grands à plus petits dans un organe (le long d’un rayon).; et, (4) comparez les tissus au même niveau (par exemple, les capillaires) dans différents organes (à travers les rayons).
Un organe, tel que le rein, a des dizaines de milliers de voies vascularisées si chaque capillaire est considéré distinctement. Cependant, afin de rendre possible la construction d’un CCF, nous formulerons une hypothèse simplificatrice supplémentaire selon laquelle bon nombre de ces voies sont indiscernables les unes des autres. Notamment, les plus petits vaisseaux (capillaires) sont au centre des petites unités fonctionnelles spécialisées de chaque organe (p.ex., lobules hépatiques dans le foie, glomérules dans le rein et alvéoles dans le poumon). Un organe entier nécessite un grand nombre de ces unités fonctionnelles centrées sur les vaisseaux qui sont anatomiquement et physiologiquement similaires (11). Cette similitude peut être utilisée pour réduire de nombreuses voies vasculaires en quelques voies représentatives (Figure 2). À l’avenir, à mesure que nous en apprendrons davantage sur les profils biomoléculaires de ces voies, nous pourrons affiner le CCF en divisant les voies en tous les sous-types découverts.

Figure 2. Déroulement de la voie vasculaire rénale jusqu’au niveau d’une seule cellule. Une voie vasculaire représentative pénètre dans le rein par l’artère rénale, traverse le glomérule et retourne dans la veine rénale. À l’échelle macroscopique (à gauche) et à la méso-échelle (au centre), les étiquettes dans les boîtes jaunes sont des structures anatomiques qui correspondent à différents vaisseaux le long de cette boucle. À l’échelle microscopique (à droite), les étiquettes dans les boîtes jaunes sont différents types de cellules qui se trouvent à une courte distance d’un vaisseau voisin dans le glomérule. La position des cellules individuelles peut être décrite par l’adresse du navire le plus proche (p. ex., « RA0 » pour glomérule capillaire), la distance en micromètres ou le nombre de cellules de l’endothélium du vaisseau et un angle perpendiculaire à la longueur du vaisseau (par exemple, « RA0-10 µm-135 ° » ou « RA0-1c-135° »). À l’extrême droite, chaque vaisseau et son tissu environnant ont été extraits de l’image originale et alignés verticalement pour permettre de voir facilement comment les types de cellules et la distribution changent le long de la voie vasculaire. Dans cet exemple, les images alignées ont également été tournées de sorte que le centre du glomérule soit toujours à droite. Fichiers Sources: Les images du rein et du glomérule sont adaptées de Wikimedia Commons : https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg (licence CC BY 3.0) ; et https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (licence CC BY-SA 4.0).
Une « adresse » d’une cellule individuelle dans un système de coordonnées vasculaires comporte quatre composantes. (1) Le premier est le vaisseau anatomiquement nommé le plus proche qui identifie le plus précisément une boucle vasculaire (le territoire vasculaire ou « bassin versant »), comme l’artère rénale droite. (2) La composante suivante représente le niveau de ramification du navire. Dans le rein, les exemples de proximal à distal incluent les artères interlobaires, les artères rayonnées corticales, les artérioles afférentes et les capillaires glomérulaires. Le niveau de ramification peut également être défini numériquement, avec des capillaires au niveau zéro, et des niveaux supérieurs avec des nombres plus importants. (3) Le troisième composant est la distance perpendiculaire en micromètres ou en nombre de cellules de la couche endothéliale du vaisseau. (4) Un quatrième élément facultatif pourrait être l’angle de rotation perpendiculaire à la longueur du bateau. Zéro degré peut être défini de plusieurs façons en fonction de l’application. Par exemple, il peut être relatif à un marqueur sur l’échantillon de tissu, ou il peut pointer vers une structure anatomique, telle que le centre du glomérule le plus proche dans le rein. L’utilité et la nécessité de ces composants devraient être confirmées par des essais expérimentaux.
Une autre approche consiste à utiliser des cellules endothéliales comme « cellules d’ancrage » pour identifier les positions relatives des autres cellules de manière GPS. L’endothélium tapisse tout le système vasculaire. Des types distincts de cellules endothéliales (EC) apparaissent dans différentes parties du système vasculaire, qui peuvent être détectés histologiquement par des caractéristiques cellulaires uniques et des cellules voisines (l' »empreinte histologique »), ainsi que par l’analyse de leurs profils génétiques spécifiques (l' »empreinte d’expression génique », carte thermique de la figure 1) (9, 12, 13). Schéma organisationnel vasculaire, complexité de la ramification, diamètre, etc. fournir des caractéristiques reconnaissables supplémentaires qui forment une « empreinte d’architecture vasculaire » pour chaque tissu (figure 1 images de vascularisation fluorescentes en fausse couleur) (10, 14). Chaque tissu a des gradients d’oxygène spécifiques, qui peuvent être utilisés pour déterminer la distance du vaisseau. Lorsque PO2 ne peut pas être mesuré directement, on peut déduire la distance cellulaire des gradients d’induction / expression de gènes inductibles par l’hypoxie dans divers types de cellules (« empreinte d’hypoxie », Figure 1 vue transversale d’un vaisseau) (15-17).
Avantages d’un CCF vasculaire
Un système de coordonnées vascularisées a un sens biologiquement. Chaque cellule vivante doit se trouver dans un petit rayon du vaisseau sanguin le plus proche (100 µm à 1 mm, selon le tissu) afin de recevoir de l’oxygène (18); et, chaque vaisseau est tapissé par la même couche continue d’endothélium (19). Ainsi, le système vasculaire forme une voie ininterrompue qui atteint toutes les parties du corps, s’effilochant de manière transparente à travers les échelles, de l’échelle macroscopique (corps entier / clinique) à la méso-échelle à l’échelle microscopique (vaisseaux capillaires de taille cellulaire unique). Dans le cadre de cela, il gère la transition progressive des grandes artères et veines, qui sont conservées chez la plupart des gens, jusqu’aux millions de vaisseaux microscopiques reconnaissables par catégorie (par exemple, glomérule capillaire) mais pas par des noms individuels. Le système vasculaire s’adapte à la taille et à la forme individuelles du corps, en tenant compte des variations interindividuelles (20, 21). Il définit la forme des unités fonctionnelles dans différents organes, tels que les lobules du foie, les glomérules rénaux et les alvéoles pulmonaires. Le développement normal d’un nouveau tissu commence par la formation de vaisseaux avant que d’autres types de cellules puissent se développer autour de lui (22).
Le système vasculaire atteint également tous les organes, tissus et cellules de manière contiguë. D’autres structures anatomiques ne semblent pas avoir une polyvalence similaire. Par exemple, le système squelettique s’étend à tout le corps; cependant, la distance entre une cellule dans un organe et l’os le plus proche peut être de plusieurs centimètres, et il est peu probable que cet os fasse partie de l’organe, et encore moins susceptible de faire partie d’un échantillon de tissu. Le système nerveux suit bon nombre des mêmes voies que les vaisseaux plus gros dotés de propriétés contractiles, mais on ne sait pas s’ils s’étendent pour suivre les vaisseaux plus petits qui atteignent toutes les cellules tissulaires. Ainsi, contrairement à la dépendance des cellules à l’oxygène, il n’y a pas de garantie que chaque cellule se trouve à proximité d’un nerf. Les systèmes de référence spécifiques aux organes sont basés sur des caractéristiques structurelles uniques qui n’existent que dans cet organe individuel (par exemple, des régions spécifiques du cerveau) et sont peu susceptibles d’être utiles pour représenter les emplacements des cellules ailleurs dans le corps.
Il existe de nombreux avantages pratiques d’un système de coordonnées vasculaires. Les voies vasculaires dans tous les organes ont été largement étudiées et sont décrites en détail dans la littérature. Ils sont utiles, bien connus et ont des noms normalisés dans de nombreux domaines spécialisés. Les schémas de vascularisation tissulaire sont utilisés cliniquement pour diagnostiquer la maladie; et, les vaisseaux sont utilisés en chirurgie et biopsies comme principaux repères anatomiques et pour définir des « territoires vasculaires » (23, 24). Bien que la position exacte dans l’espace cartésien 3D puisse être difficile à déterminer pour un échantillon de tissu réséqué, le chirurgien sera généralement en mesure d’indiquer quel bassin versant vasculaire comprenait le spécimen.
Limites d’un CCF vasculaire
Le seul fait de connaître les paires de bases dans une séquence génomique ne fournit pas suffisamment d’informations pour déterminer comment l’ADN est replié dans une cellule particulière. De même, bien que le système de coordonnées vasculaires déplié puisse décrire la relation spatiale 3D des cellules voisines à l’échelle microscopique, les chemins sinueux empruntés par les vaisseaux et la distance relative entre les cellules à de plus grandes échelles sont perdus. Des informations sur les structures à plus grande échelle pourraient être obtenues en intégrant l’imagerie clinique et la structuration histologique et moléculaire.
Certaines informations positionnelles supplémentaires sont perdues par l’effondrement des voies vasculaires. Par exemple, un système de coordonnées vasculaires pourrait initialement traiter tous les capillaires du glomérule dans le rein comme la même structure, masquant potentiellement les différences de glomérules aux pôles rénaux supérieur et inférieur. Cependant, à mesure que nous en apprenons plus sur les profils biomoléculaires de ces voies, nous pouvons affiner de manière itérative le CCF vasculaire au fil du temps en divisant les voies en tous les sous-types découverts.
Malgré ces limitations, un système de coordonnées vasculaires conserve suffisamment d’informations de position pour répondre à de nombreux types de questions de recherche, en permettant aux chercheurs de localiser précisément des cellules individuelles au sein d’unités fonctionnelles, de tissus et d’organes, ou de comparer les effets du contexte sur divers types de cellules à travers tout le corps aux échelles macro et méso.
Prochaines étapes et Orientations futures
Dans la figure 1, nous présentons une représentation très simplifiée et stylisée du CCF vasculaire afin d’introduire le concept général. Les voies vasculaires réelles sont beaucoup plus complexes, le CCF vasculaire complet comprenant finalement des centaines ou des milliers de structures ainsi que des motifs de ramification qui ne suivent pas une disposition stricte en hub et en rayons. Par exemple, les veines du système portail hépatique, qui transportent le sang de plusieurs organes vers le foie, et les anastomoses circulatoires, telles que le cercle de Willis dans le cerveau, passeraient perpendiculairement aux « rayons » de la figure 1.
Le CCF vasculaire devra également incorporer des variantes anatomiques normales du système vasculaire, telles que les thyroidea ima et les artères kystiques doubles, de la même manière que les polymorphismes nucléotidiques simples (SNP) décrivent des variations normales du génome. Au fur et à mesure que nous développons et remplissons les détails du CCF vasculaire, il pourrait prendre une apparence plus flocon de neige ou semblable à une toile, avec des probabilités attribuées à différentes sections pour indiquer la probabilité de les trouver chez une personne donnée.
Le CCF vasculaire réel nécessitera un schéma de codage plus sophistiqué pour nommer les vaisseaux que ce qui est illustré à la figure 1, afin de représenter sa complexité avec plus de précision et de la rendre « calculable » par des algorithmes logiciels. Une approche consiste à s’appuyer sur des ontologies anatomiques existantes, telles que UBERON, qui contient déjà des identifiants de ressources uniformes uniques (URI) pour de nombreux vaisseaux et définit divers types de relations, tels que « branching_part_of », pour décrire comment les vaisseaux se connectent (25).
Une cellule peut être à proximité de plus d’un navire, auquel cas il est possible de lui attribuer une adresse distincte par rapport à chaque navire. Des recherches futures sont nécessaires pour déterminer quelle devrait être la distance de « coupure » appropriée. Il peut être souhaitable de stocker plusieurs adresses pour les cellules pour aider à trianguler leur position dans l’espace 3D.
Bien que notre motivation initiale pour un CCF vasculaire soit de définir un système de coordonnées pour spécifier l’emplacement des cellules, la nouvelle disposition radiale du corps humain autour du vasculaire, telle qu’illustrée à la figure 1, pourrait avoir d’autres applications scientifiques. Par exemple, les informations de position dans ce cadre ont des analogies avec le développement embryologique et pourraient fournir un aperçu des mécanismes responsables de maladies ou de dérèglements provenant d’un groupe de cellules. Par exemple, dans le CCF vasculaire, les maladies macrovasculaires associées au diabète de type 2 (par exemple, cardiopathie ischémique, maladie vasculaire périphérique et maladie cérébrovasculaire) sont regroupées près du centre, tandis que les maladies microvasculaires (par exemple, rétinopathie, néphropathie et neuropathie) forment un anneau autour de l’extérieur (26).
Résumé
Le système vasculaire possède plusieurs propriétés qui répondent aux caractéristiques précédemment jugées souhaitables pour un CCF permettant de cartographier toutes les cellules du corps humain (7). (1) Cela fonctionne à plusieurs échelles. Grâce à un endothélium continu, il effectue une transition transparente des grandes structures anatomiques au niveau cellulaire. (2) Il est applicable à tous les tissus corporels. Parce que les organes se développent autour des vaisseaux, le système vasculaire encadre l’architecture des organes à toutes les échelles. Les motifs vasculaires sont si distinctifs que des images de vaisseaux seuls, avec toutes les autres cellules enlevées, peuvent facilement être utilisées pour identifier l’organe. (3) Il tient compte des différences entre les donateurs. La vascularisation s’adapte naturellement aux variations individuelles des tissus, de la taille et de la forme du corps. Au lieu d’avoir à mapper les coordonnées 3D de chaque glomérule chez une personne à celles d’une autre personne, le CCF vasculaire positionnerait chaque cellule dans un capillaire glomérulaire représentatif de chaque personne. (4) Le système vasculaire est bien connu des praticiens de nombreuses spécialités cliniques différentes, aidant à la fois à diagnostiquer la maladie et à guider les chirurgies, et utilisé comme point de repère par les pathologistes, les radiologues et d’autres cliniciens. Cela faciliterait le positionnement des échantillons de tissus dans le corps et l’enregistrement de l’emplacement des cellules individuelles. Bien qu’aucun CCF unique ne soit idéal pour tous les cas d’utilisation, un CCF vasculaire définit un système de coordonnées naturel qui faciliterait la combinaison de données biomoléculaires provenant de plusieurs personnes et poserait des questions de recherche biologiquement pertinentes.
Énoncé de disponibilité des données
Des ensembles de données accessibles au public ont été analysés dans le cadre de cette étude. Ces données peuvent être trouvées ici: https://www.proteinatlas.org.
Contributions des auteurs
GW a conçu cette étude sur la base des rapports de la Réunion du CCF de 2017 et de l’atelier du CCF de 2019. KB et YJ ont fourni des commentaires critiques. GW a rédigé le projet initial, avec un texte supplémentaire transcrit de la présentation de diapositives CCFWS-01. Tous les auteurs ont contribué à l’édition du manuscrit.
Financement
Cette recherche a été soutenue par le prix OT2OD026671 des National Institutes of Health (NIH). Ce travail ne représente pas l’opinion du NIH ou de l’Institut National du Cœur, des poumons et du Sang (NHLBI).
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions Dr. Zorina S. Galis des National Institutes of Health pour avoir aidé à développer l’idée d’un système de coordonnées basé sur les vaisseaux lors de la réunion du CCF 2017 et de l’atelier du CCF 2019, en nous fournissant des présentations de ces événements et en participant à de nombreuses discussions qui ont constitué la base de ce manuscrit. Les commentaires d’experts des examinateurs ont aidé à clarifier et à détailler le système de coordonnées commun à base vasculaire proposé.
3. Uhlén M, Björling E, Agaton C, Szigyarto CA, Amini B, Andersen E, et al. Atlas des protéines humaines pour les tissus normaux et cancéreux basé sur la protéomique des anticorps. Protéomique des cellules molaires. (2005) 4:1920–32. doi: 10.1074/ mcp.M500279-MCP200
Résumé publié/Texte intégral croisé/Google Scholar
12. Vanlandewijck M, He L, Mäe MA, Andrae J, Ando K, Del Gaudio F, et al. Un atlas moléculaire des types cellulaires et de la zonation dans le système vasculaire cérébral. Nature. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, Singer M. Surveillance de la tension d’oxygène tissulaire de la perfusion d’organes: justification, méthodologies et revue de la littérature. Br J Anaesth. (2015) 115:357–65. doi:10.1093/bja/aev162
Résumé publié/Texte intégral croisé/Google Scholar
17. Koch CJ. Mesure des niveaux absolus d’oxygène dans les cellules et les tissus à l’aide de capteurs d’oxygène et de 2-nitroimidazole EF5. Méthodes Enzymol. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi E, Segars WP, Sturgeon GM, Roos JE, Ravin CE, Samei E. Modélisation de l’architecture pulmonaire dans la série de fantômes XCAT: voies respiratoires, artères et veines physiologiquement basées. Imagerie Trans Med IEEE. (2018) 37:693–702. doi: 10.1109/ TMI.2017.2769640
Résumé publié|Texte intégral croisé/Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Anatomie du foie: un contour avec trois niveaux de complexité – une étape supplémentaire vers des résections hépatiques territoriales adaptées. J Hépatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar