La triphénylphosphine
PPh3 est largement utilisée en synthèse organique. Les propriétés qui guident son utilisation sont sa nucléophilie et son caractère réducteur. La nucléophilie de PPh3 est indiquée par sa réactivité envers les alcènes électrophiles, tels que les accepteurs de Michael, et les halogénures d’alkyle. Il est également utilisé dans la synthèse de composés biaryles, tels que la réaction de Suzuki.
QuaternizationEdit
PPh3 se combine avec des halogénures d’alkyle pour donner des sels de phosphonium. La facilité de la réaction de quaternisation suit le schéma habituel selon lequel les halogénures benzyliques et allyliques sont des réactifs particulièrement efficaces :
PPh3+ CH3I → +I-
Ces sels, qui peuvent souvent être isolés sous forme de solides cristallins, réagissent avec des bases fortes pour former des ylides :
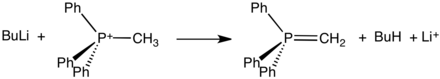
De tels ylides sont des réactifs clés dans les réactions de Wittig, utilisés pour convertir les aldéhydes et les cétones en alcènes.
Les halogénures d’aryle vont quaterniser PPh3 pour donner des sels de tétraphénylphosphonium:
PPh3 + PhBr →Br
La réaction nécessite cependant des températures élevées et des catalyseurs métalliques.
Réaction de Mitsunobudit
Dans la réaction de Mitsunobu, un mélange de triphénylphosphine et d’azodicarboxylate de diisopropyle (« DIAD », ou son analogue diéthylique, MORT) convertit un alcool et un acide carboxylique en un ester. Le DIAD est réduit car il sert d’accepteur d’hydrogène et le PPh3 est oxydé en OPPh3.
Réaction d’Appeledit
Dans la réaction d’Appel, un mélange de PPh3 et de CX4 (X = Cl, Br) est utilisé pour convertir les alcools en halogénures d’alkyle. L’oxyde de triphénylphosphine (OPPh3) est un sous-produit.
PPh3 + CBr4 + RCH2OH → OPPh3 + RCH2Br + HCBr3
Cette réaction commence par une attaque nucléophile de PPh3 sur CBr4, une extension de la réaction de quaternisation listée ci-dessus.
Désoxygénationedit
L’oxygénation facile du PPh3 est exploitée dans son utilisation pour désoxygéner les peroxydes organiques, ce qui se produit généralement avec rétention de configuration:
PPh3 + RO2H → OPPh3 + ROH (R = alkyle)
Il est également utilisé pour la décomposition des ozonides organiques en cétones et aldéhydes, bien que le sulfure de diméthyle soit plus populaire pour la réaction en tant que produit secondaire, le sulfoxyde de diméthyle est plus facilement séparé du mélange réactionnel que l’oxyde de triphénylphosphine. Les N-oxydes aromatiques sont réduits à l’amine correspondante avec un rendement élevé à température ambiante avec irradiation:

SulfonationEdit
La sulfonation de PPh3 donne la tris(3-sulfophényl)phosphine, P(C6H4-3-SO3-)3 (TPPTS), généralement isolée sous forme de sel trisodique. Contrairement au PPh3, le TPPTS est soluble dans l’eau, tout comme ses dérivés métalliques. Les complexes de rhodium des TPPT sont utilisés dans certaines réactions industrielles d’hydroformylation.

Réduction en diphénylphosphidedit
Le lithium dans le THF ainsi que le Na ou le K réagissent avec le PPh3 pour donner le Ph2PM (M = Li, Na, K). Ces sels sont des précurseurs polyvalents des phosphines tertiaires. Par exemple, le 1,2-dibromoéthane et le Ph2PM réagissent pour donner le Ph2PCH2CH2PPh2. Les acides faibles tels que le chlorure d’ammonium convertissent Ph2PM (M = Li, Na, K) en diphénylphosphine:
(C6H5) 2PM + H2O → (C6H5) 2PH + MOH
Complexes de métaux de transition
La triphénylphosphine se lie bien à la plupart des métaux de transition, en particulier ceux des métaux de transition moyens et tardifs des groupes 7-10. En termes de masse stérique, PPh3 a un angle de cône Tolman de 145°, intermédiaire entre ceux de P(C6H11)3 (170°) et de P(CH3)3 (115°). Dans une première application en catalyse homogène, le NiBr2 (PPh3)2 a été utilisé par Walter Reppe pour la synthèse d’esters d’acrylates à partir d’alcynes, de monoxyde de carbone et d’alcools. L’utilisation de PPh3 a été popularisée par son utilisation dans le catalyseur d’hydroformylation RhH (PPh3)3 (CO).