Le Solvant Universel
Le Solvant Universel
C’est, bien sûr, une autre propriété clé de l’eau car plus de substances se dissolvent dans l’eau que tout autre liquide commun. En effet, la molécule d’eau polaire améliore le « Pouvoir de dissolution ». »La dissolution implique la rupture des « sels » en ions « composants ». »Par exemple, NaCl (sel commun) se décompose en ions Na + et Cl- en raison de l’attraction élevée pour les ions (atomes ou groupes d’atomes avec une charge) vers les molécules d’eau.
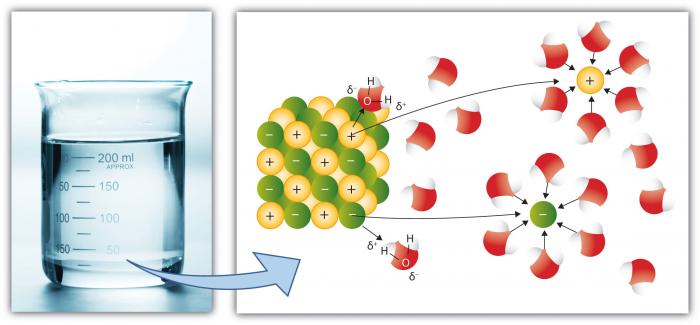
Les cations, tels que Na (Sodium) ont une charge nette positive, tandis que les anions (tels que Cl, Chlorure) ont une charge nette négative. Il existe de nombreux éléments et composés individuels qui forment des ions. Ainsi, l’eau peut contenir des concentrations considérables de diverses espèces chimiques en fonction de leurs propriétés particulières. Notez comment les molécules d’eau entourent les ions individuels, en les maintenant isolées des autres ions en solution. Cela se produit jusqu’à ce que la capacité de l’eau à isoler les ions soit dépassée, à quel point la solution est « saturée » avec ces ions et ne peut plus se dissoudre (le sel commencera à précipiter — former un solide).