Phénanthrène
- Phénanthrène Propriétés chimiques, Utilisations, Production
- Hydrocarbures aromatiques polycycliques non linéaires
- Structure moléculaire
- Propriétés chimiques
- Utilisations
- Préparation
- Propriétés chimiques
- Propriétés chimiques
- Propriétés physiques
- Utilisations
- Utilise des hydrocarbures aromatiques polycycliques marqués
- Définition
- Méthodes de production
- Synthesis Reference(s)
- Description générale
- Air &Réactions de l’eau
- Profil de réactivité
- Danger pour la santé
- Risque d’incendie
- Profil de sécurité
- Exposition potentielle
- Cancérogénicité
- Source
- Devenir environnemental
- Expédition
- Méthodes de purification
- Élimination des déchets
Phénanthrène Propriétés chimiques, Utilisations, Production
Hydrocarbures aromatiques polycycliques non linéaires
Le phénanthrène est l’hydrocarbure aromatique polycyclique non linéaire le plus simple à structure à trois cycles benzéniques, étant l’isomère de l’anthracène. En 1872, E. Ostermayer et al ont identifié le phénanthrène dans la fraction d’huile d’anthracène dans le distillat de goudron de houille, étant l’un des produits de traitement du goudron de houille. Dans le goudron de houille à haute température, la teneur en phénanthrène n’est secondaire qu’au naphtalène, étant d’environ 4 à 6%, principalement concentrée dans les fractions d’huile d’anthracène. L’activité chimique du phénanthrène est plus forte que celle du naphtalène, mais elle est plus faible que celle de l’anthracène, et les réactions d’oxydation et d’addition peuvent également se produire aux positions 9 et 10.
Le phénanthrène est un cristal incolore avec éclat, et le phénanthrène précipité de l’éthanol est un cristal monoclinique incolore. Le phénanthrène est un cristal en forme de feuille avec une densité relative de 1.179 (25/4 ℃) et un indice de réfraction de 1,6450, un point de fusion de 101 ° C et un point d’ébullition de 340 ° C. Il peut être soumis à la sublimation, étant insoluble dans l’eau, légèrement soluble dans l’éthanol, soluble dans l’éther, le benzène, l’acide acétique, le chloroforme, le tétrachlorure de carbone et le disulfure de carbone. La solution présente une fluorescence bleue. Les positions 1, 4, 5, 8 sont les mêmes, appelées position α; les positions 2, 3, 6, 7 sont également les mêmes, appelées position β; les positions 9, 10 sont les mêmes, appelées ?-position. Sa propriété chimique se situe entre le naphtalène et l’anthracène. Il peut également avoir une réaction d’addition en position 9, 10, mais pas aussi facile que l’anthracène. L’oxydation se produit également en position 9, 10 avec une oxydation donnant de la phénanthrénéquinone. Des réactions de substitution peuvent également se produire. Il peut également être obtenu par séparation de la fraction d’huile d’anthracène de l’huile de goudron de houille. Le phénanthrène peut être utilisé dans la fabrication de pesticides et de colorants, mais aussi comme stabilisateur des pesticides à haute efficacité & pesticides à faible toxicité et explosifs en poudre sans fumée.
Le phénanthrène peut être utilisé pour produire des colorants, des médicaments et des résines après traitement de conversion. Les produits d’oxydation phénanthrénéquinone peuvent être utilisés comme colorants, fongicides et inhibiteurs de polymérisation; L’acide dicarboxylique 9, 10-biphényle est utilisé pour fabriquer du polyester et de la résine alkyde; l’acide 9, 10-dihydro-9-phénathroïque est une hormone stimulant la croissance des plantes; Le perhydrophénanthrène fabriqué par hydrogénation du phénanthrène peut être utilisé dans la production de carburéacteur; son produit sulfoné, l’acide phénanthrène sulfonique peut être utilisé comme liant et tannage.
La liqueur mère contenant du phénanthrène lors de la production d’anthracène raffiné par méthode solvant, après récupération du solvant et filtration de cristallisation ultérieure, peut donner du phénanthrène brut contenant 40% de phénanthrène.
Le phénanthrène brut, après élimination des solvants résiduels dans la cuve de fusion puis rectification dans la tour de redressement avec 20 plaques théoriques, les fractions de 335 à 340 °C sont découpées, puis refroidies, cristallisées et filtrées pour obtenir le phénanthrène industriel avec une teneur en phénanthrène supérieure à 70%. .
Les informations ci-dessus sont compilées par Tongtong à partir de Chemicalbook.
Structure moléculaire
La structure moléculaire du phénanthrène et de l’anthracène sont similaires l’une à l’autre, tous les atomes étant situés dans le même plan, mais pas dans la même ligne, étant un système conjugué fermé à propriété aromatique. Les positions 1, 2, 3, 4, 10 et 5, 6, 7, 8, 9 à l’intérieur des molécules correspondent respectivement, mais il y avait des différences d’activité aux 5 positions, parmi lesquelles 9 et 10 avaient une activité plus élevée avec substitution, oxydation et addition se produisant dans 9 et 10 positions: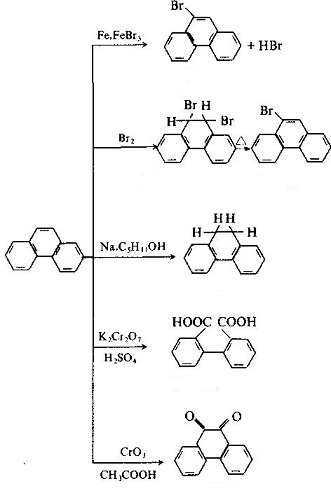
La phénanthrénéquinone est un pesticide utilisé comme pansement germicide, capable de prévenir la gale du blé, le charbon dur et tache noire de patate douce.
Le phénanthrène industriel est dérivé de la distillation de l’huile d’anthracène dérivée du distillat de goudron de houille. De nombreux types de produits naturels (tels que les stérols) contiennent ce système d’anneaux. Le phénanthrène est principalement utilisé dans la fabrication de colorants, de médicaments, de rendement élevé et de faible toxicité des pesticides, et peut être utilisé comme scintillants, stabilisateur de poudre sans fumée. De nombreux dérivés du phénanthrène ont des effets physiologiques cancérigènes. Tels que: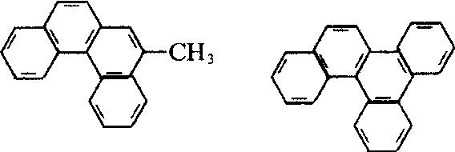
La structure moléculaire du 2-méthyl-3, 4-benzophénanthrène et du 1, 2, 3, 4-dibenzophène
Propriétés chimiques
Il apparaît sous forme de cristaux de paillettes fluorescents et de lustre blanc. Il n’est pas soluble dans l’eau, légèrement soluble dans l’éthanol, soluble dans l’éther, l’acide acétique, le benzène, le tétrachlorure de carbone et le disulfure de carbone.
Utilisations
Il peut être utilisé pour la fabrication de phénanthrénéquinone, de résine synthétique, de pesticides et de conservateurs, etc.
Le phénanthrène, par oxydation, peut donner de la phénanthrénéquinone, à utiliser pour remplacer les pesticides mercuriels organiques cérésine et gallotox. L’acide biphényle issu de son oxydation peut être utilisé pour préparer la résine alkyde. L’oxydation du phénanthrène peut également donner de l’anhydride, de la cyclohexanone et du phénol. Les produits de chloration du phénanthrène peuvent être utilisés pour fabriquer des isolants électriques et des imprégnants ininflammables. L’acide phénanthrène sulfonique sulfoné peut être constitué de liant, de tannage, etc. Mais en fait, la plupart de ces applications n’ont pas encore été développées. Dans l’industrie papetière, le phénanthrène peut être utilisé comme agent antibuée de pâte; peut également être utilisé pour les explosifs à la nitroglycérine et les stabilisants à la nitrocellulose et pour la fabrication de bombes fumigènes; l’oxyde solide de phénanthrène peut être constitué d’excellents matériaux isolants et charges électriques ignifuges. En médecine, le phénanthrène peut être utilisé pour synthétiser des alcaloïdes – morphine et caféine, diméthyl morphine ainsi que des médicaments ayant des effets physiologiques spéciaux sur de nombreux organes reproducteurs. Dans l’industrie des colorants, le phénanthrène peut être constitué de quinone 2-aminophénanthrène, de benzanthrone, de colorant de réduction des sulfures (BO bleu, BB noir et brun), etc. De plus, l’industrie du plastique, les agents de bronzage synthétique et le phénanthrène, à haute température et haute pression, peuvent subir une hydrogénation pour obtenir de l’hydrophénanthrène, qui est le carburant des avions à réaction seniors.
Pour la détermination du poids moléculaire et la synthèse de composés organiques.
Préparation
Le phénanthrène est une teneur relativement élevée en goudron de houille, représentant 5% du goudron de houille, juste derrière la teneur en naphtalène. L’huile d’anthracène dans la gamme de fraction 300-360 ℃ de goudron de houille a la teneur la plus élevée en phénanthrène, suivie de l’anthracène et du carbazole, etc. La méthode d’extraction du phénanthrène consiste généralement à envoyer de l’huile d’anthracène pour le refroidissement, la cristallisation, puis la filtration sous vide ou la séparation centrifuge pour la séparation de l’huile. La quantité relativement élevée de phénols solubles dans les huiles peut être récupérée par une méthode de distillation de précision. Le cristal obtenu est appelé anthracène brut, qui contient 25 à 30% d’anthracène, 22 à 25% de carbazole et 30% de phénanthrène. L’anthracène brut peut être soumis à une extraction lourde du benzène, à un refroidissement, à une filtration avec le filtrat cuit à la vapeur du solvant avant recristallisation et filtration. Prenez du filtrat pour la distillation afin que nous puissions obtenir du phénanthrène industriel avec sulfonation pour obtenir du phénanthrène fin.
Propriétés chimiques
cristaux blancs
Propriétés chimiques
Le phénanthrène est une substance cristalline blanche. Odeur aromatique faible. Les hydrocarbures aromatiques polycycliques (HAP) sont des composés contenant de multiples cycles benzéniques et sont également appelés hydrocarbures aromatiques polynucléaires.
Propriétés physiques
Cristaux monocliniques incolores à faible odeur aromatique
Utilisations
Le phénanthrène est un hydrocarbure aromatique polycyclique, un polluant environnemental.
Utilise des hydrocarbures aromatiques polycycliques marqués
comme micropolluants.
Définition
ChEBI: Hydrocarbure aromatique polycyclique composé de trois cycles benzéniques fusionnés qui tire son nom des deux termes « phényle » et » anthracène « .’
Méthodes de production
Le phénanthrène se trouve dans le goudron de houille et peut être isolé de plusieurs types de pétrole brut.
Synthesis Reference(s)
Journal of Heterocyclic Chemistry, 30, p. 291, 1993 DOI: 10.1002/jhet.5570300151
The Journal of Organic Chemistry, 18, p. 801, 1953 DOI: 10.1021 /jo50013a004
Lettres tétraèdres, 15, p. 495, 1974
Description générale
Cristaux monocliniques incolores à faible odeur aromatique. Les solutions présentent une fluorescence bleue.
Air &Réactions de l’eau
Insoluble dans l’eau.
Profil de réactivité
Le phénanthrène peut réagir avec les matériaux oxydants.
Danger pour la santé
La toxicité orale aiguë du phénanthrène est low.It est plus toxique que l’anthracène. Une valeur DL50 par voie orale chez la souris est rapportée à 700 mg/kg. Il peutcauser une tumeur dans la peau au site d’application.Les preuves de cancérogénicité chez les animaux sont cependant insuffisantes.
Risque d’incendie
Le phénanthrène est combustible.
Profil de sécurité
Poison par voie intraveineuse. Modérément toxique par ingestion. Données de mutation rapportées. Un photosensibilisateur pour la peau humaine. Cancérogène douteux avec des données expérimentales néoplastigéniques et tumorigènes par contact cutané. Combustible lorsqu’il est exposé à la chaleur ou à la flamme; peut réagir vigoureusement avec les matériaux oxydants. Pour combattre le feu, utilisez de l’eau, de la mousse, du CO2, des produits chimiques secs. Lorsqu’il est chauffé jusqu’à décomposition, il émet une fumée âcre et des vapeurs irritantes
Exposition potentielle
La poussière peut former un mélange explosif avec l’air. Incompatible avec les oxydants (chlorates, nitrates, peroxydes, permanganates, perchlorates, chlore, brome, fluor, etc.); le contact peut provoquer des incendies ou des explosions. Tenir à l’écart des matériaux alcalins, des bases fortes, des acides forts, des oxoacides, des époxydes.
Cancérogénicité
Le phénanthrène est inefficace en tant qu’initiateur. Il n’est pas classable pour la cancérogénicité humaine — classe 3 par le CIRC et classe D par l’IRIS, sur la base d’aucune donnée humaine et de données inadéquates provenant d’une seule étude par gavage chez le rat et d’études de peinture cutanée et d’injection dans le MICE.
Source
Détectée dans les eaux souterraines sous une ancienne usine de gazéification du charbon à Seattle, dans l’État de Washington, à une concentration de 130 µg/L (ASTR, 1995). Détecté dans 8 carburants diesel à des concentrations comprises entre 0,17 et 110 mg/L avec une valeur moyenne de 41,43 mg/L (Westerholm et Li, 1994) et dans des fractions solubles dans l’eau distillées d’huile moteur neuve et usagée à des concentrations de 1,9-2,1 et 2,1–2,2 µg/L, respectivement (Chen et al., 1994). Lee et coll. (1992) ont rapporté des plages de concentrations de 100 à 300 mg/L et de 15 à 25 µg/L dans le carburant diesel et la phase aqueuse correspondante (eau distillée), respectivement. Schauer et coll. (1999) ont signalé la présence de phénanthrène dans le carburant diesel à une concentration de 57 µg/g et dans les gaz d’échappement d’un camion à usage moyen à moteur diesel à un taux d’émission de 93,1 µg/km.Identifié dans les pétroles bruts du Koweït et du sud de la Louisiane à des concentrations de 26 et 70 ppm, respectivement (Pancirov et Brown, 1975). Le carburant diesel obtenu d’une station-service à Schlieren, en Suisse, contenait du phénanthrène à une concentration estimée à 327 mg/L (Schluep et al.,2001).
Le phénanthrène a été détecté dans les fumées d’asphalte à une concentration moyenne de 57,73 ng/m3 (Wanget al., 2001).
Thomas et Delfino (1991) ont équilibré les eaux souterraines exemptes de contaminants collectées à Gainesville, en Floride, avec des fractions individuelles de trois produits pétroliers individuels à 24-25 ° C pendant 24 h. La phase aqueuse a été analysée pour rechercher des composés organiques via la méthode d’essai approuvée par l’EPA des États-unis625. Le phénanthrène n’a été détecté que dans la fraction hydrosoluble du carburant diesel à une concentration moyenne de 17 µg/L.
D’après l’analyse en laboratoire de 7 échantillons de goudron de houille, les concentrations de phénanthrène variaient de 3 100 à 35 000 ppm (EPRI, 1990). Détecté dans un film de goudron de houille âgé de 1 an et dans du goudron de houille en vrac à une concentration identique de 10 000 mg/kg (Nelson et al., 1996). Un goudron de houille à haute température contient du phénanthrène à une concentration moyenne de 2,66 % en poids (McNeil, 1983). Également identifié dans les pas de goudron de houille à haute température à des concentrations allant de 7 500 à 40 300 mg / kg (Arrendale et Rogers, 1981). Lee et coll. (1992a) ont équilibré huit goudrons de charbon avec de l’eau distillée à 25 °C. La concentration maximale de phénanthrène observée dans la phase aqueuse est de 0,4 mg/L.
Neuf échantillons de créosote disponibles dans le commerce contenaient du phénanthrène à des concentrations variant de 48 000 à 120 000 mg/kg (Kohler et al., 2000).
La concentration typique de phénanthrène dans une huile de pyrolyse lourde est de 2,5% en poids (Chevron Phillips, mai 2003).
Devenir environnemental
Biologique. Le catéchol est le métabolite central de la dégradation bactérienne du phénanthrène.Les sous-produits intermédiaires comprennent l’acide 1-hydroxy-2-naphtoïque, le 1,2-dihydroxynaphtalène et l’acide salicylique (Chapman, 1972; Hou, 1982). Il a été rapporté que Beijerinckia, sous des conditions aérobiques, dégradait le phénanthrène en cis-3,4-dihydroxy-3,4-dihydrophénanthracène (Kobayashiand Rittman, 1982).
Sol. Les demi-vies signalées pour le phénanthrène dans un loam sableux de Kidman et un sandyloam de McLaurin sont de 16 et 35 jours, respectivement (Park et al., 1990). Manilal et Alexander (1991) ont signalé une demi-vie de 11 jours dans un sol de Kendaia.
Eaux de surface. Dans un plan d’eau de surface de 5 m de profondeur, les demi-vies calculées pour la transformation photochimique directe à 40 ° de latitude nord au milieu de l’été à midi étaient respectivement de 59 et 69 jours sans séparation sédiments-eau (Zepp et Schlotzhauer, 1979).
Photolytique. Un rendement en dioxyde de carbone de 24,2% a été obtenu lorsque le gel adsilica adsorbé au phénanthrène a été irradié à la lumière (λ> 290 nm) pendant 17 h (Freitag et al., 1985). Dans un experiment 2-wk, le phénanthrène appliqué sur des suspensions sol-eau dans des conditions aérobies et anaérobiques a donné des rendements de 14CO2 de 7,2 et 6.3 %, respectivement (Scheunert et al., 1987). Matsuzawa et autres. (2001) ont étudié la dégradation photochimique de cinq particules d’hydrocarbures aromatiques polycycliques indiesel déposées sur le sol et dans divers composants du sol. La dégradation photochimique par la lumière artificielle du soleil a été réalisée à l’aide d’une lampe au xénon de 900 W.La lumière de cette lampe a été passée à travers un filtre en verre pour éliminer la lumière de longueurs d’onde plus courtes (λ2. De plus, un simulateur solaire équipé d’une lampe au xénon de 300 W a été utilisé pour fournir l’intensité solaire maximale observée à Tokyo (latitude 35,5 ° N). Les demi-vies du phénanthrène dans les particules diesel utilisant des sources de 900 et 300 W étaient de 4,29 et 60,63 h, respectivement. Les demi-vies suivantes ont été déterminées pour le phénanthrène adsorbé sur divers composants du sol à l’aide d’un appareil de 900 W: 3,04 h pour le quartz, 2,90 h pour le feldspath, 1,15 h pour la kaolinite, 4,97 h pour la montmorillonite, 3,26 h pour le gel de silice et 1,17 h pour l’alumine.
Chimique / physique. La chloration aqueuse du phénanthrène à pH 8,8), du phénanthrène-9,10-oxyde, du phénanthrène-9,10-dione et du 9,10-dihydrophénanthrènediol ont été identifiés comme produits majeurs (Oyler et al.,1983). Il a été suggéré que la chloration du phénanthrène dans l’eau du robinet expliquait la présence de chloro- et de dichlorophénanthrènes (Shiraishi et al., 1985).
Expédition
UN3077 Matières dangereuses pour l’environnement, solides, n.s.a., Classe de danger: 9; Étiquettes: 9 – Matières dangereuses diverses, Nom technique Requis.
Méthodes de purification
Les contaminants probables comprennent l’anthracène, le carbazole, le fluorène et d’autres hydrocarbures polycycliques. Purifier par distillation du sodium sous vide, ébullition avec de l’anhydride maléique dans du xylène, cristallisation à partir d’acide acétique, sublimation et fusion de zone. Il a également été recristallisé à plusieurs reprises à partir d’EtOH, * benzène ou d’éther pet (b 60-70o), puis séché sous vide sur P2O5 dans un pistolet Abderhalden. Feldman, Pantages et Orchin ont séparé la majeure partie de l’impureté anthracénique par reflux du phénanthrène (671g) avec de l’anhydride maléique (194g) dans du xylène (1,25L) sous azote pendant 22heures, puis filtré. Le filtrat est extrait avec du NaOH aqueux à 10%, la phase organique est séparée et le solvant est évaporé. Le résidu, après 2 heures d’agitation avec 7g de sodium, est distillé sous vide, puis recristallisé deux fois à partir de benzène à 30% dans EtOH. Il a ensuite été dissous dans de l’acide acétique chaud (2,2 mL/g), auquel on a ajouté lentement une solution aqueuse de CrO3 (60g dans 72mL de H2O plus 2,2L d’acide acétique), suivie d’une addition lente de conc H2SO4 (30mL). Le mélange a été porté à reflux pendant 15minutes, dilué avec un volume égal d’eau et refroidi. Le précipité est filtré, lavé à l’eau, séché et distillé, puis recristallisé deux fois dans EtOH. Une purification supplémentaire est possible par chromatographie à partir d’une solution de CHCl3 sur alumine activée, avec * benzène comme éluant, et par raffinage de zone. Le picrate (1: 1) forme des aiguilles jaune doré avec m 146o, et le styphnate (1: 1) a m 138-139o (plaques ou aiguilles d’EtOH ou EtOH / H2O respectivement).
Élimination des déchets
Consulter les organismes de réglementation environnementale pour obtenir des conseils sur les pratiques d’élimination acceptables. Les générateurs de déchets contenant ce contaminant (≥100 kg / mois) doivent être conformes aux réglementations de l’EPA régissant le stockage, le transport, le traitement et l’élimination des déchets.