Refissa
Nom générique: trétinoïne
Forme posologique: crème
Revue médicale par Drugs.com . Dernière mise à jour le 1er avril 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Plus
À USAGE TOPIQUE SUR LE VISAGE UNIQUEMENT.
- Refissa Description
- Refissa – Pharmacologie clinique
- Indications et utilisation pour Refissa
- DONNÉES DES ESSAIS CLINIQUES
- Contre-indications
- Mises en garde
- Précautions
- Généralités
- Informations pour les patients
- Interactions médicamenteuses
- Carcinogenèse, Mutagénèse, Altération de la fertilité
- Grossesse
- Catégorie de grossesse C
- Mères allaitantes
- Utilisation pédiatrique
- Utilisation gériatrique
- Effets indésirables
- Surdosage
- Posologie et administration de Refissa
- Comment est fourni Refissa
- Stockage
- PANNEAU D’AFFICHAGE PRINCIPAL – Carton tubulaire de 40 g
- En savoir plus sur Refissa (trétinoïne topique)
- Ressources pour les consommateurs
- Ressources professionnelles
- Guides de traitement connexes
Refissa Description
Refissa, contient l’ingrédient actif trétinoïne (un rétinoïde) dans une base de crème émolliente. La trétinoïne est une poudre cristalline jaune à orange ayant une odeur florale caractéristique. La trétinoïne est soluble dans le diméthylsulfoxyde, légèrement soluble dans le polyéthylène glycol 400, l’octanol et l’éthanol à 100%. Il est pratiquement insoluble dans l’eau et l’huile minérale, et il est insoluble dans la glycérine. Le nom chimique de la trétinoïne est l’acide (all-E)-3,7-diméthyl-9- (2,6,6-triméthyl-1-cyclonexène-1-yl)-2,4,6,8-nonatétraénoïque. La trétinoïne est également appelée acide tout-trans-rétinoïque et a un poids moléculaire de 300,44. La formule structurelle est représentée ci-dessous.
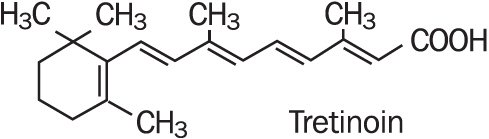
Refissa contient de la trétinoïne à une concentration de 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Pharmacologie clinique
Le mécanisme d’action exact de la trétinoïne est inconnu bien que l’on pense que les rétinoïdes exercent un effet sur la croissance et la différenciation de diverses cellules épithéliales. Cependant, lorsqu’il est appliqué par voie topique, il n’y a pas d’augmentation notée de l’ARNm de la desmosine, de l’hydroxyproline ou de l’élastine dans la peau humaine. En outre, le rôle de la nature irritante de ce produit dans l’effet positif attribué à ce produit pour son indication n’a pas encore été entièrement déterminé.
L’absorption transdermique de la trétinoïne à partir de diverses formulations topiques variait de 1% à 31% de la dose appliquée, selon qu’elle était appliquée sur une peau saine ou une peau dermatitique. Lorsque l’absorption percutanée de la crème de trétinoïne, USP (Émollient) 0,05% a été évaluée chez des sujets masculins en bonne santé (n = 14) après une seule application, ainsi qu’après des applications quotidiennes répétées pendant 28 jours, l’absorption de la trétinoïne était inférieure à 2% et les concentrations endogènes de la trétinoïne et de ses principaux métabolites n’étaient pas modifiées.
Indications et utilisation pour Refissa
(Pour bien comprendre l’indication de ce produit, veuillez lire l’intégralité de la section INDICATIONS ET UTILISATION de l’étiquetage.)
Refissa est indiqué comme adjuvant (voir deuxième point ci-dessous) pour une utilisation dans l’atténuation (la palliation) des rides fines, de l’hyperpigmentation tachetée et de la rugosité tactile de la peau du visage chez les patients qui n’obtiennent pas une telle palliation en utilisant des programmes complets de soins de la peau et d’évitement du soleil (voir point 3 pour les populations chez lesquelles l’efficacité n’a pas été établie). Refissa N’ÉLIMINE PAS LES RIDES, NE RÉPARE PAS LA PEAU ENDOMMAGÉE PAR LE SOLEIL, N’INVERSE PAS LE PHOTOVIEILLISSEMENT ou NE RESTAURE PAS UN SCHÉMA HISTOLOGIQUE CUTANÉ PLUS JEUNE ou PLUS JEUNE. De nombreux patients obtiennent les effets palliatifs souhaités sur les ridules fines, l’hyperpigmentation tachetée et la rugosité tactile de la peau du visage en utilisant des programmes complets de soins de la peau et d’évitement du soleil, y compris des écrans solaires, des vêtements de protection et des crèmes émollientes NE contenant PAS de trétinoïne.
- Crème de trétinoïne, USP (Émollient) 0.05% n’a démontré aucun EFFET ATTÉNUANT sur les signes significatifs d’exposition chronique au soleil tels que rides grossières ou profondes, jaunissement de la peau, lentigines, télangiectasie, laxisme cutané, atypie kératinocytaire, atypie mélanocytaire ou élastose cutanée.
- Refissa doit être utilisé sous surveillance médicale en complément d’un programme complet de soins de la peau et d’évitement du soleil qui comprend l’utilisation d’écrans solaires efficaces (FPS minimal de 15) et de vêtements de protection lorsque les résultats souhaités sur les rides fines, l’hyperpigmentation tachetée et la rugosité de la peau du visage n’ont pas été atteints avec un programme complet de soins de la peau et d’évitement du soleil seul.
- L’efficacité de Refissa dans l’atténuation des rides fines, de l’hyperpigmentation tachetée et de la rugosité tactile de la peau du visage n’a pas été établie chez les personnes de plus de 50 ans OU chez les personnes ayant une peau modérément à fortement pigmentée. En outre, les patients présentant des kératoses actiniques visibles et les patients ayant des antécédents de cancer de la peau ont été exclus des essais cliniques de la crème de trétinoïne, USP (Émollient) 0,05%. Ainsi, l’efficacité et l’innocuité de Refissa dans ces populations ne sont pas connues pour le moment.
- Ni l’innocuité ni l’efficacité de Refissa pour la prévention ou le traitement des kératoses actiniques ou des néoplasmes cutanés n’ont été établies.
- Ni l’innocuité ni l’efficacité de l’utilisation quotidienne de Refissa pendant plus de 48 semaines n’ont été établies, et l’utilisation quotidienne au-delà de 48 semaines n’a pas été systématiquement et histologiquement étudiée dans des essais adéquats et bien contrôlés. (Voir la section AVERTISSEMENTS.)
DONNÉES DES ESSAIS CLINIQUES
Deux essais adéquats et bien contrôlés ont été menés sur un total de 161 patients évaluables (de moins de 50 ans) traités avec la Crème à la trétinoïne, USP (Émollient) 0,05% et 154 patients évaluables traités avec la crème émolliente véhicule sur le visage pendant 24 semaines en complément d’un programme complet de soins de la peau et d’évitement du soleil, pour évaluer les effets sur les ridules fines, l’hyperpigmentation marbrée et rugosité tactile de la peau. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | Réduction de 2 unités ou plus |
Dans ces essais, on pensait que les rides fines, l’hyperpigmentation marbrée et la rugosité tactile de la peau du visage étaient causées par plusieurs facteurs qui incluaient le vieillissement intrinsèque ou des facteurs environnementaux, tels que l’exposition chronique au soleil.
Les résultats de ces évaluations sont les suivants:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| Véhicule + CSP | 67% | 23% | 10% |
La majeure partie de l’amélioration de ces signes a été notée au cours des 24 premières semaines de traitement. Par la suite, le traitement a principalement maintenu l’amélioration réalisée au cours des 24 premières semaines.
La majorité des patients perdront la plupart des effets atténuants de Refissa sur les rides fines, l’hyperpigmentation tachetée et la rugosité tactile de la peau du visage avec l’arrêt d’un programme complet de soins de la peau et d’évitement du soleil, y compris Refissa; cependant, l’innocuité et l’efficacité de l’utilisation quotidienne de Refissa pendant plus de 48 semaines n’ont pas été établies.
Contre-indications
Ce médicament est contre-indiqué chez les personnes ayant des antécédents de réactions de sensibilité à l’un de ses composants. Il doit être arrêté si une hypersensibilité à l’un de ses ingrédients est notée.
Mises en garde
- Refissa est un irritant cutané et les résultats d’une irritation continue de la peau pendant plus de 48 semaines en cas d’utilisation chronique à long terme ne sont pas connus. Il existe des preuves de modifications atypiques des mélanocytes et des kératinocytes et d’une augmentation de l’élastose cutanée chez certains patients traités par la crème de trétinoïne, USP (Émollient) 0,05% pendant plus de 48 semaines. La signification de ces résultats est inconnue.
- L’innocuité et l’efficacité de Refissa chez les personnes ayant une peau modérément ou fortement pigmentée n’ont pas été établies.
- Refissa ne doit pas être administré si le patient prend également des médicaments connus pour être des photosensibilisants (par exemple, thiazides, tétracyclines, fluoroquinolones, phénothiazines, sulfamides) en raison de la possibilité d’une phototoxicité accrue.
En raison d’une sensibilité accrue aux brûlures, l’exposition au soleil (y compris les lampes solaires) doit être évitée ou minimisée pendant l’utilisation de Refissa. Les patients doivent être avertis d’utiliser des écrans solaires (FPS minimum de 15) et des vêtements de protection lors de l’utilisation de Refissa. Il est conseillé aux patients souffrant de coups de soleil de ne pas utiliser Refissa avant d’avoir complètement récupéré. Les patients qui peuvent avoir une exposition importante au soleil, par exemple en raison de leur profession et des patients présentant une sensibilité inhérente à la lumière du soleil, doivent faire preuve d’une prudence particulière lors de l’utilisation de Refissa et s’assurer que les précautions décrites dans la Notice du patient sont respectées.
La crème de trétinoïne, USP (Émollient) 0,05% doit être conservée hors des yeux, de la bouche, des angles du nez et des muqueuses. L’utilisation topique peut provoquer un érythème local sévère, un prurit, des brûlures, des picotements et un pelage au site d’application. Si le degré d’irritation locale le justifie, les patients doivent être invités à utiliser moins de médicaments, à diminuer la fréquence d’application, à interrompre temporairement l’utilisation ou à cesser complètement l’utilisation.
Il a été rapporté que la trétinoïne provoque une irritation sévère de la peau eczémateuse et ne doit être utilisée qu’avec prudence chez les patients atteints de cette affection.
L’application de plus grandes quantités de médicaments que celles recommandées n’entraînera pas de résultats plus rapides ou meilleurs, et une rougeur, une desquamation ou une gêne marquées peuvent survenir.
Précautions
Généralités
Refissa ne doit être utilisé qu’en complément d’un programme complet de soins de la peau et d’évitement du soleil. (Voir LA section INDICATIONS ET UTILISATION.)
Si une sensibilité au médicament, une irritation chimique ou un effet indésirable systémique se développe, l’utilisation de Refissa doit être interrompue.
Les conditions météorologiques extrêmes, telles que le vent ou le froid, peuvent être plus irritantes pour les patients utilisant Refissa.
Informations pour les patients
Voir la Notice du patient.
Interactions médicamenteuses
Les médicaments topiques concomitants, les savons médicamenteux ou abrasifs, les shampooings, les nettoyants, les cosmétiques à fort effet desséchant, les produits à fortes concentrations d’alcool, les astringents, les épices ou la chaux, les solutions à ondes permanentes, l’électrolyse, les épilatoires capillaires ou les cires, et les produits susceptibles d’irriter la peau doivent être utilisés avec prudence chez les patients traités par Refissa car ils peuvent augmenter l’irritation avec Refissa.
Refissa ne doit pas être administré si le patient prend également des médicaments connus pour être des photosensibilisants (p. ex., thiazidiques, tétracyclines, fluoroquinolones, phénothiazines, sulfamides) en raison de la possibilité d’une phototoxicité accrue.
Carcinogenèse, Mutagénèse, Altération de la fertilité
Dans une étude cutanée à vie chez des souris CD-1 à 100 et 200 fois la dose clinique topique moyenne recommandée chez l’homme, quelques tumeurs cutanées chez les souris femelles et des tumeurs hépatiques chez les souris mâles ont été observées. La signification biologique de ces résultats n’est pas claire car ils se sont produits à des doses dépassant la dose cutanée maximale tolérée (DMT) de trétinoïne et parce qu’ils se situaient dans le taux d’apparition naturel de ces tumeurs chez cette souche de souris. Il n’y avait aucune preuve de potentiel cancérogène lorsque la trétinoïne était administrée par voie topique à une dose 5 fois supérieure à la dose clinique topique moyenne recommandée chez l’homme. Aux fins de comparaisons entre l’exposition animale et l’exposition humaine, la « dose clinique topique humaine recommandée » est définie comme 500 mg de Refissa appliquée quotidiennement à une personne de 50 kg.
Lors d’un essai biologique chronique de deux ans de l’acide vitaminique A chez des souris effectué par Tsubura et Yamamoto, des dépôts amyloïdes généralisés ont été rapportés dans tous les groupes de la couche basale de la peau traitée à la vitamine A. Chez les souris CD-1, une étude similaire a rapporté une hyalinisation des sites cutanés traités et l’incidence de cette découverte était de 0/50, 3/50 et 2/50 chez les souris mâles et de 1/50, 0/50, 4/50 et 2/50 chez les souris femelles des groupes témoin du véhicule, respectivement 0,25 mg / kg, 0,5 mg / kg et 1 mg / kg.
Des études sur des souris albinos sans poils suggèrent que la trétinoïne pourrait augmenter le potentiel tumorigène des doses cancérogènes de lumière UVB et UVA provenant d’un simulateur solaire. Dans d’autres études, lorsque des souris glabres légèrement pigmentées traitées avec de la trétinoïne ont été exposées à des doses cancérogènes de lumière UVB, l’incidence et le taux de développement de tumeurs cutanées ont été réduits ou aucun effet n’a été observé. En raison de conditions expérimentales très différentes, aucune comparaison stricte de ces données disparates n’est possible pour le moment. Bien que la signification de ces études chez l’homme ne soit pas claire, les patients doivent minimiser l’exposition au soleil.
Le potentiel mutagène de la trétinoïne a été évalué dans le test d’Ames et dans le test de micronoyaux de souris in vivo, tous deux négatifs.
Des études de segments dermiques I et III avec de la Crème de trétinoïne, USP (Émollient) à 0,05% n’ont été réalisées chez aucune espèce. Dans les études orales de segment I et de segment III chez des rats atteints de trétinoïne, une diminution de la survie des nouveau-nés et un retard de croissance ont été observés à des doses supérieures à 2 mg/ kg/jour (> 400 fois la dose clinique topique moyenne chez l’humain).
Grossesse
Effets tératogènes
Catégorie de grossesse C
La trétinoïne ORALE s’est avérée tératogène chez les rats, les souris, les lapins, les hamsters et les primates subhumains. Il était tératogène et fœtotoxique chez le rat lorsqu’il était administré par voie orale ou par voie topique à des doses 1000 fois la dose clinique topique moyenne recommandée chez l’homme. Cependant, des variations des doses tératogènes entre diverses souches de rats ont été rapportées. Chez le singe cynomolgus, qui, métaboliquement, est plus proche de l’homme pour la trétinoïne que les autres espèces examinées, des malformations fœtales ont été rapportées à des doses de 10 mg/ kg/jour ou plus, mais aucune n’a été observée à 5 mg/ kg/jour (1000 fois la dose clinique topique moyenne recommandée chez l’homme), bien que des variations squelettiques accrues aient été observées à toutes les doses. Une augmentation liée à la dose de la létalité embryonnaire et de l’avortement a été rapportée. Des résultats similaires ont également été rapportés chez les macaques à queue de cochon.
La trétinoïne topique dans les tests de tératogénicité chez l’animal a donné des résultats équivoques. Il existe des preuves de tératogénicité (queue raccourcie ou pliée) de la trétinoïne topique chez le rat Wistar à des doses supérieures à 1 mg/kg/jour (200 fois la dose clinique topique recommandée chez l’homme). Des anomalies (humérus: court 13%, courbé 6%, os pariétal incomplètement ossifié 14%) ont également été rapportées lorsque 10 mg / kg / jour a été appliqué par voie cutanée.
Il existe d’autres rapports chez des lapins blancs de Nouvelle-Zélande administrés à des doses d’environ 80 fois la dose clinique topique humaine recommandée d’une incidence accrue de tête bombée et d’hydrocéphalie, typique des malformations fœtales induites par les rétinoïdes chez cette espèce.
En revanche, plusieurs études animales bien contrôlées ont montré que la trétinoïne appliquée par voie cutanée n’était pas tératogène, à des doses de 100 et 200 fois la dose clinique topique humaine recommandée, chez le rat et le lapin, respectivement.
Avec l’utilisation généralisée de n’importe quel médicament, un petit nombre de rapports d’anomalies congénitales associés temporellement à l’administration du médicament seraient attendus par hasard. Trente cas de malformations congénitales associées temporellement ont été rapportés au cours de deux décennies d’utilisation clinique d’une autre formulation de trétinoïne topique (Retin-A). Bien qu’aucun modèle défini de tératogénicité et aucune association occasionnelle n’aient été établis à partir de ces cas, 5 des rapports décrivent la catégorie d’anomalie congénitale rare holoprosencéphalie (défauts associés à un développement incomplet de la ligne médiane du cerveau antérieur). L’importance de ces rapports spontanés en termes de risque pour le fœtus n’est pas connue.
Effets non tératogènes
Il a été démontré que la trétinoïne cutanée était fœtotoxique chez le lapin lorsqu’elle était administrée à des doses 100 fois supérieures à la dose clinique topique recommandée chez l’humain. Il a été démontré que la trétinoïne orale était fœtotoxique chez le rat lorsqu’elle était administrée à des doses 500 fois supérieures à la dose clinique topique recommandée chez l’humain.
Il n’existe cependant pas d’études adéquates et bien contrôlées chez la femme enceinte. Refissa ne doit pas être utilisé pendant la grossesse.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, des précautions doivent être prises lorsque Refissa est administré à une femme qui allaite.
Utilisation pédiatrique
L’innocuité et l’efficacité chez les patients de moins de 18 ans n’ont pas été établies.
Utilisation gériatrique
L’innocuité et l’efficacité chez les personnes âgées de plus de 50 ans n’ont pas été établies.
Effets indésirables
(Voir les sections MISES en GARDE et PRÉCAUTIONS.)
Dans des études en double aveugle, contrôlées par un véhicule, portant sur 179 patients ayant appliqué la Crème de trétinoïne, USP (Émollient) 0,05% sur leur visage, les effets indésirables associés à l’utilisation de la Crème de Trétinoïne, USP (Émollient) 0,05% se sont limités principalement à la peau. Au cours de ces essais, 4% des patients ont dû interrompre l’utilisation de la crème de trétinoïne, USP (Émollient) 0,05% en raison d’effets indésirables. Ces interruptions étaient dues à une irritation cutanée ou à des effets indésirables cutanés connexes.
Des réactions locales telles que desquamation, peau sèche, brûlure, picotement, érythème et prurit ont été rapportées par presque tous les sujets pendant le traitement par la crème de trétinoïne, USP (Émollient) 0,05%. Ces signes et symptômes étaient généralement de gravité légère à modérée et se sont généralement produits au début du traitement. Chez la plupart des patients, la sécheresse, la desquamation et la rougeur sont réapparues après une baisse initiale (24 semaines).
Surdosage
Il n’a pas été démontré que l’application de plus grandes quantités de médicaments que celles recommandées entraîne des résultats plus rapides ou meilleurs, et des rougeurs, des desquamations ou une gêne marquées peuvent survenir. L’ingestion orale du médicament peut entraîner les mêmes effets secondaires que ceux associés à un apport oral excessif en vitamine A.
Posologie et administration de Refissa
- Ne PAS utiliser Refissa si la patiente est enceinte ou tente de le devenir ou présente un risque élevé de grossesse
- Ne PAS utiliser Refissa si la patiente est brûlée par le soleil ou si la patiente souffre d’eczéma ou d’autres affections chroniques de la peau
- Ne PAS utiliser Refissa si la patiente est intrinsèquement sensible à la lumière du soleil
- Ne PAS utiliser Refissa si la patiente prend également des médicaments connus pour être photosensibilisants (par exemple, thiazides, tétracyclines, fluoroquinolones, phénothiazines, sulfamides) en raison de la possibilité d’une phototoxicité accrue.
Les patients ont besoin d’instructions détaillées pour obtenir des bénéfices maximaux et comprendre toutes les précautions nécessaires pour utiliser ce produit avec la plus grande sécurité. Le médecin doit examiner la notice du patient.
Refissa doit être appliqué sur le visage une fois par jour avant de se retirer, en n’en utilisant que suffisamment pour couvrir légèrement toute la zone touchée. Les patients doivent se laver doucement le visage avec un savon doux, sécher la peau et attendre 20 à 30 minutes avant d’appliquer Refissa. Le patient doit appliquer une quantité de crème de la taille d’un pois pour couvrir légèrement l’ensemble du visage. Des précautions particulières doivent être prises lors de l’application de la crème pour éviter les yeux, les oreilles, les narines et la bouche.
L’application de Refissa peut provoquer une sensation transitoire de chaleur ou une légère piqûre.
L’atténuation (palliation) des ridules faciales, de l’hyperpigmentation tachetée et de la rugosité tactile peut se produire progressivement au cours du traitement. Jusqu’à six mois de traitement peuvent être nécessaires avant que les effets ne soient observés. La plus grande partie de l’amélioration observée avec Refissa est observée au cours des 24 premières semaines de traitement. Par la suite, le traitement maintient principalement l’amélioration réalisée au cours des 24 premières semaines.
Avec l’arrêt du traitement par Refissa, la majorité des patients perdront la plupart des effets atténuants de Refissa sur les rides fines, l’hyperpigmentation tachetée et la rugosité tactile de la peau du visage; cependant, l’innocuité et l’efficacité de l’utilisation quotidienne de Refissa pendant plus de 48 semaines n’ont pas été établies.
L’application de plus grandes quantités de médicaments que celles recommandées peut ne pas entraîner des résultats plus rapides ou de meilleurs résultats, et une rougeur, une desquamation ou une gêne marquées peuvent survenir.
Les patients traités par Refissa peuvent utiliser des produits cosmétiques, mais les zones à traiter doivent être soigneusement nettoyées avant l’application du médicament. (Voir la section PRÉCAUTIONS.
Comment est fourni Refissa
Refissa est disponible en:
tubes de 20 g NDC 42851-012-20
tubes de 40 g NDC 42851-012-40
Stockage
Conserver à 20-25 °C (68-77 °F). NE PAS CONGELER.
Rx uniquement.
Imprimé aux États-Unis
140904-0118
Fabriqué par DPT Laboratories, San Antonio, TX 78215
Distribué par ZO Skin Health, Inc., Irvine, CA 92618
Refissa®
À USAGE TOPIQUE SUR LE VISAGE UNIQUEMENT
Quelles sont les Informations les plus importantes sur Refissa?
Refissa est un médicament sérieux. Il n’élimine pas les rides et ne répare pas la peau endommagée par le soleil. Il peut aider à traiter les rides fines, la décoloration inégale et la peau rugueuse, mais il ne « guérit » pas ces conditions. Refissa ne doit être utilisé que sous la supervision de votre fournisseur de soins de santé dans le cadre d’un vaste programme de soins de la peau. Ce programme devrait inclure d’éviter la lumière directe du soleil (en utilisant des vêtements de protection et des écrans solaires avec un FPS minimum de 15) et en utilisant d’autres crèmes hydratantes pour le visage qui ne contiennent pas de trétinoïne.
Vous ne devez utiliser Refissa qu’au coucher. N’utilisez pas de produits de soins de la peau qui sèchent. Utilisez la plus petite quantité de Refissa nécessaire et évitez de l’avoir dans les yeux, les oreilles, le nez ou la bouche.
AVERTISSEMENT : N’utilisez pas Refissa si vous êtes enceinte ou si vous tentez de le devenir. Évitez la lumière du soleil et tout autre médicament qui pourrait augmenter votre sensibilité à la lumière du soleil (voir ci-dessous).
Refissa n’a pas été étudié chez les personnes de plus de 50 ans ni chez les personnes à la peau moyennement ou faiblement pigmentée.
Qu’est-ce que Refissa ?
(Que puis-je attendre de Refissa?)
Refissa est un médicament sérieux qui peut aider à traiter mais ne « guérira » pas les rides fines, la décoloration inégale de la peau et la peau rugueuse.
Des études montrent qu’après 24 semaines, environ 30% des personnes ayant utilisé la crème à la trétinoïne, USP (Émollient) 0,05% pour les rides fines ou les décolorations inégales présentaient une amélioration modérée, 35% une amélioration minimale et 35% aucune amélioration. Environ 16% des personnes qui ont utilisé la crème de trétinoïne, USP (Émollient) 0,05% pour la peau rugueuse ont eu une amélioration modérée, 35% ont eu une amélioration minimale et 49% n’ont eu aucune amélioration. Il n’y a aucune preuve que Refissa traite la peau grossière, les rides profondes, le jaunissement de la peau ou d’autres problèmes de soins de la peau.
Refissa doit être utilisé dans le cadre d’un vaste programme de soins de la peau. Ce programme devrait inclure d’éviter la lumière directe du soleil (en utilisant des vêtements de protection et des écrans solaires avec un FPS minimum de 15) et en utilisant d’autres crèmes hydratantes pour le visage qui ne contiennent pas de trétinoïne. Beaucoup de gens peuvent obtenir les effets souhaités en utilisant ce programme sans utiliser Refissa. Vous ne devez pas utiliser Refissa avant d’avoir essayé un vaste programme de traitement de la peau sans Refissa.
Lorsque vous utilisez Refissa, l’amélioration des ridules fines, de la décoloration inégale de la peau et de la peau rugueuse n’est pas immédiate et se produit progressivement dans le temps. Généralement, vous pouvez remarquer certains effets dans 3 à 4 mois. Les effets sont généralement les plus visibles à environ 6 mois avec peu d’amélioration supplémentaire après cette période. Si Refissa est arrêté, l’amélioration diminuera progressivement.
L’innocuité de l’utilisation quotidienne de Refissa pendant plus de 48 semaines n’a pas été établie.
Qui Ne Devrait Pas Utiliser Refissa ?
Vous ne devez pas utiliser Refissa si vous êtes brûlé par le soleil ou très sensible au soleil, si vous avez de l’eczéma ou si votre peau est irritée. Refissa peut provoquer une irritation accrue de la peau et une sensibilité accrue aux coups de soleil.
Étant donné que Refissa peut rendre votre peau plus sensible au soleil, vous devez informer votre professionnel de la santé si vous utilisez également d’autres médicaments qui augmentent la sensibilité au soleil, car vous ne devez pas utiliser Refissa avec ces médicaments. Ceux-ci comprennent, sans s’y limiter: les thiazides (utilisés pour traiter l’hypertension artérielle), les tétracyclines, les fluoroquinolnes ou les sulfamides (utilisés pour traiter l’infection) et les phénothiazines (utilisés pour traiter de graves problèmes émotionnels). Si vous prenez des médicaments sur ordonnance, des médicaments en vente libre ou utilisez des crèmes pour le visage, consultez un professionnel de la santé pour vous assurer qu’ils n’interagissent pas avec Refissa.
Avertissement de grossesse: Aucune utilisation sûre pendant la grossesse n’a été démontrée. Il y a des rapports de malformations congénitales chez des animaux de laboratoire et des humains qui ont reçu de la trétinoïne par voie orale. Vous ne devez pas utiliser Refissa si vous êtes enceinte ou si vous essayez de le devenir.
On ne sait pas si Refissa est transmis aux nourrissons par le lait maternel. Une utilisation sûre chez les enfants n’a pas été démontrée.
L’innocuité et l’efficacité de Refissa chez les personnes de plus de 50 ans ou ayant une coloration cutanée plus foncée n’ont pas été prouvées.
Comment utiliser Refissa ?
Vous devez appliquer Refissa sur votre visage une fois par jour avant de vous retirer en utilisant seulement assez pour couvrir légèrement toute la zone touchée. Lavez doucement votre visage avec un savon doux, séchez la peau et attendez 20 à 30 minutes avant d’appliquer Refissa. Appliquez une quantité de crème de la taille d’un pois pour couvrir tout votre visage. Vous pouvez ressentir une chaleur ou une légère piqûre lors de la première application de Refissa.
Vous devez être particulièrement prudent lors de l’application de la crème pour éviter les yeux, les oreilles, les narines ou la bouche. Refissa peut provoquer des rougeurs sévères, des démangeaisons, des brûlures, des picotements et un pelage s’il est appliqué sur ces zones.
L’utilisation de quantités plus importantes que nécessaire de Refissa n’accélérera pas les résultats et peut provoquer un surdosage. Un surdosage peut entraîner une peau rouge et desquamée ainsi qu’une douleur ou un inconfort.
Vous pouvez utiliser des produits cosmétiques après l’application de Refissa. Assurez-vous de bien nettoyer votre visage avant d’appliquer à nouveau Refissa.
Que Dois-Je Éviter En Utilisant Refissa ?
Refissa augmente votre sensibilité au soleil. Évitez autant que possible la lumière du soleil. Utilisez des vêtements de protection et un écran solaire avec un FPS minimum de 15. Ne pas bronzer ni utiliser de lampes solaires. Si vous êtes sensible à la lumière du soleil ou si vous avez un travail qui vous oblige à rester au soleil pendant de longues périodes, vous devez faire preuve d’une extrême prudence.
Lors de l’utilisation de Refissa, évitez tout produit pouvant assécher ou irriter la peau. Par exemple, évitez les produits appliqués sur la peau qui contiennent de l’alcool, des épices ou de la chaux. Évitez également les nettoyants, l’épilation ou d’autres produits pouvant irriter la peau.
Quels Sont les Effets Secondaires Possibles de Refissa?
Les effets secondaires les plus courants sont les réactions cutanées. Des démangeaisons, une peau rouge et sèche ont été rapportées. Donc, avoir une peau brûlante, piquante et qui pèle. Ceux-ci sont le plus souvent bénins et sont les plus fréquents au début du traitement.
Comment Puis-Je Obtenir Des Informations Supplémentaires ?
Cette notice résume les informations les plus importantes concernant Refissa. Si vous souhaitez plus d’informations, parlez-en à votre médecin ou à un autre fournisseur de soins de santé. Il existe également une notice écrite à l’intention des professionnels de la santé que votre pharmacien peut vous fournir.
APPELEZ VOTRE MÉDECIN POUR OBTENIR UN AVIS MÉDICAL SUR LES EFFETS SECONDAIRES. VOUS POUVEZ SIGNALER LES EFFETS SECONDAIRES À LA FDA AU 1-800-FDA-1088.
PANNEAU D’AFFICHAGE PRINCIPAL – Carton tubulaire de 40 g
NDC 42851-012-40
117471-0118
Crème à la trétinoïne Refissa ®
,
USP (Émollient) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
En savoir plus sur Refissa (trétinoïne topique)
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Interactions médicamenteuses
- Prix &Coupons
- En Español
- Classe de médicaments: Agents topiques contre l’acné
Ressources pour les consommateurs
- Informations pour les patients
- Refissa Topique (Lecture avancée)
Ressources professionnelles
- Informations sur la prescription
- Microsphère de Gel de trétinoïne (FDA)
Autres marques Retin-A, Renova, Atralin, Altreno,… + 2 autres
Guides de traitement connexes
- Photovieillissement de la peau
Avertissement médical