Table des matières
- Résumé
- Contexte
- Méthodes
- Résultats
- Conclusions
- Mots clés
- Introduction
- Matériel et méthodes
- Résultats et discussions
- Présentation clinique des OKC
- Imagerie de l’OKC
- Le diagnostic de l’OKC
- Modalités de traitement
- Recommandation globale
- L’énucléation des OKC
- Excision de la muqueuse sus-jacente
- Énucléation des OKC suivie de l’application de la Solution de Carnoy (CS)
- Énucléation des OKC suivie d’une ostectomie périphérique
- Énucléation des OKC suivie d’une cryothérapie
- La marsupialisation seule et la marsupialisation et l’énucléation retardée
- Considérations finales
- Remerciements
- Citation
Résumé
Contexte
Le kératocyste odontogène (OKC) est un kyste odontogène localement agressif avec un taux de récidive élevé après traitement. Plusieurs chirurgies conservatrices ont été suggérées dans le traitement des kératocystes, mais travailler avec une vue d’ensemble de la pratique peut donner de meilleurs résultats.
Méthodes
Nous avons effectué une revue de la littérature dans les bases de données MEDLINE, Web of Science, Scopus, Cochrane Library et Google Scholar ainsi que dans la littérature grise (livres et thèses) pour des études portant sur la pathogenèse, la présentation clinique, l’imagerie, le diagnostic et les modalités de traitement des OKC.
Résultats
Les caractéristiques des OKC sont discutées à la lumière de la littérature afin d’établir le meilleur protocole dans le diagnostic, la planification du traitement et le traitement lui-même.
Conclusions
Les OKC méritent une attention particulière par rapport aux autres kystes odontogènes réguliers, ordinaires. Les radiographies et les tomodensitogrammes dans l’évaluation des OKC, le diagnostic histologique préopératoire et l’énucléation des OKC suivie de l’application de Carnoy et de l’excision de la muqueuse sus-jacente dans la région de fixation de la muqueuse buccale au kyste sont généralement un protocole approprié dans le traitement de l’OKC.
Mots clés
Kératocyste odontogène, Tumeur odontogène kératocystique, Kystes odontogènes, Solution de Carnoy, Thérapie, Récidive
Introduction
La dernière classification des Tumeurs de la Tête et du Cou par l’Organisation Mondiale de la Santé (2017) a réévalué les concepts sur les caractéristiques cliniques, radiologiques et biologiques de la Tumeur Odontogène Kératocystique (KCOT ) et a décidé de renommer à nouveau cette lésion en Kératocyste odontogène (OKC). La motivation de ce changement de politique fait cependant défaut. L’OKC est potentiellement une lésion très agressive (figure 1) et ce changement de nom peut provoquer une certaine confusion chez les chirurgiens et tend à diminuer la vigilance des chirurgiens pour traiter cette lésion de manière adéquate.
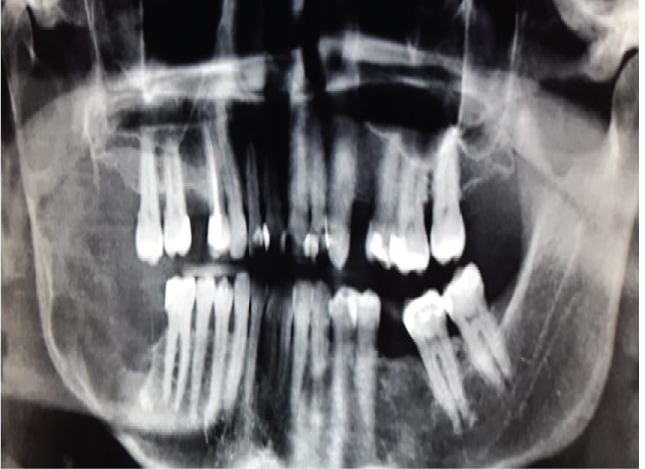 Figure 1: Grand OKC dans la région postérieure droite de la mandibule démontrant son agressivité. Voir la figure 1
Figure 1: Grand OKC dans la région postérieure droite de la mandibule démontrant son agressivité. Voir la figure 1
En dehors de son taux de récidive élevé après traitement, Emerson, et al. décrit l’extension de deux OKC récurrents dans le médiastin, via le cou. D’autres auteurs ont déjà signalé l’extension de trois OKC dans la base du crâne, deux OKC pénétrant dans le muscle temporal et deux OKC dans le muscle masséter. Quatre rapports de cas ont été publiés montrant des OKC récurrents dans une greffe osseuse. Les kystes réguliers, ordinaires et odontogènes ne se comportent pas de cette façon.
L’agressivité de l’OKC peut être attribuée à l’indice mitotique élevé de la muqueuse du kyste épithélial par rapport aux kystes odontogènes réguliers. Cela expliquerait l’OKC récurrent après une énucléation fragmentaire du kyste, alors qu’une partie de la paroi du kyste a été laissée pour compte. Même si l’on pense que les OKC proviennent de restes de la lame dentaire, les nids de cellules épithéliales et les microcystes, souvent situés dans la muqueuse buccale recouvrant les crêtes alvéolaires, peuvent également être une source importante d’OKC primaires et récurrentes. C’est notamment le cas dans la région postérieure des mâchoires.
Ces nids de cellules épithéliales et/ou microcystes proviennent de la couche basale de la muqueuse buccale et peuvent être considérés comme des hamartias. Histologiquement, un phénomène de décrochage peut être observé dans certains cas. En cas d’OKC intra-osseux résultant de la couche basale de la muqueuse buccale, une perforation osseuse peut facilement être détectée par tomodensitométrie (tomodensitométrie) et une telle zone de la muqueuse buccale sera attachée à l’OKC.
Les théories mentionnées ci-dessus sur l’origine des OKC et leur schéma de récurrence possible devraient jouer un rôle dans la planification du traitement chirurgical. Plusieurs approches, principalement conservatrices, ont été suggérées aux OKC comme l’énucléation seule, l’énucléation suivie d’une thérapie d’appoint (application de la solution de Carnoy, cryothérapie, ostectomie périphérique), l’énucléation avec ou sans thérapie d’appoint comprenant l’ablation de la muqueuse sus-jacente, la marsupialisation seule et la marsupialisation suivie d’une énucléation retardée.
En général, les modalités de traitement des OKC syndromiques (Syndrome du carcinome basocellulaire Nevoïde) sont les mêmes que celles des OKC non syndromiques. Cependant, le schéma de développement de l’OKC chez les patients syndromiques est largement influencé par des altérations moléculaires / génétiques telles que l’inactivation du PTCH1, un gène suppresseur de tumeur, ce qui explique l’une des raisons pour lesquelles les patients syndromiques ont souvent plusieurs OKC dans les os de la mâchoire. Ainsi, un OKC récurrent pourrait être, en fait, un nouvel OKC primaire.
Le but de la présente étude est de donner un aperçu clinique et de discuter, à la lumière de la littérature, des principales caractéristiques et modalités de traitement de l’OKC non syndromique.
Matériel et méthodes
Nous avons effectué une revue de la littérature dans les bases de données MEDLINE, Web of Science, Scopus, Cochrane Library et Google Scholar ainsi que dans la littérature grise (livres et thèses), à la recherche d’études sur KCOT ou OKC écrites en anglais ou en portugais. Seules les données concernant la pathogenèse, la présentation clinique, l’imagerie, le diagnostic et les modalités de traitement des OKC ont été extraites des études récupérées pour fournir des données fiables sur la base d’une politique de traitement rationnelle.
Résultats et discussions
Les OKC résultent de la prolifération de restes ou de ramifications de la lame dentaire sous forme de lésion intra-osseuse associée ou non à une dent non percée, principalement dans la zone d’appui de la dent (c.-à-d. incisives, canines, prémolaires et 1ère / 2ème zone molaire). Ils peuvent également provenir de nids de cellules épithéliales et de microcystes, souvent situés dans la couche basale de la muqueuse buccale, principalement dans la région postérieure des mâchoires (c.-à-d. 3ème molaire, angle et ramus dans la mandibule et 3ème tubérosité molaire / maxillaire dans le maxillaire). Les OKC non syndromiques peuvent également subir une mutation ou une inactivation du gène PTCH1, qui active la voie de signalisation SHH et entraîne la prolifération exacerbée de l’épithélium kystique. OKC est potentiellement très agressif et le consensus d’être une tumeur ou un kyste n’a pas encore été atteint.
Présentation clinique des OKC
Les OKC se développent dans l’espace médullaire de la mandibule ou du maxillaire sans ou peu d’expansion de l’os cortical. Ainsi, les petites lésions initiales sont généralement asymptomatiques à moins qu’elles ne soient infectées. Cependant, si le kyste perfore des régions plus minces de l’os cortical, de l’intérieur vers l’extérieur, un gonflement local peut survenir (figure 2). Cela se produit souvent avec des kystes odontogènes réguliers, ordinaires, par exemple un kyste radiculaire ou dentigère. Soudainement, les patients peuvent développer un trismus en cas d’OKC plus importants dans le ramus mandibulaire (Figure 1). Des OKC plus gros dans le maxillaire peuvent se développer dans le sinus maxillaire (Figure 3) et provoquer une obstruction nasale du même côté. D’autre part, les kystes à croissance lente peuvent stimuler l’apposition osseuse périostée et provoquer une expansion osseuse sans perforation corticale. Les OKC se produisent sur une large tranche d’âge des patients, le plus souvent dans la région postérieure de la mandibule des hommes dans la deuxième à la troisième décennie de la vie.
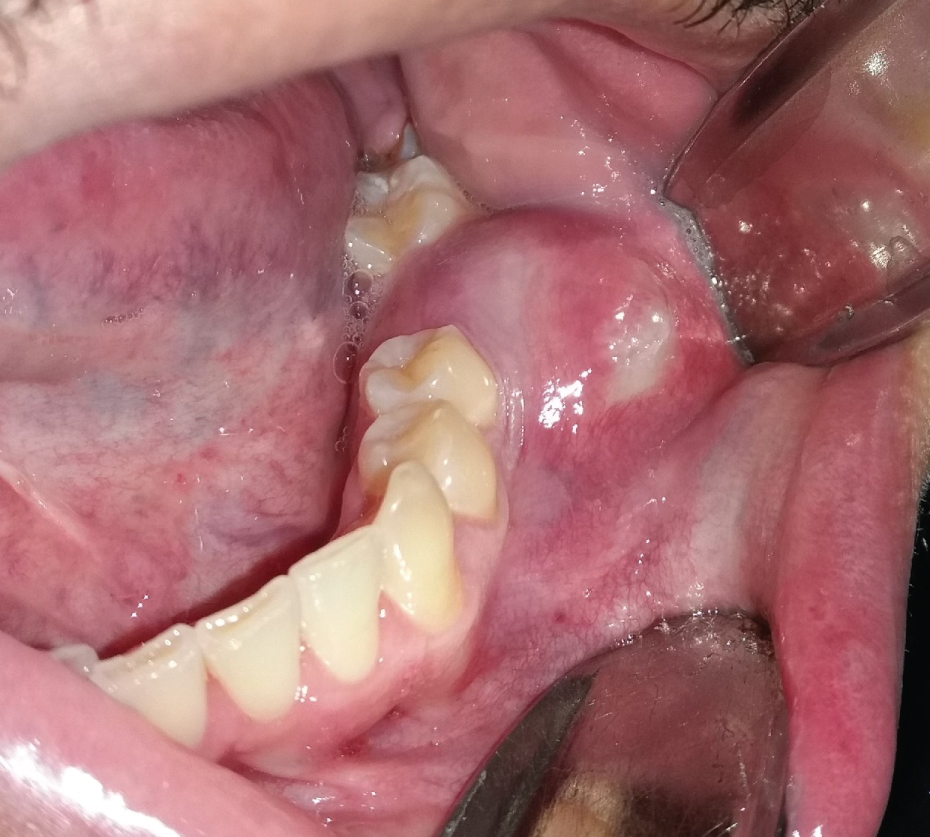 Figure 2: OKC infecté provoquant douleur et gonflement dans la région de la dent manquante 36. Voir la figure 2
Figure 2: OKC infecté provoquant douleur et gonflement dans la région de la dent manquante 36. Voir la figure 2
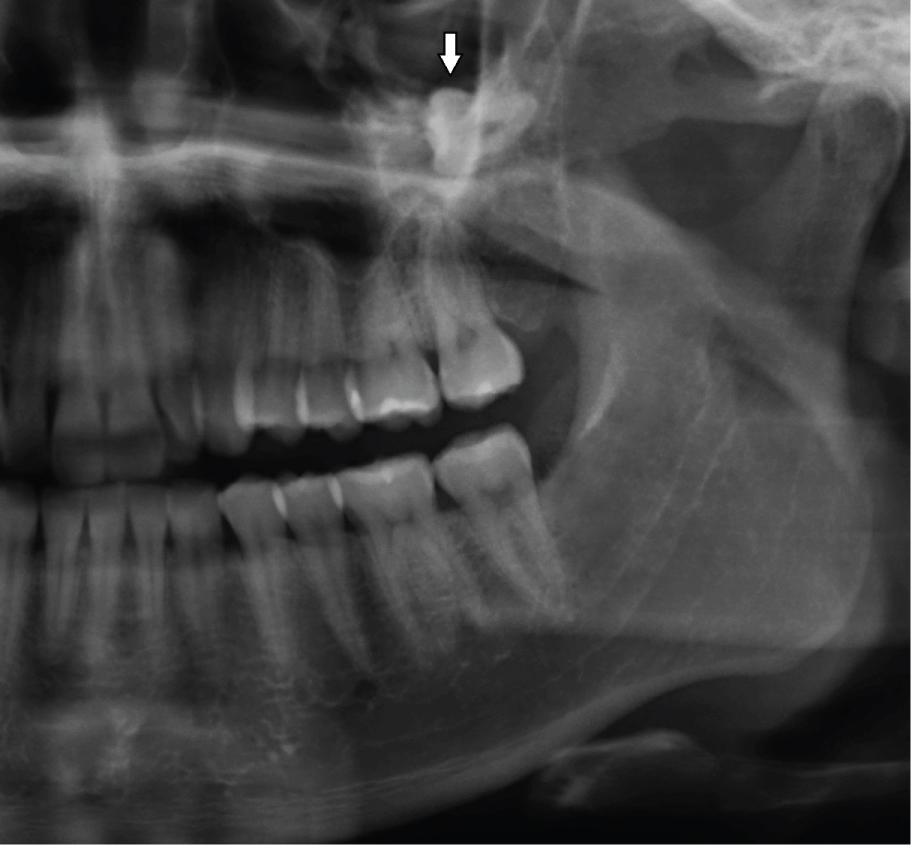 Figure 3: Grand OKC dans le sinus maxillaire gauche, déplaçant la dent 28 en haut (flèche). Voir la figure 3
Figure 3: Grand OKC dans le sinus maxillaire gauche, déplaçant la dent 28 en haut (flèche). Voir la figure 3
Imagerie de l’OKC
Radiographies de l’OKC couramment présentes sous forme de lésion kystique uniloculaire avec une bordure bien définie avec ou sans marges festonnées, mais pouvant également être multiloculaires. Souvent, ils ne se distinguent pas facilement des kystes odontogènes réguliers (figure 4). Les OKC peuvent n’avoir aucun rapport avec une dent ou la couronne peut être complètement à l’intérieur du kyste. Ils peuvent être positionnés adjacents à l’aspect latéral de la racine de la dent, semblable à un kyste parodontal latéral. Dans un examen des aspects radiographiques de 1138 OKC, rapportés dans plusieurs études, y compris les OKC récurrents et syndromiques, nous avons constaté que 672 étaient uniloculaires (59%), 342 multiloculaires (30%), 202 avaient une bordure lisse ou bien définie (18%), tandis que 70 avaient une bordure festonnée (6%). Dans de nombreux cas, l’aspect radiologique n’a pas été signalé.
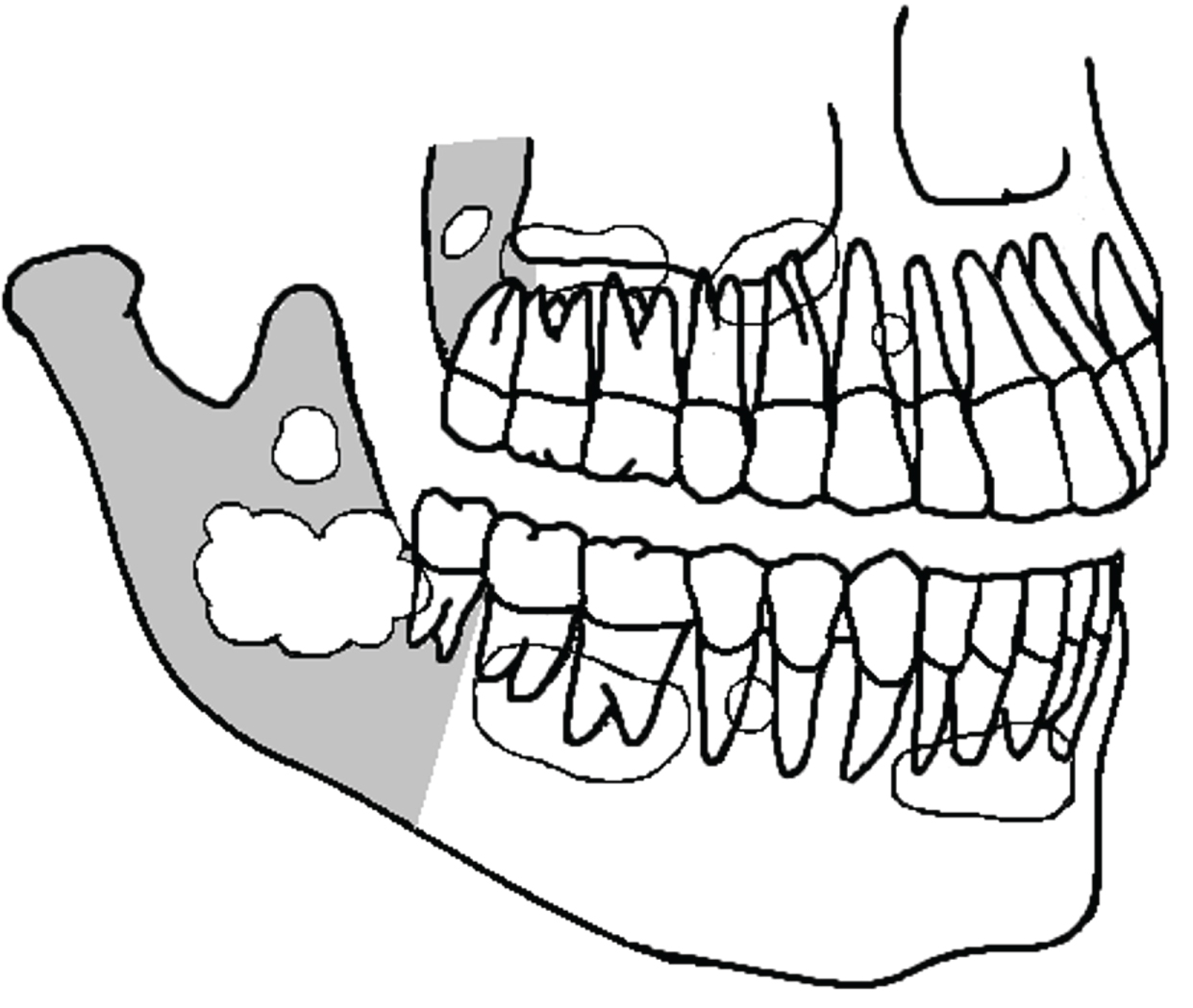 Figure 4: Quelques-unes des nombreuses possibilités de la présentation d’OKC dans la mandibule et le maxillaire (dessin schématique). Ils sont généralement confondus avec des kystes odontogènes réguliers. La zone grise est la région postérieure des os de la mâchoire. Voir la figure 4
Figure 4: Quelques-unes des nombreuses possibilités de la présentation d’OKC dans la mandibule et le maxillaire (dessin schématique). Ils sont généralement confondus avec des kystes odontogènes réguliers. La zone grise est la région postérieure des os de la mâchoire. Voir la figure 4
La tomodensitométrie est un outil précieux pour détecter toutes les dimensions de l’OKC avec une meilleure définition des structures anatomiques telles que le nerf alvéolaire inférieur (IAN), le sinus maxillaire, la cavité nasale, etc. Les tomodensitogrammes permettent la détection précise de la perforation corticale (en particulier dans l’angle / ramus de la mandibule ou dans la tubérosité maxillaire), le cas échéant. La perforation corticale est probablement la zone où la muqueuse buccale sus-jacente est attachée à l’OKC et cette région doit être incluse dans l’excision chirurgicale. Les kystes uniloculaires plus petits, en particulier dans la zone d’appui de la dent, peuvent facilement être confondus avec des kystes odontogènes réguliers, en particulier le kyste latéral parodontal.
En pratique clinique, l’imagerie par résonance magnétique (IRM) a une valeur limitée mais peut compléter l’évaluation radiologique, en particulier dans les cas d’atteinte des tissus mous d’OKC plus gros. L’IRM permet également de différencier les OKC des améloblastomes et autres kystes et tumeurs des mâchoires. L’IRM détecte la présence de locularités et de masses solides. Il montrera également l’épaisseur de la paroi du kyste et le contenu du kyste par l’intensité du signal du liquide intraluminal. Nous avons regroupé les données d’imagerie de l’IRM améliorée par contraste de 39 OKC rapportées dans deux études et avons constaté que 24 étaient uniloculaires (62%) et 15 multiloculaires (38%). L’épaisseur de la paroi du kyste était mince chez 26 OKC (67%) et épaisse chez 11 (28%). Cependant, l’information sur l’épaisseur de la capsule de 2 kystes n’était pas disponible. En ce qui concerne l’intensité du signal du fluide, 21 OKC étaient kystiques (54%). Treize étaient mixtes (33%), c’est-à-dire solides et kystiques, et 5 étaient solides (13%). La teneur en solides doit cependant être attribuée au dépôt de débris kératinisés dans le kyste et non à la prolifération intraluminale de la paroi du kyste. L’intensité du signal du liquide intraluminal (principalement dans les lésions non solides) était principalement hétérogène (30 OKC – 77%) plutôt qu’homogène (9 OKC – 23%), cette caractéristique étant particulièrement intéressante pour distinguer les OKC des améloblastomes.
Le diagnostic de l’OKC
L’évaluation histopathologique au moyen d’une biopsie incisionnelle est le meilleur moyen de diagnostiquer l’OKC avant la chirurgie, lorsque la suspicion était née de la présentation clinique et radiographique. La biopsie incisionnelle peut provoquer une inflammation de l’OKC et interférer dans l’analyse histopathologique de l’échantillon post-chirurgical. La paroi du kyste est fibreuse et bordée d’un épithélium parakératinisé régulier, mince et plié, épais de 5 à 8 couches cellulaires, sans crêtes de rete. La surface de la parakératine est généralement ondulée, et la couche basale est bien définie et souvent palissadée, avec des noyaux hyperchromatiques et des zones focales montrant une polarité nucléaire inversée. Cependant, comme mentionné précédemment, l’inflammation du kyste peut rendre un résultat faussement négatif secondaire à la métaplasie de la paroi du kyste. Les caractéristiques de l’épithélium parakératinisé et de la couche basale peuvent avoir complètement disparu.
Des biopsies d’aspiration pour l’étude des taux de protéines et des flocons de kératine dans le liquide d’aspiration peuvent faciliter le diagnostic et aider à surmonter les problèmes de résultats histopathologiques.
Modalités de traitement
Recommandation globale
Les dents non vitales proches de l’OKC peuvent être traitées et maintenues par endodontie (Figure 5a et Figure 5b), mais celles dont le kyste est adhéré à la surface radiculaire ou dont la résorption radiculaire par l’OKC doit être retirée. Après l’ablation totale de l’OKC, les patients doivent recevoir un suivi radiologique annuel les cinq premières années et au-delà tous les deux ans. Les récidives peuvent survenir sur une période aussi longue que 25 ans.
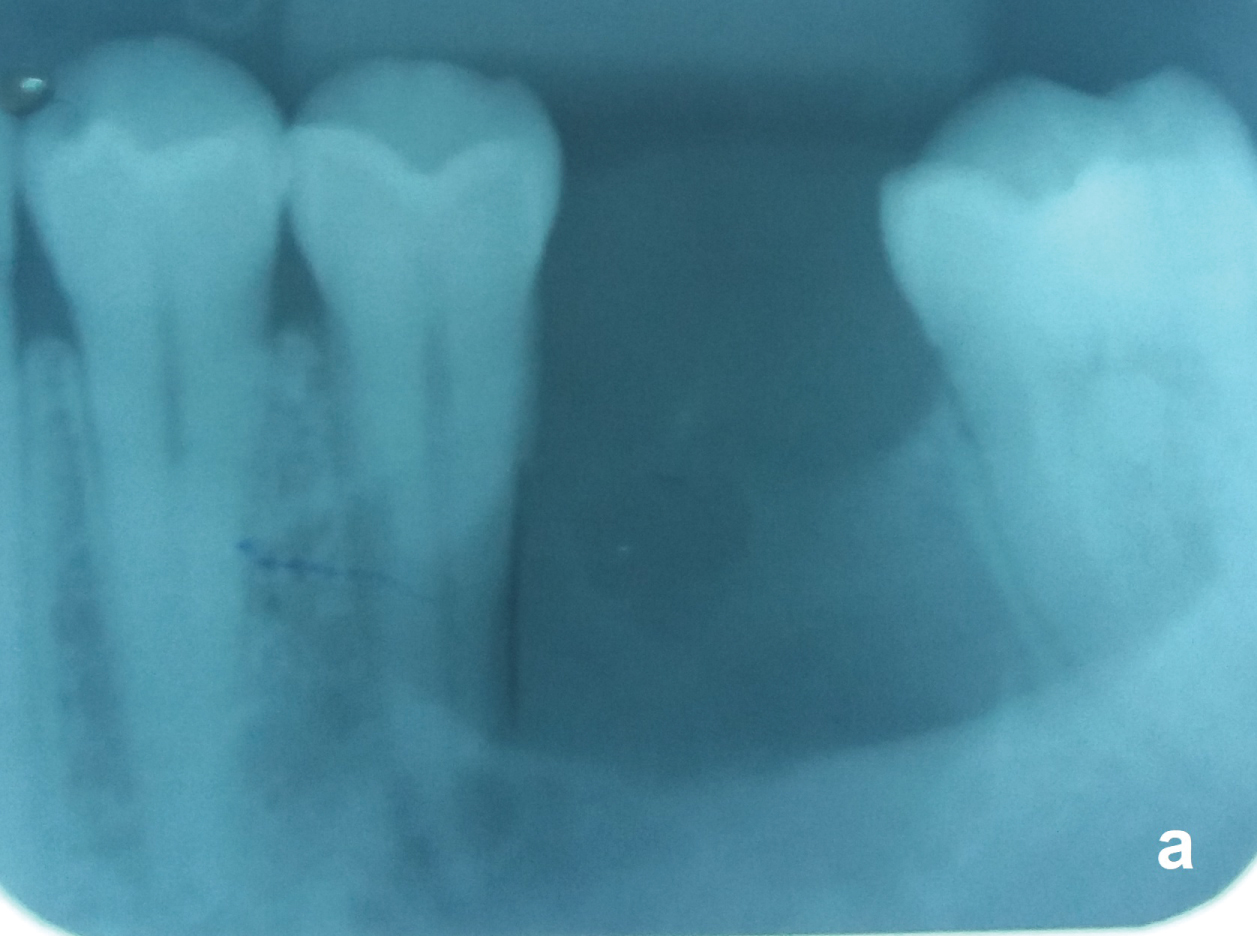 Figure 5A : Même cas de figure 2. OKC uniloculaire avec une bordure bien définie entre la dent non vitale 35 et la dent vitale 37. Observez que le ligament parodontal des deux dents est préservé. Voir la figure 5A
Figure 5A : Même cas de figure 2. OKC uniloculaire avec une bordure bien définie entre la dent non vitale 35 et la dent vitale 37. Observez que le ligament parodontal des deux dents est préservé. Voir la figure 5A
 Figure 5B: La dent 35 a été traitée par endodontie avant la chirurgie. Voir la figure 5B
Figure 5B: La dent 35 a été traitée par endodontie avant la chirurgie. Voir la figure 5B
L’énucléation des OKC
L’énucléation consiste en l’ablation totale du kyste en un seul morceau, mais cette tâche est assez difficile à réaliser en raison de la paroi fragile des OKC. Ainsi, un curetage supplémentaire de la cavité osseuse pour éliminer les fragments de kyste est fréquemment nécessaire. La muqueuse des kystes qui reste dans la cavité osseuse après l’énucléation ou le curetage augmente le risque de récidive. Par conséquent, si l’OKC a été diagnostiqué avant la chirurgie, l’énucléation seule est découragée.
Aucun traitement supplémentaire n’est nécessaire pour les petits OKC (environ 1 cm de diamètre ou moins, généralement dans la zone d’appui de la dent) diagnostiqués après l’énucléation, mais les patients doivent faire l’objet d’un suivi radiologique rigoureux. Les récidives dans ces domaines peuvent être facilement traitées sans trop de mal au patient.
Excision de la muqueuse sus-jacente
Si les tomodensitogrammes montrent une perforation corticale, la muqueuse buccale sus-jacente et sa fixation à l’OKC doivent toujours être excisées avec une marge de sécurité afin d’éliminer les nids de cellules épithéliales et / ou les microcystes situés dans cette région.
Énucléation des OKC suivie de l’application de la Solution de Carnoy (CS)
L’application de CS est probablement la meilleure option de traitement d’appoint et le traitement conservateur le plus efficace pour réduire le taux de récidive des OKC. C’est une procédure sûre et peu coûteuse. Cette solution est composée de 60% d’alcool absolu, 30% de chloroforme, 10% d’acétique glaciaire et 1 gramme de chlorure ferrique. CS provoque une fixation / inactivation immédiate des cellules épithéliales restantes après l’énucléation et inactive également les nids de cellules épithéliales ou les microcystes situés dans les zones de perforation corticale, le cas échéant. Un morceau de gaze imbibé de CS est appliqué sur la cavité osseuse avec une pince Kelly incurvée pendant 1 minute. Évitez d’appliquer CS sur le IAN, le parodonte de la dent vitale voisine et les parois osseuses minces du sinus en raison de dommages irréparables possibles à ces structures.
Malgré les résultats bénéfiques de la Solution de Carnoy (CS) dans la réduction du taux de récurrence des kératocystes odontogènes, le manque d’informations histologiques concernant ses effets hypothétiquement néfastes sur les structures exposées dans le domaine opératoire comme la nécrose osseuse et la mauvaise qualité de la néoformation osseuse a conduit de nombreux chirurgiens à s’interroger et à abandonner cette modalité de traitement complémentaire.
Énucléation des OKC suivie d’une ostectomie périphérique
L’ostectomie périphérique peut être la deuxième meilleure option de traitement d’appoint pour contrôler le taux de récidive des OKC. C’est une procédure sûre et peu coûteuse, qui donne de bons résultats en réduisant le taux de récurrence par l’élimination mécanique des cellules épithéliales restantes et des nids / microcystes de cellules épithéliales. Avec une grande fraise ronde, retirez le tissu osseux jusqu’à une profondeur de 1,5 mm le long de la cavité osseuse, sous une irrigation saline abondante.
Énucléation des OKC suivie d’une cryothérapie
Après énucléation, la pulvérisation d’azote liquide (-196.6 ℃) est appliqué une fois sur la cavité osseuse pendant 1 minute, gelant les cellules épithéliales restantes et les nids de cellules épithéliales / microcystes ce qui provoque une mort physique des cellules pathologiques jusqu’à une profondeur de 1,5 mm. Cependant, l’utilisation de cette technique pour réduire le taux de récidive est controversée. L’application du spray d’azote liquide sur les mandibules fragiles augmente le risque de fracture pathologique postopératoire.
La marsupialisation seule et la marsupialisation et l’énucléation retardée
La marsupialisation est la conversion de l’OKC en une cavité intégrante de la cavité buccale. Elle peut être définitive (marsupialisation seule) ou temporaire (marsupialisation et énucléation retardée). Lorsque le kyste est exposé au milieu buccal, la muqueuse du kyste épithélial subira une métaplasie pour devenir indiscernable de l’épithélium de la muqueuse buccale tandis que la cavité kystique diminue de taille, en raison de la décompression, qui peut être surveillée sur des radiographies ou des boîtes de tomodensitométrie. Les OKC deviennent moins agressifs après la métaplasie, mais ont toujours un taux de récidive élevé. D’autre part, la marsupialisation pendant environ 12 à 18 mois et l’énucléation retardée démontrent un meilleur résultat en ce qui concerne le taux de récurrence à condition que le fragment marsupialisé soit retiré au niveau de la perforation corticale, s’il est présent (Paul JW Stoelinga, Professeur émérite de l’Université Radboud, communication personnelle. Voir la section « excision de la muqueuse sus-jacente »). La marsupialisation peut être quelque peu lourde pour le patient. Par conséquent, il est plus indiqué chez les personnes âgées ou les patients à faible risque présentant des OKC de grande taille.
Considérations finales
Les kératocystes odontogènes méritent une attention particulière par rapport aux autres kystes odontogènes ordinaires réguliers concernant le diagnostic, la planification du traitement et le traitement lui-même. Malgré le changement actuel du nom de cette lésion, les OKC peuvent se comporter comme une tumeur et apporter une certaine confusion à la pratique clinique.
En bref, les radiographies et les tomodensitogrammes suffisent généralement à l’évaluation des OKC.Nous recommandons que les lésions suspectes fassent l’objet d’un diagnostic histologique avant de décider du traitement définitif qui sera suivi. Chez les patients en bonne santé, l’énucléation des OKC suivie de l’application de Carnoy et l’excision de la muqueuse sus-jacente dans la région d’attachement à l’OKC devraient être le traitement de choix. Dans les cas de gros OKC, principalement dans la région postérieure des mâchoires, la marsupialisation pendant 12 à 18 mois avant le traitement définitif est une bonne option pour réduire la taille de la lésion afin de diminuer le risque de l’intervention chirurgicale.
À terme, la vue d’ensemble de la pratique des OKC peut être appliquée au traitement d’autres lésions odontogènes agressives telles que l’améloblastome solide / multicystique.
Remerciements
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
- Speight P, Devilliers P, Li TJ, Odell EW, Wright JM (2017) kératocyste odontogène. Dans: El-Naggar AK, Chan JKC, Grandis JR, Takata T, Slootweg PJ, Classification OMS des tumeurs de la tête et du cou. (4e éd.), CIRC, Lyon, France, 235-236.
- Stoelinga PJW (2018) La tumeur odontogène kératocystique (KCOT) a de nouveau été renommée kératocyste odontogène (OKC). Int J Maxillofac Oral Surg 30313-30318.
- Cisaillement M, Speight PM (2007) kératocyste odontogène. Dans: Cisaillement M, Speight PM, Kystes des régions buccale et maxillo-faciale. (4e éd.), Blackwell Publishing Ltd, 6-58.
- Emerson TG, Whitlock RI, Jones JH (1972) Implication des tissus mous par des kératocystes odontogènes (kystes primordiaux). Br J Surg Oral 9:181-185.
- Jackson IT, Potparic Z, Fasching M, Schievink WI, Tidstrom K, et al. (1993) Pénétration de la base du crâne en disséquant le kératocyste. J Craniomaxillofac Surg 21:319-325.
- Franc C, Cresseaux P, Richard L, Breton P, Freidel M (1996) Le kératocyste ou kyste épidermoïde: L’état actuel de la compréhension à propos d’un cas avec atteinte intracrânienne. Rev Stomatol Chir Maxillofac 97:270-282.
- Soost F, Stoll C, Gerhardt O, Neumann HJ (1999) Kératocystes des mâchoires avec une expansion à la base du crâne. Zentralbl Neurochir 60:11-14.
- Worral SF (1992) kératocyste odontogène récurrent dans le muscle temporal. Br J Sourg orale 30, 59-62.
- Abé T, Maruyama S, Yamazaki M, Essa A, Babkair H, et al. (2014) kératocyste intramusculaire comme homologue des tissus mous de la tumeur odontogène kératocystique: Diagnostic différentiel par immunohistochimie. Humm Pathol 45:110-118.
- Makarla S, Bavle RM, Muniswamappa S, Narasimhamurthy S (2015) Une tumeur odontogène kératocystique extragnathique de grande taille. Représentant du cas Pathol 2015.
- Yamamoto K, Matsusue Y, Kurihara M, Takahashi Y, Kirita T (2013) Un kératocyste dans la muqueuse buccale présentant les caractéristiques d’une tumeur odontogène kératocystique. Dent ouverte J 7:152-156.
- Schofield JJ (1971) Récurrence inhabituelle du kératocyste odontogène. Br Dent J 130:487-489.
- Persson G (1973) Récidive remarquable d’un kératocyste dans une greffe osseuse. Int J Oral Surg 2:69-76.
- Attenborough NR (1974) Récurrence d’un kératocyste odontogène dans une greffe osseuse: Rapport d’un cas. Br J Sourg orale 12,33-39.
- DeGould MD, Goldberg JS (1991) Récurrence d’un kératocyste odontogène dans une greffe osseuse. Rapport d’une affaire. Int J Maxillofac Oral Surg 20:9-11.
- Toller P (1967) Origine et croissance des kystes des mâchoires. Ann R Coll Surg Engl 40:306-336.
- Stoelinga PJW, Peters JH (1973) Une note sur l’origine des kératocystes des mâchoires. Int J Surg Oral 2:37-44.
- Stoelinga PJ (2001) Suivi à long terme des kératocystes traités selon un protocole défini. Int J Maxillofac Oral Surg 30:14-25.
- Stoelinga PJW (2003) Étiologie et pathogenèse des kératocystes. Maxillofac Oral Surg Clin Nord Am 15:317-324.
- Stoelinga PJW, Peters JH, van de Staak WJ, Cohen MM Jr (1973) Quelques nouvelles découvertes dans le syndrome du naevus basocellulaire. Surg Oral Oral Med Pathol Oral 36: 686-692.
- Stoelinga PJ (2003) Excision de la muqueuse sus-jacente attachée, en conjonction avec l’énucléation du kyste et le traitement du défaut osseux avec une solution de carnoy. Maxillofac Oral Surg Clin Nord Am 15: 407-414.
- Al-Moraissi EA, Pogrel MA, Ellis E (2016) L’excision de la muqueuse buccale sus-jacente réduit-elle le taux de récidive dans le traitement de la tumeur odontogène kératocystique? Une revue systématique et une méta-analyse. J Maxillofac Oral Surg 74: 1974-1982.
- Blanas N, Freund B, Schwartz M, Furst IM (2000) Revue systématique du traitement et du pronostic du kératocyste odontogène. Surg Oral Med Pathol Oral Radiol Oral Endod 90: 553-558.
- Al-Moraissi EA, Dahan AA, Alwadeai MS, Oginni FO, Al-Jamali JM, et al. (2017) Quel traitement chirurgical présente le taux de récidive le plus faible après la prise en charge d’une tumeur odontogène kératocystique? Une vaste revue systématique et une méta-analyse. J Craniomaxillofac Surg 45:131-144.
- de Castro MS, Caixeta CA, de Carli ML, Ribeiro Júnior NV, Miyazawa M, et al. (2018) Traitements chirurgicaux conservateurs pour les kératocystes odontogènes non syndromiques: Une revue systématique et une méta-analyse. Clin Oral Investig 22:2089-2101.
- Philipsen HP (2005) Tumeur odontogène kératocystique. Dans: Barnes L, Eveson JW, Reichart P, Sidransky, Classification des tumeurs de l’Organisation mondiale de la Santé. Pathologie et génétique des Tumeurs de la Tête et du Cou, Presse du CIRC, Lyon, France, 306-307.
- Ribeiro Junior O, Borba AM, Alves C, De Gouveia M, Coracin FL, et al. (2018) Tumeurs odontogènes kératocystiques et solution de carnoy: Évaluation des résultats et des complications. Oral Dis 18:548-557.
- Vedtofte P, Praetorius F (1979) Récurrence du kératocyste odontogène en relation avec les caractéristiques cliniques et histologiques. Une étude de suivi de 20 ans sur 72 patients. Int J Oral Surg 8:412-420.
- Bataineh AB, al Qudah M (1998) Traitement des kératocystes odontogènes mandibulaires. Surg Oral Med Pathol Oral Radiol Oral Endod 86:42-47.
- Berge TI, Helland SB, Sælen A, Øren M, Johannessen AC, et al. (2016) Schéma de récurrence des tumeurs odontogènes kératocystiques non syndromiques. Surg Oral Med Pathol Oral Radiol Oral 122:10-16.
- Boffano P, Ruga E, Gallesio C (2010) Tumeur odontogène kératocystique (kératocyste odontogène): Examen rétrospectif préliminaire des caractéristiques épidémiologiques, cliniques et radiologiques de 261 lésions de l’Université de Turin. J Maxillofac Oral Surg 68: 2994-2999.
- Deepthi PV, Beena VT, Padmakumar SK, Rajeev R, Sivakumar R (2016) Une étude de 1177 lésions odontogènes dans une population du sud du Kerala. J Pathol Maxillo-facial oral 20:202-207.
- Leung YY, Lau SL, Tsoi KY, Ma HL, Ng CL (2016) Résultats du traitement des tumeurs odontogènes kératocystiques par énucléation et traitement du défaut osseux résiduel avec la solution de Carnoy. Int J Maxillofac Oral Surg 45: 1154-1158.
- MacDonald D, Gu Y, Zhang L, Poh C (2013) Les caractéristiques cliniques et radiologiques peuvent-elles prédire la récurrence dans les tumeurs odontogènes kératocystiques solitaires? Surg Oral Med Pathol Oral Radiol Oral 115: 263-271.
- Mamabolo M, Noffke C, Raubenheimer E (2011) Tumeurs odontogènes se manifestant au cours des deux premières décennies de vie dans un échantillon de population rurale africaine: Une analyse rétrospective de 26 ans. Dentomaxillofac Radiol 40:331-337.
- McIvor J (1972) Les caractéristiques radiologiques des kératocystes odontogènes. Br J Sourg orale 10, 116-125.
- Ong ST, Siar CH (1995) kératocystes odontogènes dans une population malaisienne: Considérations cliniques, radiologiques et histologiques. Annales Dent 2:9-14.
- Park TW, Kim SR (1985) Étude clinique et radiographique du kératocyste odontogène. Radiol oral 1:43-53.
- Simiyu BN, Butt F, Dimba EA, Wagaiyu EG, Awange DO, et al. (2013) Tumeurs odontogènes kératocystiques des mâchoires et pathologies associées: Un audit clinicopathologique de 10 ans dans un hôpital universitaire de référence au Kenya. J Craniomaxillofac Surg 41:230-234.
- Tabrizi R, Omidi M, Dehbozorgi M, Hekmat M (2014) Corrélation des caractéristiques radiographiques et des traitements avec la fréquence de récurrence dans les kératocystes odontogènes de la mandibule. J Craniofac Surg 25: e413-e417.
- Urs AB, Arora S, Singh H (2014) Lésions intra-osseuses de la mâchoire chez les patients pédiatriques: Une étude rétrospective. J Clin Diagn Res 8:216-220.
- Brondum N, Jensen VJ (1991) Récurrence des kératocystes et traitement de décompression. Un suivi à long terme de quarante-quatre cas. Surg Oral Med Oral Pathol 72:265-269.
- Nakamura N, Mitsuyasu T, Mitsuyasu Y, Taketomi T, Higuchi Y, et al. (2002) Marsupialization for odontogenic keratocysts: Analyse de suivi à long terme des effets et des changements dans les caractéristiques de croissance. Surg Oral Med Pathol Oral Radiol Oral Endod 94: 543-553.
- Cunha JF, Gomes CC, De Mesquita RA, Goulart EMA, De Castro WH, et al. (2016) Caractéristiques clinicopathologiques associées à la récurrence du kératocyste odontogène: Une analyse rétrospective de cohorte. Surg Oral Med Pathol Oral Radiol Oral 121: 629-635.
- Irvine GH, Bowerman JE (1985) kératocystes mandibulaires: Gestion chirurgicale. Br J Maxillofac Oral Surg 23:204-209.
- Minami M, Kaneda T, Ozawa K, Yamamoto H, Itai Y, et al. (1996) Lésions kystiques de la région maxillo-mandibulaire: distinction par imagerie MR des kératocystes odontogènes et des améloblastomes d’autres kystes. AJR Am J Roentgenol 166:943-949.
- Probst FA, Probst M, Pautke Ch, Kaltsi E, Otto S, et al. (2015) Imagerie par résonance magnétique: Un outil utile pour distinguer les tumeurs odontogènes kératocystiques des kystes odontogènes. Br J Maxillofac oral Surg 53:217-222.
- Rodu B, Tate AL, Martinez MG (1987) Les implications des inflammations dans les kératocystes odontogènes. J Pathol Oral 16:518-521.
- Haring JI, van Dis ML (1988) kératocystes odontogènes: Étude clinique, radiographique et histologique. Surg Oral Med Oral Pathol 66:145-153.
- Voorsmit RACA (1984) L’incroyable kératocyste. Université de Nimègue.
- Johnson NR, Batstone MD, Savage NW (2013) Gestion et récurrence de la tumeur odontogène kératocystique: Une revue systématique. Surg Oral Med Pathol Oral Radiol Oral 116: 271-276.
- Slusarenko da Silva Y (2016) analyse histologique des effets de la solution de carnoy sur les défauts monocorticaux effectués dans la mâchoire de rats Wistar. Université de São Paulo.
Citation
Slusarenko da Silva Y, Naclério-Homem MG (2018) Traitement conservateur du Kératocyste odontogène primaire et Non Syndromique: Un aperçu de la pratique. Int J Santé dentaire dentaire 4:070. doi.org/10.23937/2469-5734/1510070