Un sucre spécial: comment l’acide sialique affecte le métabolisme, la santé et les maladies
Nous regorgeons de microbes qui vivent sur les surfaces extérieures et intérieures de notre corps. Notre compréhension du microbiome intestinal en particulier s’améliore rapidement à mesure que nous commençons à déceler comment les communautés microbiennes complexes interagissent avec notre alimentation, avec d’autres microbes et avec nos surfaces cellulaires. Alors que de nombreux produits chimiques sont importants dans ce milieu, nous nous concentrons ici sur les acides sialiques en tant qu’ensemble critique de molécules qui sous-tendent bon nombre de ces interactions et ont un impact sur le métabolisme, la santé et les maladies.
L’acide sialique le plus courant, l’acide N-acétyl-neuraminique (Neu5Ac) (Fig. 1) est un acide sucrier relativement simple qui, en dehors de sa charge, n’a rien d’intrinsèquement inhabituel. Cependant, lorsque les cellules entrent en contact avec d’autres cellules, elles utilisent souvent des molécules affichées à la surface, et c’est là que les acides sialiques deviennent si importants, car ce sont généralement les sucres terminaux des glycanes hôtes qui poivrent les protéines et les lipides assis à la surface des cellules. Les glycoprotéines de mucine sécrétées à la surface des cellules sont de bons exemples de structures revêtues d’acide sialique que les microbes pourraient rencontrer à la surface des muqueuses, telles que les voies respiratoires ou gastro-intestinales (GI). Cette position unique en tant que molécule de « rencontre et d’accueil » pour d’autres cellules humaines, des cellules bactériennes et des virus place les acides sialiques au centre de nombreux processus importants.
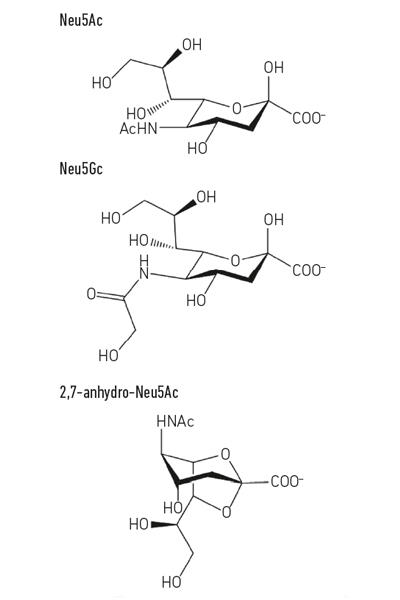
- Fig. 1. Exemple de dérivés de l’acide sialique. Notez que l’acide N-glycolyl-neuraminique (Neu5Gc) ne peut pas être fabriqué par l’homme, une différence biochimique qui nous distingue des autres grands singes, mais peut être incorporé à nos surfaces cellulaires lorsqu’il est acquis de l’alimentation.
- Agents pathogènes enrobés de sucre
- Alimentation croisée – partageant les bonbons autour
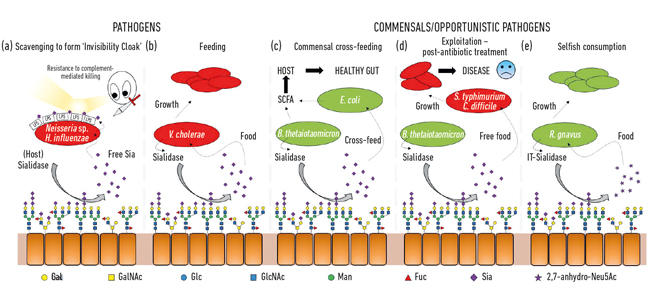
- Fig. 2. Illustration caricaturale des différentes interactions entre les bactéries et les acides sialiques présents sous forme de sucres terminaux sur une gamme de glycanes hôtes. Ceux-ci sont clivés par des sialidases et généralement convertis en Neu5Ac libre à l’exception de l’IT-sialidase qui libère de la 2,7-anhydro-Neu5Ac. L’acide sialique libre libéré par les sialidases hôtes ou pathogènes peut alors être utilisé par les agents pathogènes comme cape d’invisibilité (a), ou pour l’alimentation (b). L’alimentation croisée peut se produire entre des membres du microbiote intestinal ou entre des bactéries commensales et pathogènes partageant la même niche (c, d) tandis que d’autres bactéries ont développé des mécanismes égoïstes pour réserver l’acide sialique pour leur propre consommation (e).
- Garder la main sur ses propres bonbons
- Les virus passent à l’acte
- Pour en savoir plus
- Andrew Bell
- Emmanuele Severi
- Nathalie Juge
- Gavin H. Thomas
- Pourquoi la microbiologie est-elle importante ?
- Quels conseils donneriez-vous à quelqu’un qui débute dans ce domaine ?
Fig. 1. Exemple de dérivés de l’acide sialique. Notez que l’acide N-glycolyl-neuraminique (Neu5Gc) ne peut pas être fabriqué par l’homme, une différence biochimique qui nous distingue des autres grands singes, mais peut être incorporé à nos surfaces cellulaires lorsqu’il est acquis de l’alimentation.
Agents pathogènes enrobés de sucre
L’une des premières fonctions microbiennes des acides sialiques était liée à la capacité de certains agents pathogènes à coloniser puis à provoquer des maladies chez l’homme. En effet, l’ex-président de la Microbiology Society, le professeur Harry Smith FRS, travaillant à l’Université de Birmingham, a été le pionnier de ce travail avec la gonorrhée Neisseria. Lorsque les scientifiques de son groupe ont isolé l’insecte directement du corps, il était résistant à la mort par le sérum humain (meurtre médié par le complément), mais si les insectes étaient cultivés en laboratoire pendant quelques générations, cette protection était perdue et les cellules étaient tuées par le sérum. Son groupe avait découvert que ces agents pathogènes volaient l’acide sialique de l’hôte et l’utilisaient pour enrober leur propre surface cellulaire afin de les humaniser. Cependant, comme ils ne peuvent que récupérer cet acide sialique, son absence dans les milieux de croissance signifie qu’aucun autre acide sialique n’est ajouté, de sorte qu’ils perdent rapidement cette « protection sérique » et sont tués. Il s’avère qu’une série d’autres insectes sournois utilisent des stratégies similaires pour générer leur propre cape d’invisibilité à l’aide d’acide sialique, tels que Neisseria meningitidis, Campylobacter jejuni ou Haemophilus influenzae (Fig. 2a)
Alimentation croisée – partageant les bonbons autour
En plus d’être utilisés par les agents pathogènes comme cape d’invisibilité, les acides sialiques sont de très bons aliments pour les bactéries, car ils fournissent à la fois du carbone et de l’azote, et peuvent être utilisés comme source d’énergie. Des travaux antérieurs ont montré que des agents pathogènes tels que Vibrio cholerae étaient heureux de manger de l’acide sialique et que cela était en soi important pour une colonisation réussie de l’hôte (Fig. 2b).
Dans l’intestin, une source majeure d’acides sialiques provient des mucines, qui sont les principaux composants structurels de la couche de mucus recouvrant la surface de l’épithélium. La couche de mucus la plus exposée est l’habitat de diverses bactéries commensales, qui ont appris à se régaler de protéines de mucine, où les sucres font 80% de leur masse. D’un point de vue topologique simple, les acides sialiques, en tant que sucres terminaux, sont récoltés en premier, exposant les sucres sous-jacents qui peuvent également être ensuite libérés et consommés. Avec l’avènement du séquençage de nouvelle génération, nous avons acquis des connaissances sur les microbes vivant dans ce créneau, et beaucoup ont des gènes pour l’absorption de l’acide sialique et le catabolisme ultérieur. Ce qui était passionnant, c’est la découverte que certains des anaérobies commensaux, comme Bacteroides thetaiotaomicron, sécrètent des sialidases pour libérer l’acide sialique mais manquent de transporteurs et de gènes cataboliques pour l’utiliser réellement. Ce geste apparemment altruiste est nécessaire pour que les bactéries accèdent aux sucres sous-jacents et sous-tend un processus de croisement métabolique avec d’autres insectes vivant dans la niche du mucus, comme les souches commensales d’Escherichia coli qui ne possèdent pas de sialidase mais sont bonnes à manger de l’acide sialique libre (Fig. 2c). Ce concept est maintenant reconnu comme un aspect important de la colonisation et de l’adaptation de niche. Une brillante illustration de cela a été décrite par le groupe de Justin Sonnenburg de l’Université de Stanford, en utilisant un modèle de souris avec un microbiote intestinal simple défini. Après un traitement antibiotique, de nombreuses bactéries mangeuses d’acide sialique ont été éliminées, entraînant l’accumulation d’acide sialique libre dans l’intestin. Lorsqu’ils sont ensuite confrontés à des agents pathogènes tels que Salmonella typhimurium ou Clostridium difficile, ces agents pathogènes bénéficieraient de l’acide sialique libre en tant que nutriment (Fig. 2d). Les souches mutantes d’agents pathogènes dépourvues de transporteurs ou de gènes cataboliques n’avaient pas d’avantage, établissant un lien direct avec la prolifération des agents pathogènes lorsque la communauté microbienne intestinale est perturbée. Des mécanismes visant à réduire le pool d’acide sialique libre dans l’intestin ont donc été proposés dans le cadre d’une nouvelle stratégie anti-infectieuse.
Fig. 2. Illustration caricaturale des différentes interactions entre les bactéries et les acides sialiques présents sous forme de sucres terminaux sur une gamme de glycanes hôtes. Ceux-ci sont clivés par des sialidases et généralement convertis en Neu5Ac libre à l’exception de l’IT-sialidase qui libère de la 2,7-anhydro-Neu5Ac. L’acide sialique libre libéré par les sialidases hôtes ou pathogènes peut alors être utilisé par les agents pathogènes comme cape d’invisibilité (a), ou pour l’alimentation (b). L’alimentation croisée peut se produire entre des membres du microbiote intestinal ou entre des bactéries commensales et pathogènes partageant la même niche (c, d) tandis que d’autres bactéries ont développé des mécanismes égoïstes pour réserver l’acide sialique pour leur propre consommation (e).
Garder la main sur ses propres bonbons
Alors que la sialomicrobiologie beaucoup plus précoce s’est concentrée sur les agents pathogènes, des travaux plus récents se sont concentrés sur les bactéries commensales habitant la même niche. Les études d’aujourd’hui dans le domaine du microbiote intestinal révèlent à quel point la concurrence pour le Neu5Ac est féroce dans notre intestin et comment il peut faire pencher la balance entre les agents pathogènes et les commensaux. Et si une bactérie particulière pouvait libérer de l’acide sialique sous une forme à laquelle elle seule pouvait accéder? Des travaux dans le groupe Juge à Norwich ont montré que le symbiote intestinal Ruminococcus gnavus a évolué pour le faire, en utilisant un type spécial de sialidase appelé trans-sialidase intramoléculaire (IT-sialidase) qui libère de la 2,7-anhydro-Neu5Ac (voir Fig. 1) au lieu de Neu5Ac. En développant une méthode de synthèse du 2,7-anhydro-Neu5Ac pur, ils ont montré que les souches de R. gnavus étaient capables de se développer sur le 2,7-anhydro-Neu5Ac comme seule source de carbone. En plus du domaine catalysant la réaction enzymatique, les IT-sialidases comprennent un domaine de liaison glucidique qui aide à médier la liaison de l’IT-sialidase aux mucines riches en acide sialique. In vivo, cela peut favoriser un mécanisme qui aide à cibler les bactéries vers les régions riches en acide sialique du tractus gastro-intestinal, favorisant ainsi la colonisation bactérienne dans la couche de mucus. Une fois située au bon endroit, l’IT-sialidase clive l’acide sialique des chaînes terminales des mucines et le libère sous une forme, 2,7-anhydro-Neu5Ac, que R. gnavus peut utiliser comme sa propre source de nourriture, plutôt que de partager Neu5Ac avec d’autres bactéries habitant la niche du mucus, y compris des agents pathogènes (Fig. 2e). Ce mécanisme offre un avantage concurrentiel par rapport aux autres bactéries mangeuses d’acide sialique habitant la niche du mucus, en fournissant une source de nutriments à laquelle elle peut accéder préférentiellement. En outre, R. gnavus peut également aider à réduire la prolifération des agents pathogènes entériques en réduisant le taux de Neu5Ac dans l’environnement muqueux, ouvrant la voie à une nouvelle stratégie thérapeutique à une époque de résistance croissante aux antibiotiques.
Les virus passent à l’acte
Les virus utilisent également les acides sialiques comme molécules clés au cours de leur cycle d’infection, le plus célèbre étant le virus de la grippe. La fixation initiale est la première étape clé car les acides sialiques fonctionnent comme les récepteurs du virus sur les cellules épithéliales respiratoires. Le type de liaison de l’acide sialique aux sucres sous-jacents dans les glycanes contrôle souvent la gamme hôte des virus grippaux, et les souches pandémiques ont souvent une protéine d’adhésion (hémagglutinine) qui reconnaît les formes humaines d’attachement à l’acide sialique et sont donc particulièrement virulentes. L’acide sialique est important au dernier stade du cycle de vie viral car la libération de la cellule infectée nécessite un clivage des acides sialiques de la surface de la cellule hôte. Ceci est catalysé par une enzyme virale appelée sialidase (ou neuraminidase). L’inhibition de cette enzyme par des analogues structuraux de l’acide sialique, formulés en Tamiflu® (phosphate d’Oseltamivir) et en Zanamivir, sont notre traitement de première ligne contre la grippe et sont un triomphe de la conception de médicaments inspirée de la structure / fonction.
En conclusion, il est clair que les acides sialiques sont des molécules critiques dans de nombreux processus où les cellules microbiennes et les virus interagissent avec les surfaces cellulaires des mammifères. Dans ce court article, nous avons abordé certains d’entre eux pour donner une idée des fonctions centrales de ces sucres dans la communication, la furtivité, la colonisation et le métabolisme dans différents aspects de la santé et de la maladie. Les acides sialiques ont été décrits comme les produits chimiques les plus importants au monde et continueront sans doute à en révéler davantage sur l’évolution des humains et leur interaction avec leurs microbes.
Pour en savoir plus
Thomas, GH. Acquisition d’acide sialique dans les bactéries – un substrat, de nombreux transporteurs. Biochem Soc Trans 2016; 44: 760-765.
Ng KM, Ferreyra JA, Higginbottom SK, Lynch JB, Kashyap PC et al. Les sucres hôtes libérés par le microbiote facilitent l’expansion post-antibiotique des agents pathogènes entériques. Nature 2013; 502:96-99.
Owen CD, Tailford LE, Monaco S, Šuligoj T, Vaux L et al. Démêler la spécificité et le mécanisme de reconnaissance de l’acide sialique par le symbionte intestinal Ruminococcus gnavus. Nat Commun 2017; 8: 2196.
Tailford LE, Owen CD, Walshaw J, Crost EH, Hardy-Goddard J, Le Gall G, de Vos WM, Taylor GL, Juge N. La découverte de trans-sialidases intramoléculaires dans le microbiote intestinal humain suggère de nouveaux mécanismes d’adaptation des muqueuses. Nat Commun 2015; 6:7624.
Juge N, Tailford L, Owen CD. Sialidases des bactéries intestinales: un mini-examen. Biochem Soc Trans 2016; 44: 166-175.

Andrew Bell
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, Royaume-Uni
Andrew Bell est un étudiant de troisième cycle au Département des microbes intestinaux et de la santé de l’Institut Quadram qui étudie l’impact d’un nouveau mécanisme du métabolisme de l’acide sialique sur l’homéostasie intestinale. Il a obtenu son BSc en biochimie de l’Université d’East Anglia et a travaillé pendant 2 ans au Centre John Innes sur le métabolisme de la chlorophylle dans le pois (Pisum sativum) avant de rejoindre le groupe de Nathalie Juge à l’Institut Quadram en 2015 pour son travail de doctorat.

Emmanuele Severi
Département de biologie, Université de York, Wentworth Way, York YO10 5DD, Royaume-Uni
@emm_severi
Emmanuele Severi est associée de recherche postdoctorale au Département de biologie de l’Université de York, travaillant dans le laboratoire du Professeur Gavin Thomas. Il a travaillé sur le transport et le métabolisme de l’acide sialique à différents moments de sa carrière et est membre de la Société depuis 2002.

Nathalie Juge
Quadram Institute Bioscience, Norwich Research Park, NR4 7UQ, Royaume-Uni
Nathalie Juge est Chef de recherche au Quadram Institute Bioscience (QIB) à Norwich, Chef adjointe du Programme Stratégique de l’Institut, les Microbes intestinaux et la Santé (GMH), et Professeure honoraire à la School of Biological Sciences de l’Université d’East Anglia. Elle dirige un groupe de recherche sur la glycobiologie des interactions hôte-microbe dans l’intestin avec un accent sur le métabolisme de l’acide sialique dérivé de la mucine par le microbiote intestinal (https://quadram.ac.uk/nathalie-juge).

Gavin H. Thomas
Département de biologie, Université de York, Wentworth Way, York YO10 5DD, Royaume-Uni
@GavinHThomas
Gavin H. Thomas est professeur de microbiologie au Département de biologie de l’Université de York et travaille sur le transport et le catabolisme de l’acide sialique bactérien depuis plus d’un an décennie. Il est membre de la Société depuis 1995, a été rédacteur en chef de Microbiology Today (2003-2006), a siégé au Conseil au cours de la même période, a siégé au comité des communications (2012-2015) et au comité de la diversité de & (2013-2015). Il a été Rédacteur en chef, Rédacteur en chef et est maintenant Rédacteur en chef adjoint de la revue de référence de la Société Microbiology (http://thomaslabyork.weebly.com).
Pourquoi la microbiologie est-elle importante ?
Gavin: C’est important pour notre santé – ce n’est que maintenant que nous commençons vraiment à comprendre la composition moléculaire et la fonction de notre microbiome, qui a probablement un impact sur notre corps de multiples façons.
Quels conseils donneriez-vous à quelqu’un qui débute dans ce domaine ?
Gavin: Lisez largement et au-delà de « votre bug » – les microbes peuvent faire à peu près tout et ont généralement inventé plusieurs façons de le faire!
Images: Particules du virus de la grippe H3N2. Photothèque CDC/ Science.
Fig. 1. Andrew Bell.
Fig. 2. Emmanuele Severi.