Vitamine C: Un Agent Antioxydant
Métabolisme redox et propriétés antioxydantes de la vitamine C
Les radicaux libres et les oxydants jouent un double rôle en tant que composés toxiques et bénéfiques, dans les processus métaboliques et en réponse aux stimulations exogènes. Ils sont produits soit par des activités métaboliques normales, soit par des facteurs environnementaux (pollution, fumée de cigarette et radiations). Lorsqu’une surcharge de radicaux libres ne peut pas être éliminée, leur accumulation dans le corps génère un stress oxydatif. Le stress oxydatif se produit lorsque la formation de radicaux libres dépasse la capacité de protection contre eux. Ce processus conduit au développement de maladies chroniques et dégénératives telles que le cancer, les maladies auto-immunes, le vieillissement, la cataracte, la polyarthrite rhumatoïde, les maladies cardiovasculaires et neurodégénératives. Un antioxydant est une molécule qui empêche l’oxydation d’autres molécules. Le processus d’oxydation est une réaction chimique qui produit des radicaux libres, entraînant des réactions en chaîne susceptibles d’endommager les cellules. L’effet antioxydant de la vitamine C a été bien documenté. La vitamine C est un puissant antioxydant capable de donner un atome d’hydrogène et de former un radical libre ascorbyle relativement stable. La vitamine E, la vitamine C et le β-carotène sont connus comme des vitamines antioxydantes qui sont suggérées pour diminuer les dommages oxydatifs et réduire le risque de certaines maladies chroniques. Les maladies, telles que les troubles cardiovasculaires, sont associées à des concentrations inadéquates d’acide l-ascorbique, de tocophérol et de β-carotène dans les études épidémiologiques. La vitamine C améliore également l’absorption du fer en réduisant le Fe3+ en Fe2 + provenant de sources de fer non hémique. En présence d’ions redox actifs (fer, cuivre), la vitamine C agit comme un prooxydant, contribuant à la formation de radicaux hydroxyles, pouvant conduire à l’oxydation des lipides, de l’ADN ou des protéines. Il existe différents mécanismes pour soulager le stress oxydatif et réparer les macromolécules endommagées. Les antioxydants enzymatiques et non enzymatiques jouent un rôle important dans le piégeage des radicaux libres et des espèces réactives de l’oxygène (ROS). Les enzymes antioxydantes, la catalase (CAT), la superoxyde dismutase (SOD), la glutathion réductase (GR), la glutathion peroxydase (GSHpx) et, chez les plantes, l’ascorbate peroxydase (AA-px) et les antioxydants non enzymatiques, y compris le glutathion (GSH) et l’ascorbate (ASC), ont été significativement affectés par le stress oxydatif. Les composés antioxydants peuvent empêcher la formation incontrôlée de radicaux libres ou inhiber leur réaction avec des sites biologiques; en outre, la destruction de la plupart des radicaux libres dépend de l’oxydation des antioxydants endogènes principalement par le balayage et la réduction des molécules. On pense que la vitamine C est un antioxydant soluble dans l’eau important qui neutraliserait les ROS et réduirait le stress oxydatif.
La vitamine C est un puissant agent réducteur et piégeur des radicaux libres dans les systèmes biologiques. Il est impliqué dans la première ligne de défense antioxydante, protégeant les membranes lipidiques et les protéines des dommages oxydatifs. En tant que molécule soluble dans l’eau, la vitamine C peut agir à la fois à l’intérieur et à l’extérieur des cellules, et peut neutraliser les radicaux libres et prévenir les dommages causés par les radicaux libres. La vitamine C est une excellente source d’électrons pour les radicaux libres qui recherchent un électron pour retrouver leur stabilité. La vitamine C peut donner des électrons aux radicaux libres et étancher leur réactivité.
Il a été démontré que la vitamine C est un piégeur efficace contre les espèces d’oxygène et d’oxyde d’azote, telles que l’ion radicalaire superoxyde, le peroxyde d’hydrogène, le radical hydroxyle et l’oxygène singulet. Cette propriété de la vitamine C a des processus vitaux dans la protection des composants cellulaires contre les dommages induits par les radicaux libres. De plus, la vitamine C est efficace pour régénérer la forme antioxydante de la vitamine E en réduisant les radicaux tocophéroxyles. Ce processus protège les membranes et autres compartiments de la cellule des dommages induits par les radicaux libres (Figure 2). L’ascorbate peroxydase (APX) est une enzyme réduisant l’H2O2 en eau en utilisant l’ascorbate comme donneur d’électrons. Le monodéhydroascorbate est un ascorbate oxydé qui est régénéré par la monodéhydroascorbate réductase (MDAR). Le radical monodéhydroascorbate se disproportionne rapidement en ascorbate et en déhydroascorbate. Dehydroascorbate is reduced to ascorbate by dehydroascorbate reductase in the presence of GSH, yielding oxidized glutathione (GSSG). It is reduced by glutathione reductase (GR) using nicotinamide adenine dinucleotide phosphate hydrogen (NADPH) as an electron donor. Dehydroascorbate may be reduced nonenzymatically or catalyzed by proteins with dehydroascorbate reductase (DHAR) activity.
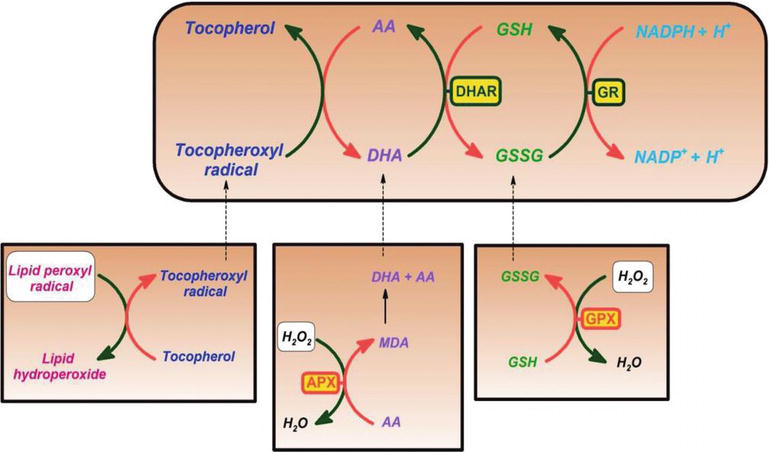
Figure 2.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceAscorbate and redox cycling antioxidants. AA, ascorbate; DHA, dehydroascorbate; DHAR, semidehydroascorbate reductase; GSH, glutathione; GSSG, semi-glutathione reductase; GR, glutathione reductase; APX, ascorbate peroxidase; and GPX, glutathione peroxidase .
Glutathione-ascorbate cycle operates in the cytosol, mitochondria, plastids, and peroxisomes in plants . Il est suggéré que le cycle glutathion-ascorbate joue un rôle clé pour la détoxification de l’H2O2, en raison des concentrations élevées de glutathion, d’ascorbate et de NADPH dans les cellules végétales. D’autres enzymes, telles que l’ascorbate et les glutathion peroxydases, qui utilisent des thiorédoxines ou des glutarédoxines comme substrats réducteurs, jouent également un rôle dans l’élimination de l’H2O2 chez les plantes (figure 2).
La vitamine C forme également le radical semidydroascorbyle, un radical à durée de vie relativement longue, dans la régénération de la vitamine E à partir de sa forme radicalaire, ainsi que dans les radicaux piégeurs. Les cellules végétales et animales contiennent une enzyme semi-hydroxydroascorbate réductase dépendante du NADH (EC 1.6.5.4), réduisant le radical en vitamine C en utilisant le NADH comme source d’agent réducteur (Figure 2). enzymatiquement et non enzymatiquement, il peut se décomposer de manière irréversible en acide dicétogluconique ou il peut être converti en ascorbate dans une réaction dépendante du glutathion.
En tant que substance réductrice et donneur d’électrons, lors du piégeage des radicaux libres, la vitamine C donne des électrons de haute énergie pour neutraliser les radicaux libres, et elle est oxydée en acide déhydroascorbique. L’acide déhydroascorbique peut être reconverti en acide ascorbique pour être réutilisé ou peut être métabolisé, libérant davantage d’électrons. Bien que la vitamine C soit absorbée par l’intestin via un transporteur de vitamine C dépendant du sodium, la plupart des cellules transportent la vitamine C sous une forme oxydée (acide déhydroascorbique) via le transporteur de glucose 1. L’acide déhydroascorbique est réduit pour générer de l’acide ascorbique à l’intérieur de la cellule, protégeant les mitochondries des dommages oxydatifs induits par les radicaux libres (Figures 2 et 3). Radicaux libres hautement réactifs (p.ex., RO-, RO2-, OH-,, NO2) sont réduits par l’ascorbate et le radical ascorbyle nouvellement généré est peu réactif. L’ascorbate peut également piéger des espèces réactives non radicales, dérivées de la peroxynitrite, telles que l’acide hypochloreux, l’ozone et les agents nitrants. La vitamine C est un catalyseur d’oxydoréduction (redox) monosaccharidique que l’on trouve chez les animaux et les plantes. L’effet antioxydant de la vitamine C est dû à sa capacité à donner des électrons du deuxième et du troisième carbone. Au cours de l’évolution des primates, l’une des enzymes nécessaires à la fabrication de l’acide ascorbique a été perdue par mutation, les humains doivent l’obtenir de l’alimentation; la plupart des animaux peuvent synthétiser cette vitamine dans leur corps et n’en ont pas besoin dans leur alimentation. La vitamine C est nécessaire à la conversion du procollagène en collagène en oxydant les résidus de proline en hydroxyproline. Dans d’autres cellules, il est maintenu sous sa forme réduite par réaction avec le glutathion. Comme le montrent les figures 2 et 3, l’acide ascorbique est un catalyseur redox qui peut réduire, et ainsi neutraliser, les ROS tels que le peroxyde d’hydrogène (H2O2) (Figures 2 et 3).
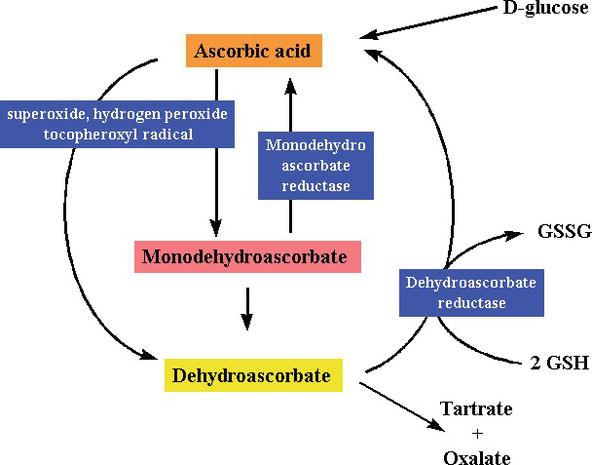
Figure 3.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceSynthesis and degradation ofl-ascorbic acid in plant tissues .
Ascorbic acid has direct antioxidant effects, and also it is a substrate for the redox enzyme ascorbate peroxidase, that is particularly important in stress resistance in plants. L’acide ascorbique est présent à des niveaux élevés dans toutes les parties des plantes, en particulier dans les chloroplastes qui y atteignent des concentrations de 20 mM. Le déhydroascorbate (DHA) et le radical libre d’ascorbate (AFR), en tant qu’intermédiaire, le radical libre d’ascorbate (AFR), qui sont des oxydations réversibles à un électron, sont générés à partir de l’ascorbate (Figure 4). Selon le modèle généralement supposé d’élimination enzymatique du ROS, SOD catalyse l’anion superoxyde en H2O2 et en oxygène; puis H2O2 est réduit en eau et en oxygène moléculaire par CAT. CAT turnover number is very high, but its affinity for H2O2 is relatively low, and consequently a certain amount of H2O2 remains in the cell.
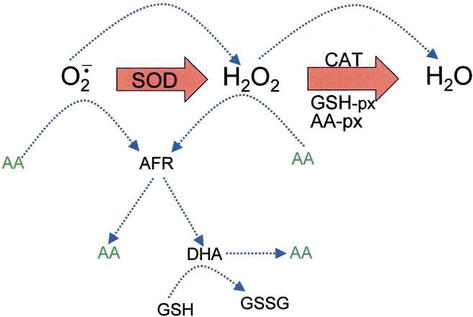
Figure 4.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceThe role of AA in the detoxification of ROS. Blue dotted lines indicate nonenzymatic reactions.
H2O2 can react with superoxide anion formed in oxidative metabolism generating the highly reactive hydroxyl radical. GSH peroxidases (GSH-px) and AA peroxidases (AA-px) are capable of scavenging H2O2 due to their high affinity for H2O2. The cooperativity of SOD, CAT, and peroxidases ensures low amounts of superoxide anion and H2O2 and limiting the risk of hydroxyl radical formation (Figure 5).

Figure 5.
xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceFoyer-Halliwell-Asada cycle .