VoLumen
Nom générique: sulfate de baryum
Forme posologique: suspension buvable
Revue médicale par Drugs.com . Dernière mise à jour le 1 octobre 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Grossesse
- Plus
Avertissement: Ce médicament n’a pas été jugé sûr et efficace par la FDA, et cet étiquetage n’a pas été approuvé par la FDA. Pour plus d’informations sur les médicaments non approuvés, cliquez ici.
- VoLumenDescription
- PHARMACOLOGIE CLINIQUE
- INDICATIONS ET UTILISATION
- Contre-indications
- Mises en garde
- Précautions
- Généralités
- Information pour les patientes
- Interactions médicamenteuses
- Utilisation pendant la grossesse
- Les mères allaitantes
- EFFETS INDÉSIRABLES
- RÉACTIONS ALLERGIQUES
- Surdosage
- DOSAGE ET ADMINISTRATION
- Pour administration orale: Marquage des voies gastro-intestinales
- Stockage
- Comment est fourni le VoLumen
- More about Volumen (barium sulfate)
- Ressources pour les consommateurs
- Ressources professionnelles
- Guides de traitement connexes
VoLumenDescription
VoLumen® est une suspension de sulfate de baryum 0,1% p/v, 0,1% p/p pour administration orale. Chaque 100 mL contient 0,1 g de sulfate de baryum. Le sulfate de baryum, en raison de sa densité moléculaire élevée, est opaque aux rayons X et agit donc comme un agent de contraste positif pour les études radiographiques. L’ingrédient actif est le sulfate de baryum et sa formule structurelle est BaSO4. Le sulfate de baryum se présente sous la forme d’une poudre fine, blanche, inodore, insipide et volumineuse, exempte de gravillons. Ses suspensions aqueuses sont neutres à tournesol. Il est pratiquement insoluble dans l’eau, les solutions d’acides et d’alcalins et les solvants organiques.
Ingrédients inactifs: acide citrique, gomme naturelle, acide benzoïque, citrate de sodium, arôme naturel et artificiel de myrtille, sorbate de potassium, eau purifiée, saccharine sodique, émulsion de siméthicone, benzoate de sodium et sorbitol.
PHARMACOLOGIE CLINIQUE
Le sulfate de baryum, en raison de sa densité moléculaire élevée, est opaque aux rayons X et agit donc comme un agent de contraste positif pour les études radiographiques. Le sulfate de baryum est biologiquement inerte et, par conséquent, n’est ni absorbé ni métabolisé par l’organisme et est éliminé du tractus gastro-intestinal sous forme inchangée.
INDICATIONS ET UTILISATION
Pour une utilisation en tomodensitométrie pour opacifier le tractus gastro-intestinal.
Contre-indications
Ce produit ne doit pas être utilisé chez les patients présentant une perforation gastro-intestinale connue ou suspectée ou une hypersensibilité au sulfate de baryum ou à tout composant de cette formulation de sulfate de baryum.
Mises en garde
Des réactions allergiques sévères de nature anaphylactoïde ont rarement été rapportées après administration d’agents de contraste au sulfate de baryum. Du personnel et des installations dûment formés doivent être disponibles pour le traitement d’urgence des réactions graves et doivent rester disponibles pendant au moins 30 à 60 minutes après l’administration, car des réactions retardées peuvent survenir.
Précautions
Généralités
Les procédures de diagnostic impliquant l’utilisation d’agents de contraste radio-opaques doivent être effectuées sous la direction d’un personnel ayant la formation requise et une connaissance approfondie de la procédure particulière à effectuer. Des antécédents d’asthme bronchique, d’atopie, comme en témoignent le rhume des foins et l’eczéma, ou une réaction antérieure à un agent de contraste, méritent une attention particulière. Des précautions doivent être prises lors de l’utilisation de milieux radio-opaques chez les patients gravement affaiblis et chez ceux présentant une hypertension marquée ou une maladie cardiaque avancée. L’ingestion de baryum n’est pas recommandée chez les patients ayant des antécédents d’aspiration alimentaire. Si des études sur le baryum sont nécessaires chez ces patients ou chez des patients chez lesquels l’intégrité du mécanisme de déglutition est inconnue, procéder avec prudence. Si le baryum est aspiré dans le larynx, l’administration ultérieure doit être immédiatement interrompue.
Information pour les patientes
Avant l’administration de ce produit, les patientes recevant des agents diagnostiques au sulfate de baryum doivent être informées de :
- Informer leur médecin si elles sont enceintes.
- Informer leur médecin s’ils sont allergiques à un médicament ou à un aliment, ou s’ils ont déjà eu des réactions aux produits à base de sulfate de baryum ou à d’autres agents de contraste utilisés dans les procédures radiologiques (voir PRÉCAUTIONS – Généralités).
- Informer leur médecin de tout autre médicament qu’ils prennent actuellement.
- Consulter immédiatement un médecin en cas de réaction allergique après l’utilisation de ce produit.
Interactions médicamenteuses
La présence de formulations de sulfate de baryum dans le tractus gastro-intestinal peut modifier l’absorption des agents thérapeutiques pris en même temps. Afin de minimiser tout changement potentiel d’absorption, l’administration séparée de sulfate de baryum de celle d’autres agents doit être envisagée.
Utilisation pendant la grossesse
Les radiations sont connues pour causer des dommages au fœtus à naître exposé in utero. Par conséquent, les procédures radiographiques ne doivent être utilisées que lorsque, de l’avis du médecin, son utilisation est jugée essentielle au bien-être de la patiente enceinte.
Les mères allaitantes
Des produits à base de sulfate de baryum peuvent être utilisés pendant l’allaitement.
EFFETS INDÉSIRABLES
Les effets indésirables, tels que nausées, vomissements, diarrhée et crampes abdominales, accompagnant l’utilisation de formulations de sulfate de baryum sont peu fréquents et généralement bénins. Des réactions sévères (environ 1 sur 1 000 000) et des décès (environ 1 sur 10 000 000) se sont produits. Les complications procédurales sont rares, mais peuvent inclure une pneumopathie par aspiration, la formation d’un granulome, une intravasation, une embolisation et une péritonite suite à une perforation intestinale, des épisodes vasovagaux et syncopaux et des décès.
RÉACTIONS ALLERGIQUES
En raison de la probabilité accrue de réactions allergiques chez les patients atopiques, il est important d’obtenir des antécédents complets d’allergies connues et suspectées ainsi que des symptômes de type allergique, par exemple rhinite, asthme bronchique, eczéma et urticaire, avant toute intervention médicale utilisant ces produits. Une réaction allergique légère comprendrait très probablement un prurit, un érythème ou une urticaire généralisés (environ 1 sur 250 000). De telles réactions répondront généralement à un antihistaminique tel que 50 mg de diphenhydramine ou son équivalent. Dans les réactions plus rares et plus graves (environ 1 sur 1 000 000), un œdème laryngé, un bronchospasme ou une hypotension pourraient se développer. Les réactions sévères pouvant nécessiter des mesures d’urgence sont souvent caractérisées par une vasodilatation périphérique, une hypotension, une tachycardie réflexe, une dyspnée, une agitation, une confusion et une cyanose, évoluant vers l’inconscience. Le traitement doit être initié immédiatement avec 0,3 à 0,5 cc d’épinéphrine 1: 1000 par voie sous-cutanée. Si le bronchospasme prédomine, 0,25 à 0,50 gramme d’aminophylline intraveineuse doit être administré lentement. Des vasopresseurs appropriés peuvent être nécessaires. Les corticostéroïdes, même administrés par voie intraveineuse, n’exercent aucun effet significatif sur les réactions allergiques aiguës pendant quelques heures. L’administration de ces agents ne doit pas être considérée comme une mesure d’urgence pour le traitement des réactions allergiques. Les patients craintifs peuvent développer une faiblesse, une pâleur, des acouphènes, une diaphorèse et une bradycardie après l’administration de tout agent diagnostique. De telles réactions sont généralement de nature non allergique et sont mieux traitées en faisant reposer le patient à plat pendant 10 à 30 minutes supplémentaires sous observation.
Surdosage
En de rares occasions après une administration répétée, des crampes d’estomac sévères, des nausées, des vomissements, de la diarrhée ou de la constipation peuvent survenir. Ces réponses indiquées peuvent être présentes dans les procédures fluoroscopiques et CT. Ceux-ci sont de nature transitoire et ne sont pas considérés comme graves. Les symptômes peuvent être traités selon les normes de soins médicaux actuellement acceptées.
DOSAGE ET ADMINISTRATION
Le volume de la suspension de sulfate de baryum CT à administrer dépendra du degré et de l’étendue du contraste requis dans la ou les zones examinées et de la technique utilisée.
Pour administration orale: Marquage des voies gastro-intestinales
Le patient doit commencer à boire VoLumen® environ 20 à 30 minutes avant l’intervention prévue. Il est recommandé au patient de consommer plusieurs flacons, d’environ 900 mL à 1 350 mL de volume total avant l’examen ou d’utiliser selon les directives du médecin. Pour améliorer le marquage gastrique, demandez au patient de consommer les 200 ml finaux immédiatement avant le scan. Le marquage intestinal est cohérent en raison de l’uniformité de la concentration de 0,1% de BaSO4. Le marquage de la lumière intestinale peut être amélioré en augmentant le volume de VoLumen® consommé (voir ci-dessous). D’autres schémas posologiques peuvent être suivis le cas échéant. Chez les patients où le marquage est problématique, comme l’obésité et le transit retardé, un marquage amélioré peut être possible en augmentant le volume total de VoLumen® administré jusqu’à 1 800 mL ou quatre (4) flacons.
Stockage
Température ambiante contrôlée par USP, de 20 à 25 °C (68 à 77 °F). Protéger du gel.
Comment est fourni le VoLumen
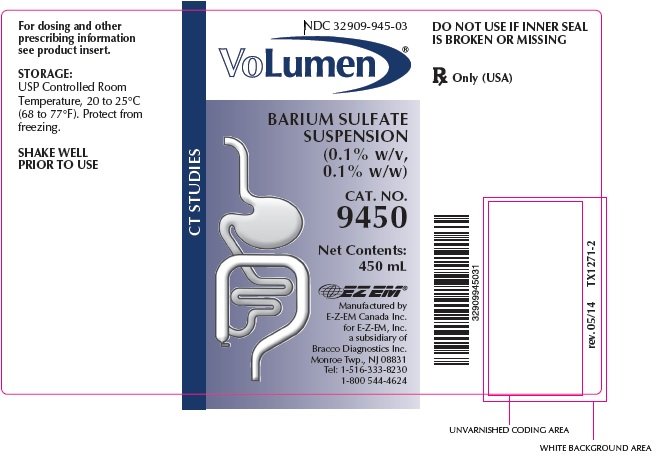
VoLumen® est fourni dans la quantité suivante: Flacons de 450 mL,
Cat. No 9450, NDC 32909-945-03
Rx Seulement (États-Unis)
BIEN AGITER AVANT UTILISATION
Brevet en instance
Fabriqué par
E-Z-EM Canada Inc.
pour E-Z-EM, Inc.
une filiale de Bracco Diagnostics Inc.
Monroe Township, NJ 08831
Tél: 1-516-333-8230 1-800 544-4624
rév.05/14 TX1272-3 © 2006 E-Z-EM, Inc.
Suspension VoLumen-Sulfate de baryum
NDC: 32909-945-03
| VoLumen barium sulfate suspension |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Labeler – E-Z-EM Canada Inc (204211163)
Inscrit – E-Z-EM, INC. (002041226)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| E-Z-EM Canada Inc | 204211163 | PACK(32909-945), ANALYSIS(32909-945), LABEL(32909-945), MANUFACTURE(32909-945) | |
More about Volumen (barium sulfate)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Pricing & Coupons
- En Español
- 1 Examen
- Classe de médicament: Produit de contraste non iodé
Ressources pour les consommateurs
- Lecture avancée
Ressources professionnelles
- Informations sur la prescription
Autres marques NeuLumEX, Liquid E-Z Paque, HD 200 Plus, Entrobar,… + 30 autres
Guides de traitement connexes
- Tomodensitométrie
Avertissement médical