Refissa
általános név: tretinoin
adagolási forma: krém
orvosilag felülvizsgálta Drugs.com. Utoljára 1.Április 2020-én frissült.
- áttekintés
- mellékhatások
- adagolás
- szakmai
- kölcsönhatások
- több
csak az arcon történő helyi alkalmazásra.
- Refissa leírás
- Refissa – Clinical Pharmacology
- A Refissa indikációi és alkalmazása
- klinikai vizsgálati adatok
- ellenjavallatok
- figyelmeztetések
- óvintézkedések
- Általános
- betegekre vonatkozó információk
- Gyógyszerkölcsönhatások
- karcinogenezis, mutagenezis, fertilitás romlása
- terhesség
- C terhességi kategória
- szoptató anyák
- gyermekgyógyászati alkalmazás
- geriátriai alkalmazás
- mellékhatások
- túladagolás
- Refissa Adagolás és alkalmazás
- hogyan szállítjuk a Refissa-t
- Tárolás
- fő kijelző PANEL – 40 g tubus karton
- További információ a Refissa (tretinoin helyi)
- fogyasztói források
- szakmai források
- kapcsolódó kezelési útmutatók
Refissa leírás
Refissa , a tretinoin (retinoid) hatóanyagot egy lágyító krémalapban tartalmazza. A Tretinoin egy sárga-narancssárga kristályos por, amelynek jellegzetes virágszaga van. A Tretinoin dimetil-szulfoxidban oldódik, kis mértékben oldódik polietilénglikol 400-ban, oktanolban és 100% etanolban. Vízben és ásványolajban gyakorlatilag nem oldódik, glicerinben pedig nem oldódik. A tretinoin kémiai neve (all-e)-3,7-dimetil-9-(2,6,6-trimetil-1-ciklonexén-1-Il)-2,4,6,8-nonatetraénsav. A tretinoint all-transz-retinsavnak is nevezik, molekulatömege 300,44. A szerkezeti képletet az alábbiakban mutatjuk be.
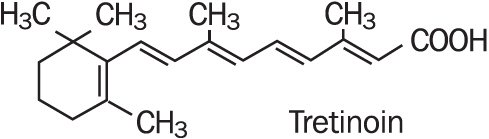
a Refissa 0 koncentrációban tartalmaz tretinoint.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Clinical Pharmacology
a tretinoin pontos hatásmechanizmusa nem ismert, bár úgy gondolják, hogy a retinoidok hatással vannak a különböző hámsejtek növekedésére és differenciálódására. Helyileg alkalmazva azonban nem volt megfigyelhető a dezmozin, a hidroxiprolin vagy az elasztin mRNS növekedése az emberi bőrben. Ezenkívül még nem határozták meg teljes mértékben a termék irritatív jellegének szerepét a terméknek a javallata szempontjából tulajdonított pozitív hatások végrehajtásában.
a tretinoin transzdermális felszívódása a különböző helyi készítményekből az alkalmazott dózis 1% – tól 31% – ig terjedt, attól függően, hogy egészséges bőrre vagy dermatitikus bőrre alkalmazták-e. Amikor a Tretinoin krém perkután felszívódását, az USP (bőrpuhító) 0,05% – ot egészséges férfiakban (n=14) értékelték egyszeri alkalmazás után, valamint 28 napon át tartó ismételt napi alkalmazás után, a tretinoin felszívódása kevesebb volt, mint 2%, és a tretinoin endogén koncentrációja és fő metabolitjai változatlanok voltak.
A Refissa indikációi és alkalmazása
(a termék indikációinak teljes megértéséhez kérjük, olvassa el a címkézés teljes javallatok és használat szakaszát.)
a Refissa adjuváns szerként (lásd az alábbi második felsoroláspontot) javallott az arcbőr finom ráncainak, foltos hiperpigmentációjának és tapintható érdességének enyhítésére (palliációjára) azoknál a betegeknél, akik átfogó bőrápoló és napelkerülő programokkal nem érik el ezt a palliációt (lásd a 3.felsorolást azokra a populációkra vonatkozóan, amelyekben a hatékonyságot nem igazolták). A Refissa nem szünteti meg a ráncokat, nem javítja a NAPKÁROSODOTT bőrt, nem fordítja vissza a fotózást, vagy nem állítja helyre a fiatalos vagy fiatalabb BŐRSZÖVETTANI mintát. Sok beteg elérni kívánt palliatív hatása finom ráncosodás, foltos hiperpigmentáció, és tapintható érdessége arcbőr használatával átfogó bőrápolási és nap elkerülésére programok, beleértve a napvédő, védőruházat, és lágyító krémek nem tartalmazó tretinoin.
- Tretinoin krém, USP (bőrpuhító) 0.05% nem mutatott enyhítő hatást a krónikus napsugárzás jelentős jeleire, például durva vagy mély ráncosodás, bőr sárgulása, lentiginek, telangiectasia, bőr lazaság, keratinocytás atypia, melanocytás atypia vagy dermális elasztózis.
- a Refissa-t orvosi felügyelet mellett kell alkalmazni egy átfogó bőrápolási és napelkerülési program kiegészítéseként, amely magában foglalja a hatékony napvédők (minimum SPF 15) és védőruházat használatát, ha a finom ráncokra, foltos hiperpigmentációra és az arcbőr érdességére vonatkozó kívánt eredményeket nem sikerült elérni egy átfogó bőrápolási és napelkerülési programmal.
- a Refissa hatékonyságát az arcbőr finom ráncainak, foltos hiperpigmentációjának és tapintható érdességének enyhítésében nem igazolták 50 évesnél idősebb vagy közepesen vagy erősen pigmentált bőrű embereknél. Ezenkívül a látható aktinikus keratosisban szenvedő betegeket és a kórtörténetben szereplő bőrrákos betegeket kizárták a Tretinoin krém 0,05% – os USP (bőrpuhító) klinikai vizsgálataiból. Ezért a Refissa hatásossága és biztonságossága ezekben a populációkban jelenleg nem ismert.
- sem a Refissa biztonságosságát, sem hatékonyságát az aktinikus keratózisok vagy bőrdaganatok megelőzésében vagy kezelésében nem igazolták.
- sem a Refissa 48 hétnél hosszabb napi alkalmazásának biztonságosságát, sem hatásosságát nem igazolták, és a 48 hétnél hosszabb napi alkalmazást sem szisztematikusan, sem szövettanilag nem vizsgálták megfelelő és jól kontrollált vizsgálatokban. (Lásd a figyelmeztetések részt.)
klinikai vizsgálati adatok
két megfelelő és jól kontrollált vizsgálatot végeztek, amelyekben összesen 161 értékelhető beteget (50 év alatti) kezeltek Tretinoin krémmel, USP (bőrpuhító) 0,05% és 154 értékelhető beteget kezeltek a vivőanyag bőrpuhító krémmel az arcon 24 héten keresztül egy átfogó bőrápolási és napelkerülési program kiegészítéseként, a finom ráncosodásra, foltos hiperpigmentációra gyakorolt hatások felmérésére, tapintható bőr érdesség. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | 2 egység vagy annál nagyobb csökkenés |
ezekben a vizsgálatokban a finom ráncokat, a foltos hiperpigmentációt és az arcbőr tapintható érdességét úgy gondolták, hogy több tényező, amely magában foglalta a belső öregedést vagy a környezeti tényezőket, például a krónikus napsugárzást.
Ezen értékelések eredményei a következők:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| jármű + CSP | 67% | 23% | 10% |
ezeknek a tüneteknek a javulását a kezelés első 24 hetében figyelték meg. Ezt követően a terápia elsősorban az első 24 hét során elért javulást tartotta fenn.
a betegek többsége elveszíti a Refissa enyhítő hatását a finom ráncokra, a foltos hiperpigmentációra és az arcbőr tapintható érdességére egy átfogó bőrápolási és napelkerülési program abbahagyásával, beleértve a Refissa-t is; azonban a Refissa napi alkalmazásának biztonságossága és hatékonysága 48 hétnél hosszabb ideig nem igazolták.
ellenjavallatok
Ez a gyógyszer ellenjavallt olyan személyeknél, akiknek kórtörténetében érzékenységi reakciók vannak bármely összetevőjére. A kezelést abba kell hagyni, ha bármely összetevőjével szembeni túlérzékenységet észlelnek.
figyelmeztetések
- a Refissa Bőrirritáló hatású, és krónikus, hosszú távú alkalmazás esetén a bőrirritáció 48 hétnél hosszabb ideig tartó folytatódásának eredményei nem ismertek. Bizonyíték van a melanocyták és a keratinocyták atipikus változásaira, valamint a megnövekedett dermális elasztózisra néhány Tretinoin krémmel kezelt betegnél, USP (bőrpuhító) 0,05% 48 hétnél hosszabb ideig. Ezen eredmények jelentősége nem ismert.
- a Refissa biztonságosságát és hatásosságát közepesen vagy erősen pigmentált bőr esetén nem igazolták.
- a Refissa nem adható be, ha a beteg olyan gyógyszereket is szed, amelyekről ismert, hogy fényérzékenyítők (pl. tiazidok, tetraciklinek, fluorokinolonok, fenotiazinok, szulfonamidok) a fokozott fototoxicitás lehetősége miatt.
a fokozott égési érzékenység miatt a Refissa alkalmazása során kerülni kell vagy minimalizálni kell a napfénynek (beleértve a napfényt is) való kitettséget. A betegeket figyelmeztetni kell, hogy a Refissa alkalmazásakor használjanak fényvédőt (minimum SPF 15) és védőruházatot. A napégésben szenvedő betegeknek azt kell tanácsolni, hogy ne alkalmazzák a Refissa-t, amíg teljesen fel nem gyógyulnak. Azoknak a betegeknek, akik-pl. foglalkozásuk miatt-jelentős napsugárzásnak lehetnek kitéve, valamint azoknak a betegeknek, akik eredendően érzékenyek a napfényre, különös óvatossággal kell eljárniuk a Refissa alkalmazása során, és gondoskodniuk kell arról, hogy betartsák a betegtájékoztatóban leírt óvintézkedéseket.
Tretinoin krém, USP (bőrpuhító) 0,05% kell tartani a szem, száj, szögek az orr, és a nyálkahártyák. A helyi alkalmazás súlyos helyi erythemát, viszketést, égést, szúrást és hámlást okozhat az alkalmazás helyén. Ha a helyi irritáció mértéke indokolja, a betegeket arra kell irányítani, hogy kevesebb gyógyszert szedjenek, csökkentsék az alkalmazás gyakoriságát, ideiglenesen hagyják abba a felhasználást, vagy teljesen hagyják abba a felhasználást.
a Tretinoinról beszámoltak arról, hogy súlyos irritációt okoz az ekcémás bőrön, ezért ebben az állapotban csak óvatosan szabad alkalmazni.
az ajánlottnál nagyobb mennyiségű gyógyszer alkalmazása nem eredményez gyorsabb vagy jobb eredményeket, és jelentős bőrpír, hámlás vagy kellemetlen érzés léphet fel.
óvintézkedések
Általános
a Refissa csak egy átfogó bőrápolási és napvédő program kiegészítéseként alkalmazható. (Lásd a használati és használati útmutatót.)
ha gyógyszerérzékenység, kémiai irritáció vagy szisztémás mellékhatás alakul ki, a Refissa alkalmazását abba kell hagyni.
az időjárási szélsőségek, mint például a szél vagy a hideg, irritálóbbak lehetnek a Refissa-t használó betegeknél.
betegekre vonatkozó információk
lásd a beteg Betegtájékoztatóját.
Gyógyszerkölcsönhatások
a refissa-val kezelt betegeknél óvatosan kell alkalmazni az egyidejűleg alkalmazott helyi gyógyszereket, gyógyszeres vagy súrolószappanokat, samponokat, tisztítószereket, erős szárító hatású kozmetikumokat, magas koncentrációjú alkoholt, összehúzó szereket, fűszereket vagy mésztartalmú termékeket, állandó hullámoldatokat, elektrolízist, szőrtelenítő szereket vagy viaszokat, valamint a bőrirritációt okozó termékeket, mivel ezek fokozhatják a refissa irritációját.
a Refissa-t nem szabad alkalmazni, ha a beteg olyan gyógyszereket is szed, amelyekről ismert, hogy fényérzékenységet okoznak (pl., tiazidok, tetraciklinek, fluorokinolonok, fenotiazinok, szulfonamidok) a fokozott fototoxicitás lehetősége miatt.
karcinogenezis, mutagenezis, fertilitás romlása
egy életen át tartó dermális vizsgálatban CD-1 egereken az átlagos ajánlott humán lokális klinikai dózis 100-szorosánál és 200-szorosánál néhány bőrdaganatot figyeltek meg nőstény egerekben és májdaganatokat hím egerekben. Ezeknek az eredményeknek a biológiai jelentősége nem egyértelmű, mivel olyan dózisokban fordultak elő, amelyek meghaladták a tretinoin dermális maximálisan tolerálható dózisát (MTD), és mivel a háttérben voltak természetes előfordulási arány ezen daganatok esetében ebben az egér törzsben. Nem volt bizonyíték a karcinogén potenciálra, ha a tretinoint helyileg adták be az átlagos ajánlott humán lokális klinikai dózis 5-szörösének. Az állatok humán expozíciójának összehasonlítása céljából az “ajánlott humán lokális klinikai dózis” meghatározása: 500 mg Refissa naponta alkalmazva egy 50 kg-os személyre.
a Tsubura és Yamamoto által egerekben végzett krónikus, kétéves A-vitamin-biológiai vizsgálat során az A-vitaminnal kezelt bőr bazális rétegében minden csoportban általános amiloid lerakódást jelentettek. CD-1 egerekben egy hasonló vizsgálat a kezelt bőrterületek hialinizációjáról számolt be, és ennek előfordulási gyakorisága hím egerekben 0/50, 3/50 és 2/50 volt, a vivőanyag-kontrollból származó nőstény egerekben pedig 1/50, 0/50, 4/50 és 2/50 volt, 0,25 mg/kg, 0,5 mg/kg és 1 mg/kg csoportokban.
szőrtelen albínó egereken végzett vizsgálatok arra utalnak, hogy a tretinoin fokozhatja a napszimulátorból származó UVB és UVA fény karcinogén dózisainak tumorképző potenciálját. Más vizsgálatokban, amikor a tretinoinnal kezelt, enyhén pigmentált, szőrtelen egereket rákkeltő UVB-sugárzásnak tették ki, a bőrdaganatok előfordulási gyakorisága és fejlődési üteme vagy csökkent, vagy semmilyen hatást nem észleltek. A jelentősen eltérő kísérleti körülmények miatt ezen eltérő adatok szigorú összehasonlítása jelenleg nem lehetséges. Bár ezeknek a vizsgálatoknak a jelentősége emberben nem egyértelmű, a betegeknek minimálisra kell csökkenteniük a napsugárzást.
a tretinoin mutagén potenciálját az Ames vizsgálatban és az in vivo egér micronucleus vizsgálatban értékelték, mindkettő negatív volt.
dermális szegmens I. és III vizsgálatok Tretinoin krém, USP (bőrpuhító) 0,05% nem végeztek egyetlen faj. Patkányokon tretinoinnal végzett orális I. és III. szegmenses vizsgálatokban az újszülöttek túlélésének csökkenését és növekedési retardációt figyeltek meg a napi 2 mg/kg-ot meghaladó dózisok mellett (>az átlagos humán lokális klinikai dózis 400-szorosa).
terhesség
teratogén hatások
C terhességi kategória
az orális tretinoin teratogénnek bizonyult patkányokban, egerekben, nyulakban, hörcsögökben és főemlősökben. Patkányokban teratogén és fetotoxikus volt, ha orálisan vagy helyileg adagolták az átlagos ajánlott humán lokális klinikai dózis 1000-szeresét. A teratogén dózisok eltéréseit azonban a patkányok különböző törzsei között jelentették. A cynomolgus majomban, amely metabolikusan közelebb áll az emberhez a tretinoin szempontjából, mint a többi vizsgált faj, magzati rendellenességeket jelentettek 10 mg/kg/nap vagy annál nagyobb dózisok mellett, de 5 mg/kg/nap dózisnál (az átlagos ajánlott humán lokális klinikai dózis 1000-szerese) egyiket sem figyelték meg, bár minden adagnál fokozott csontrendszeri eltéréseket figyeltek meg. Az embrioletalitás és az abortusz dózisfüggő növekedését jelentették. Hasonló eredményekről számoltak be a pigtail makákókban is.
a helyi tretinoin állati teratogenitási tesztekben kétértelmű eredményeket hozott. Bizonyíték van a lokális tretinoin teratogenitására (rövidített vagy eltört farok) Wistar patkányokban 1 mg/kg/nap-nál nagyobb dózisok (az ajánlott humán lokális klinikai dózis 200-szorosa) esetén. Anomáliákról (humerus: rövid 13%, hajlított 6%, os parietalis nem teljesen elcsontosodott 14%) szintén beszámoltak, amikor 10 mg/kg/nap dermálisan alkalmazták.
egyéb jelentések is vannak Új-zélandi fehér nyulakról, akiket az ajánlott humán lokális klinikai dózis körülbelül 80-szorosának megfelelő adagokkal adtak be, a kupolás fej és a hidrocefália gyakoribb előfordulásával, ami jellemző a retinoid által kiváltott magzati malformációkra ebben a fajban.
ezzel szemben számos jól kontrollált állatkísérlet kimutatta, hogy a bőrön alkalmazott tretinoin nem volt teratogén, az ajánlott humán lokális klinikai dózis 100-szorosának, illetve 200-szorosának dózisában patkányokban és nyulakban.
bármely gyógyszer széles körű alkalmazása esetén a gyógyszer beadásával ideiglenesen összefüggő kis számú születési rendellenesség csak véletlenül várható. Harminc esetben időben összefüggő veleszületett fejlődési rendellenességekről számoltak be a lokális tretinoin (Retin-A) másik gyógyszerformájának két évtizedes klinikai alkalmazása során. Bár ezekből az esetekből nem állapítottak meg egyértelmű teratogenitási mintát és alkalmi összefüggést, a jelentések közül 5 a ritka születési defektus kategóriájú holoprosencephaliát (az előagy hiányos középvonali fejlődésével járó defektusokat) írja le. Ezeknek a spontán jelentéseknek a jelentősége a magzatra gyakorolt kockázat szempontjából nem ismert.
nem teratogén hatások
a dermális tretinoin nyulakban fetotoxikusnak bizonyult, ha az ajánlott lokális humán klinikai adag 100-szorosát adják be. Az orális tretinoin patkányokban fetotoxikusnak bizonyult, ha az ajánlott lokális humán klinikai dózis 500-szorosában adják be.
terhes nőkön azonban nem végeztek megfelelő és jól kontrollált vizsgálatokat. A Refissa terhesség alatt nem alkalmazható.
szoptató anyák
nem ismert, hogy ez a gyógyszer kiválasztódik-e az anyatejbe. Mivel sok gyógyszer kiválasztódik az anyatejbe, óvatosan kell eljárni, ha a Refissa-t szoptató nőnek adják be.
gyermekgyógyászati alkalmazás
biztonságosságát és hatásosságát 18 évesnél fiatalabb betegeknél nem igazolták.
geriátriai alkalmazás
biztonságosságát és hatékonyságát 50 évesnél idősebb egyéneknél nem igazolták.
mellékhatások
(lásd a figyelmeztetések és óvintézkedések című részt.)
kettős-vak, vivőanyag-kontrollos vizsgálatokban, amelyekben 179 olyan beteg vett részt, akik tretinoin krémet, USP (bőrpuhító) 0,05% – ot alkalmaztak az arcukra, a Tretinoin krém, USP (bőrpuhító) 0,05% alkalmazásával kapcsolatos mellékhatások elsősorban a bőrre korlátozódtak. Ezekben a vizsgálatokban a betegek 4% – ának abba kellett hagynia a Tretinoin krém, USP (bőrpuhító) 0,05% alkalmazását a mellékhatások miatt. Ezeket a megszakításokat bőrirritáció vagy ezzel összefüggő bőrmellékhatások okozták.
helyi reakciókat, például hámlást, száraz bőrt, égést, szúrást, erythemát és viszketést jelentettek szinte minden alanynál a Tretinoin krémmel végzett kezelés során, USP (bőrpuhító) 0,05%. Ezek a jelek és tünetek általában enyhék vagy közepesen súlyosak voltak, és általában a kezelés korai szakaszában jelentkeztek. A legtöbb betegnél a szárazság, a hámlás és a bőrpír a kezdeti (24 hetes) csökkenés után megismétlődött.
túladagolás
az ajánlottnál nagyobb mennyiségű gyógyszer alkalmazása nem mutatott gyorsabb vagy jobb eredményeket, és jelentős bőrpír, hámlás vagy kellemetlen érzés léphet fel. A gyógyszer szájon át történő bevétele ugyanolyan mellékhatásokhoz vezethet, mint az A-Vitamin túlzott orális bevitelével járó mellékhatások.
Refissa Adagolás és alkalmazás
- ne alkalmazza a Refissa-t, ha a beteg terhes, vagy teherbe kíván esni, vagy magas a terhesség kockázata
- ne alkalmazza a Refissa-t, ha a beteg leégett, vagy ha a betegnek ekcémája vagy más krónikus bőrbetegsége van
- ne alkalmazza a Refissa-t, ha a beteg eredendően érzékeny a napfényre
- ne alkalmazza a Refissa-t, ha a beteg olyan gyógyszereket is szed, amelyekről ismert, hogy fényérzékenyek(pl. tiazidok, tetraciklinek, fluorokinolonok, fenotiazinok, szulfonamidok) a fokozott fototoxicitás lehetősége miatt.
a betegeknek részletes utasításokra van szükségük ahhoz, hogy maximális előnyöket érjenek el, és megértsék a termék legnagyobb biztonsággal történő használatához szükséges óvintézkedéseket. Az orvosnak felül kell vizsgálnia a beteg Betegtájékoztatóját.
a Refissa-t naponta egyszer kell felvinni az arcra, mielőtt visszavonulna, csak annyit használva, hogy az egész érintett területet könnyedén lefedje. A betegeknek enyhe szappannal óvatosan meg kell mosniuk az arcukat, szárazra kell tapogatniuk a bőrt, és várniuk kell 20-30 percet a Refissa alkalmazása előtt. A betegnek borsó méretű krémet kell felvinnie, hogy az egész arcot könnyedén ellepje. A krém alkalmazása során különös óvatossággal kell eljárni, hogy elkerüljük a szemet, a füleket, az orrlyukakat és a szájat.
A Refissa alkalmazása átmeneti melegséget vagy enyhe csípést okozhat.
az arc finom ráncosodásának, foltos hiperpigmentációjának és tapintási érdességének enyhítése (palliációja) fokozatosan fordulhat elő a kezelés során. A hatások észlelése előtt legfeljebb hat hónapos kezelésre lehet szükség. A Refissa-val észlelt javulás legnagyobb része a kezelés első 24 hetében figyelhető meg. Ezt követően a terápia elsősorban az első 24 hét során elért javulást tartja fenn.
a Refissa-kezelés abbahagyásával a betegek többsége elveszíti a Refissa finom ráncokra, foltos hiperpigmentációra és az arcbőr tapintható érdességére gyakorolt enyhítő hatását; azonban a Refissa napi alkalmazásának biztonságosságát és hatékonyságát 48 hétnél hosszabb ideig nem igazolták.
az ajánlottnál nagyobb mennyiségű gyógyszer alkalmazása nem eredményezhet gyorsabb vagy jobb eredményeket, és jelentős bőrpír, hámlás vagy kellemetlen érzés léphet fel.
A Refissa-val kezelt betegek használhatnak kozmetikumokat, de a kezelendő területeket alaposan meg kell tisztítani a gyógyszer alkalmazása előtt. (Lásd az óvintézkedések részt.)
hogyan szállítjuk a Refissa-t
a Refissa elérhető:
20 g-os csövek NDC 42851-012-20
40 g-os csövek NDC 42851-012-40
Tárolás
20-25 C (68-77 F). NEM FAGYASZTHATÓ.
csak Rx.
nyomtatott USA
140904-0118
által gyártott Dpt Laboratories, San Antonio, TX 78215
által forgalmazott ZO Skin Health, Inc., Irvine, CA 92618
Refissa adapterek
csak az arcon történő helyi alkalmazásra
mi a legfontosabb információ a Refissa-ról ?
A Refissa súlyos gyógyszer. Nem szünteti meg a ráncokat vagy javítja a nap által sérült bőrt. Segíthet a finom ráncok, a foltos elszíneződés és a durva érzés kezelésében, de nem” gyógyítja ” ezeket a feltételeket. A Refissa-t csak az egészségügyi szolgáltató felügyelete mellett szabad alkalmazni egy széles körű bőrápolási program részeként. Ennek a programnak magában kell foglalnia a közvetlen napfény elkerülését (védőruházat és napvédő krémek használatával, legalább 15 SPF-vel), valamint más hidratáló arckrémek használatát, amelyek nem tartalmaznak tretinoint.
a Refissa-t csak lefekvéskor szabad alkalmazni. Ne használjon szárító bőrápolási termékeket. Használja a szükséges legkisebb mennyiségű Refissa-t, és ne kerüljön a szemébe, a fülébe, az orrába vagy a szájába.figyelmeztetés: Ne alkalmazza a Refissa-t, ha terhes vagy terhességet tervez. Kerülje a napfényt és minden olyan gyógyszert, amely fokozhatja a napfényre való érzékenységét (lásd alább).
a Refissa-t nem vizsgálták 50 évesnél idősebb vagy közepesen vagy sötéten pigmentált bőrű személyeknél.
milyen típusú gyógyszer a Refissa?
( mit várhatok a Refissától?)
a Refissa egy komoly gyógyszer, amely segíthet a finom ráncok kezelésében, de nem “gyógyítja” a finom ráncokat, a foltos bőr elszíneződését és a durva érzést.
tanulmányok azt mutatják, hogy 24 hét után a tretinoin krémet, az USP (bőrpuhító) 0,05% – át finom ráncok vagy foltos elszíneződés esetén használó emberek körülbelül 30% – a mérsékelt javulást mutatott, további 35% – uk minimális javulást, 35% – uk pedig nem javult. A tretinoin krémet, az USP (bőrpuhító) 0,05% – át durva bőrre használók körülbelül 16% – a mérsékelt javulást mutatott, 35% – uk minimális javulást, 49% – uk pedig nem javult. Nincs bizonyíték arra, hogy a Refissa kezeli a durva bőrt, a mély ráncokat, a sárguló bőrt vagy más bőrápolási problémákat.
A Refissa-t széles körű bőrápolási program részeként kell alkalmazni. Ennek a programnak magában kell foglalnia a közvetlen napfény elkerülését (védőruházat és napvédő krémek használatával, legalább 15 SPF-vel), valamint más hidratáló arckrémek használatát, amelyek nem tartalmaznak tretinoint. Sokan tudják elérni a kívánt hatást használja ezt a programot használata nélkül Refissa. Ne alkalmazza a Refissa-t, amíg nem próbált ki egy széles bőrkezelő programot Refissa nélkül.
a Refissa alkalmazásakor a finom ráncosodás, a foltos bőr elszíneződése és a durva bőr javulása nem azonnali, és idővel fokozatosan következik be. Általában 3-4 hónap alatt észlelhet bizonyos hatásokat. A hatások általában leginkább észrevehető körülbelül 6 hónap kis további javulás után. Ha a Refissa-t leállítják, a javulás fokozatosan csökken.
a Refissa 48 hétnél hosszabb napi alkalmazásának biztonságosságát nem igazolták.
ki ne használja a Refissa-t?
ne alkalmazza a Refissa-t, ha leégett vagy nagyon érzékeny a napra, ha ekcémája van, vagy ha a bőre irritált. A Refissa fokozott bőrirritációt és fokozott napégésre való hajlamot okozhat.
mivel a Refissa érzékenyebbé teheti a bőrt a napfényre, tájékoztassa kezelőorvosát, ha más, a napfényre érzékenységet növelő gyógyszereket is szed, mivel ezekkel a gyógyszerekkel nem szabad együtt alkalmaznia a Refissa-t. Ezek közé tartoznak többek között a következők: tiazidok (magas vérnyomás kezelésére alkalmazzák), tetraciklinek, fluorokinolonok vagy szulfonamidok (fertőzések kezelésére alkalmazzák) és fenotiazinok (súlyos érzelmi problémák kezelésére alkalmazzák). Ha bármilyen vényköteles gyógyszert, vény nélkül kapható gyógyszert vagy arckrémet szed, forduljon egészségügyi szakemberhez, hogy megbizonyosodjon arról, hogy azok nem lépnek kölcsönhatásba a Refissa-val.
terhesség figyelmeztetés: a terhesség alatti biztonságos alkalmazás nem bizonyított. Vannak jelentések születési rendellenességek laboratóriumi állatok és emberek, hogy kaptak tretinoin szájon át. Ne alkalmazza a Refissa-t, ha terhes vagy teherbe kíván esni.
nem ismert, hogy a Refissa átjut-e a csecsemőknek az anyatejjel. A gyermekek biztonságos használata nem bizonyított.
a Refissa biztonságosságát és hatásosságát 50 év felettiek vagy sötétebb bőrszínnel rendelkezők esetében nem igazolták.
hogyan kell alkalmazni a Refissa-t?
naponta egyszer alkalmazza a Refissa-t az arcára, mielőtt visszavonulna, csak annyit használva, hogy az egész érintett területet könnyedén lefedje. Óvatosan mossa meg az arcát enyhe szappannal, szárítsa meg a bőrt, és várjon 20-30 percet a Refissa alkalmazása előtt. Vigyen fel borsó méretű krémet, hogy ellepje az egész arcát. A Refissa első alkalmazásakor melegséget vagy enyhe csípést érezhet.
a krém alkalmazása során különösen óvatosnak kell lennie, hogy elkerülje a szemét, fülét, orrlyukát vagy száját. A Refissa ezeken a területeken súlyos bőrpírt, viszketést, égést, szúrást és hámlást okozhat.
a szükségesnél nagyobb mennyiségű Refissa alkalmazása nem gyorsítja az eredményeket, és túladagolást okozhat. A túladagolás vörös és hámló bőrt, valamint némi fájdalmat vagy kellemetlenséget okozhat.
a Refissa alkalmazása után használhat kozmetikumokat. Ügyeljen arra, hogy alaposan tisztítsa meg az arcát, mielőtt újra felvenné a Refissa-t.
mit kell kerülni a Refissa használata közben?
A Refissa növeli a napfényre való érzékenységet. Kerülje a napfényt, amennyire csak lehetséges. Használjon védőruházatot és legalább 15 SPF-es fényvédő krémet. Ne napozzon vagy használjon napfényt. Ha érzékeny a napfényre, vagy olyan munkája van, amely megköveteli, hogy hosszú ideig kint legyen a napon, rendkívül óvatosan kell eljárnia.
a Refissa használata közben kerülje az olyan termékeket, amelyek kiszáríthatják vagy irritálhatják a bőrt. Kerülje például a bőrre felvitt termékeket, amelyek alkoholt, fűszereket vagy mészet tartalmaznak. Kerülje a tisztítószereket, a szőrtelenítést vagy más olyan termékeket is, amelyek irritálhatják a bőrt.
mik a Refissa lehetséges mellékhatásai?
a leggyakoribb mellékhatások a bőrreakciók. Viszketést, vöröset és száraz bőrt jelentettek. Így van égő, szúró és hámló bőr. Ezek leggyakrabban enyhék, és a kezelés megkezdésekor a leggyakoribbak.
Hogyan kaphatok további információkat?
Ez a betegtájékoztató a Refissa-val kapcsolatos legfontosabb információkat foglalta össze. Ha további információt szeretne, beszéljen orvosával vagy más egészségügyi szolgáltatóval. Van egy egészségügyi szakemberek számára írt szórólap is, amelyet gyógyszerésze nyújthat Önnek.
forduljon orvosához a mellékhatásokkal kapcsolatos orvosi tanácsért. LEHET JELENTENI MELLÉKHATÁSOK FDA 1-800-FDA-1088.
fő kijelző PANEL – 40 g tubus karton
NDC 42851-012-40
117471-0118
Refissa GmbH Tretinoin krém,
USP (lágyító) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
További információ a Refissa (tretinoin helyi)
- mellékhatások
- terhesség vagy szoptatás alatt
- adagolási információk
- Gyógyszerkölcsönhatások
- árképzés & kuponok
- En Espa Kb
- gyógyszer osztály: helyi akne szerek
fogyasztói források
- beteginformációk
- refissa helyi (haladó olvasás)
szakmai források
- felírási információk
- tretinoin gél mikrogömb (FDA)
egyéb márkák Retin-A, Renova, atralin, altreno, … +2 további
kapcsolódó kezelési útmutatók
- a bőr fotózása
orvosi nyilatkozat