VoLumen
általános név: bárium-szulfát
adagolási forma: belsőleges szuszpenzió
orvosilag felülvizsgálta Drugs.com. Utoljára 1.Október 2020-én frissült.
- áttekintés
- mellékhatások
- adagolás
- szakmai
- terhesség
- több
jogi nyilatkozat: Ezt a gyógyszert az FDA nem találta biztonságosnak és hatékonynak, és ezt a címkézést az FDA nem hagyta jóvá. További információ a nem jóváhagyott gyógyszerekről, kattints ide.
- VoLumen leírás
- klinikai farmakológia
- javallatok és használat
- ellenjavallatok
- figyelmeztetések
- óvintézkedések
- Általános
- információk a betegek számára
- Gyógyszerkölcsönhatások
- terhesség alatti alkalmazás
- szoptató anyák
- mellékhatások
- allergiás reakciók
- túladagolás
- adagolás és alkalmazás
- szájon át történő alkalmazás esetén: GI traktus jelölés
- Tárolás
- hogyan szállítjuk a volument
- More about Volumen (barium sulfate)
- fogyasztói források
- szakmai források
- kapcsolódó kezelési útmutatók
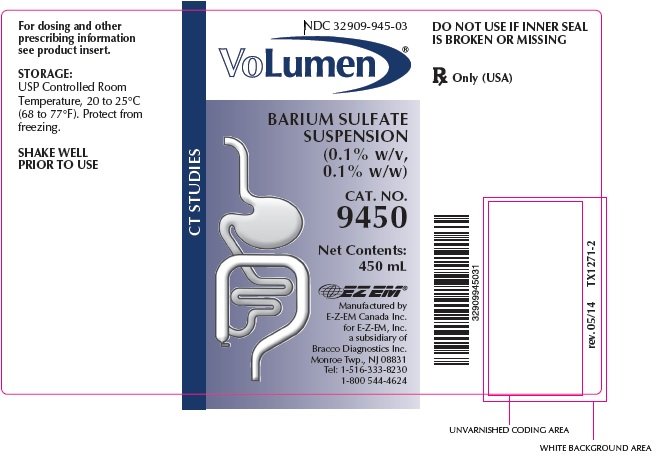
VoLumen leírás
a volumen egy 0,1 tömegszázalékos bárium-szulfát szuszpenzió, 0,1 tömegszázalék orális beadásra. Minden 100 mL 0,1 g bárium-szulfátot tartalmaz. A bárium-szulfát nagy molekulasűrűsége miatt átlátszatlan a röntgensugarakkal szemben, ezért pozitív kontrasztanyagként működik a radiográfiai vizsgálatokban. A hatóanyag bárium-szulfát, szerkezeti képlete BaSO4. A bárium-szulfát finom, fehér, szagtalan, íztelen, terjedelmes porként fordul elő, amely mentes a szemcsésségtől. Vizes szuszpenziói semlegesek a lakmusszal szemben. Gyakorlatilag nem oldódik vízben, savak és lúgok oldataiban, valamint szerves oldószerekben.
Inaktív összetevők: citromsav, természetes gumi, benzoesav, nátrium-citrát, természetes és mesterséges áfonya íz, kálium-szorbát, tisztított víz, szacharin-nátrium, szimetikon emulzió, nátrium-benzoát, és szorbit.
klinikai farmakológia
a bárium-szulfát nagy molekulasűrűsége miatt átlátszatlan a röntgensugarakkal szemben, ezért pozitív kontrasztanyagként működik a radiográfiai vizsgálatokban. A bárium-szulfát biológiailag inert, ezért a szervezet nem szívódik fel vagy metabolizálódik, változatlan formában ürül ki a gyomor-bél traktusból.
javallatok és használat
számítógépes tomográfiában történő alkalmazásra a gyomor-bél traktus homályosítására.
ellenjavallatok
Ez a készítmény nem alkalmazható olyan betegeknél, akiknek ismert vagy feltételezett gastrointestinalis perforációja van, vagy túlérzékenyek a bárium-szulfáttal vagy a bárium-szulfát készítmény bármely összetevőjével szemben.
figyelmeztetések
bárium-szulfát kontrasztanyagok alkalmazását követően ritkán súlyos, anafilaktoid jellegű allergiás reakciókról számoltak be. Megfelelően képzett személyzetnek és létesítményeknek kell rendelkezésre állniuk a súlyos reakciók sürgősségi kezelésére, és a beadást követően legalább 30-60 percig rendelkezésre kell állniuk, mivel késleltetett reakciók léphetnek fel.
óvintézkedések
Általános
a radiopaque kontrasztanyagok alkalmazásával járó diagnosztikai eljárásokat a személyzet irányítása mellett, a szükséges képzettséggel és az elvégzendő eljárás alapos ismeretével kell elvégezni. Különös figyelmet érdemel a bronchiális asztma, az atópia, amit szénanátha és ekcéma bizonyít, vagy egy kontrasztanyagra adott korábbi reakció. Radiopaque táptalajok alkalmazásakor körültekintően kell eljárni súlyosan legyengült, valamint súlyos hypertoniában vagy előrehaladott szívbetegségben szenvedő betegeknél. A bárium lenyelése nem ajánlott olyan betegeknél, akiknek kórtörténetében élelmiszer-aspiráció történt. Ha bárium-vizsgálatok szükségesek ezeknél a betegeknél, vagy olyan betegeknél, akiknél a nyelési mechanizmus integritása nem ismert, óvatosan járjon el. Ha a báriumot a gégébe szívják, a további beadást azonnal abba kell hagyni.
információk a betegek számára
a készítmény alkalmazása előtt a bárium-szulfát diagnosztikai szereket kapó betegeket arra kell utasítani, hogy:
- értesítsék kezelőorvosukat, ha terhesek.
- tájékoztassa orvosát, ha allergiás bármilyen gyógyszerre vagy ételre, vagy ha korábban bármilyen reakciója volt a bárium-szulfát termékekre vagy más kontrasztanyagokra, amelyeket röntgen-eljárásokban használtak (lásd óvintézkedések-Általános).
- tájékoztassa orvosát minden más gyógyszerről, amelyet jelenleg szed.
- azonnal forduljon orvoshoz, ha allergiás reakciót tapasztal a termék használata után.
Gyógyszerkölcsönhatások
a bárium-szulfát készítmények jelenléte a gyomor-bél traktusban megváltoztathatja az egyidejűleg alkalmazott terápiás szerek felszívódását. A felszívódás esetleges változásának minimalizálása érdekében mérlegelni kell a bárium-szulfát más szerektől való elkülönítését.
terhesség alatti alkalmazás
a sugárzásról ismert, hogy károsítja a méhen belül kitett magzatot. Ezért radiológiai eljárásokat csak akkor szabad alkalmazni, ha az orvos megítélése szerint alkalmazása a terhes beteg jóléte szempontjából alapvető fontosságú.
szoptató anyák
bárium-szulfát termékek alkalmazhatók szoptatás alatt.
mellékhatások
mellékhatások, mint például hányinger, hányás, hasmenés és hasi görcsök, kísérő használata bárium-szulfát készítmények ritkán és általában enyhe. Súlyos reakciók (körülbelül 1: 1 000 000) és halálos kimenetelű reakciók (körülbelül 1: 10 000 000) fordultak elő. A procedurális szövődmények ritkák, de lehetnek aspirációs pneumonitis, granuloma képződés, intravasatio, embolizáció és peritonitis intesztinális perforációt követően, vasovagalis és syncopalis epizódok, valamint halálos kimenetelűek.
allergiás reakciók
az allergiás reakciók fokozott valószínűsége miatt az atópiás betegeknél fontos, hogy a kórelőzményben ismert és feltételezett allergiák, valamint allergiás jellegű tünetek, pl. rhinitis, bronchiális asztma, ekcéma és urticaria szerepeljenek, mielőtt ezeket a termékeket bármilyen orvosi beavatkozásra felhasználnák. Az enyhe allergiás reakció valószínűleg magában foglalja a generalizált viszketést, erythemát vagy csalánkiütést (körülbelül 1: 250 000). Az ilyen reakciók általában reagálnak egy antihisztaminra, például 50 mg difenhidraminra vagy annak ekvivalensére. A ritkább, súlyosabb reakciók (körülbelül 1: 1 000 000) gégeödéma, hörgőgörcs vagy hipotenzió alakulhat ki. A sürgősségi intézkedéseket szükségessé tevő súlyos reakciókat gyakran perifériás értágulat, hipotenzió, reflex tachycardia, dyspnoe, izgatottság, zavartság és cyanosis jellemzi, amely eszméletvesztésig terjed. A kezelést azonnal meg kell kezdeni 0,3-0,5 cc 1:1000 epinefrinnel szubkután. Ha a bronchospasmus túlsúlyban van, 0,25-0,50 gramm intravénás aminofillint kell lassan beadni. Megfelelő vazopresszorokra lehet szükség. Az adrenokortikoszteroidok, még akkor is, ha intravénásan adják be, néhány órán keresztül nem gyakorolnak jelentős hatást az akut allergiás reakciókra. Ezen szerek beadása nem tekinthető sürgősségi intézkedésnek az allergiás reakciók kezelésére. A nyugtalan betegeknél gyengeség, sápadtság, fülzúgás, verejtékezés és bradycardia alakulhat ki bármely diagnosztikai szer alkalmazását követően. Az ilyen reakciók általában nem allergiás jellegűek, és legjobban úgy kezelhetők, ha a beteget további 10-30 percig megfigyelés alatt tartják.
túladagolás
ismételt alkalmazást követően ritkán súlyos gyomorgörcs, hányinger, hányás, hasmenés vagy székrekedés léphet fel. Ezek a jelzett válaszok mind fluoroszkópos, mind CT eljárásokban jelen lehetnek. Ezek átmeneti jellegűek, és nem tekinthetők súlyosnak. A tünetek az orvosi ellátás jelenleg elfogadott normáinak megfelelően kezelhetők.
adagolás és alkalmazás
a beadandó CT bárium-szulfát szuszpenzió térfogata a vizsgált terület(ek) ben szükséges kontraszt mértékétől és mértékétől, valamint az alkalmazott technikától függ.
szájon át történő alkalmazás esetén: GI traktus jelölés
a betegnek körülbelül 20-30 perccel a tervezett eljárás előtt el kell kezdenie a VoLumen adagolását. Javasoljuk, hogy a beteg több palackot fogyasszon, körülbelül 900 mL-től 1350 mL teljes térfogatig a vizsgálat előtt, vagy az orvos utasításai szerint használja. A gyomor jobb jelölése érdekében a beteg közvetlenül a vizsgálat előtt fogyasztja el az utolsó 200 mL-t. A bél jelölése következetes a Baso 0,1% – os koncentrációjának egységessége miatt4. A bél lumen jelölése javítható az elfogyasztott térfogat mennyiségének növelésével (lásd alább). Adott esetben más adagolási sémák is követhetők. Azoknál a betegeknél, ahol a jelölés problémás, mint például az elhízás és a késleltetett tranzit, a jelölés javítása lehetséges lehet az 1800 mL-ig vagy négy (4) palackig beadott térfogat-növekedés révén.
Tárolás
USP szabályozott szobahőmérséklet, 20-25 C (68-77 F). Védje a fagyástól.
hogyan szállítjuk a volument
a volument a következő mennyiségben szállítjuk: 450 mL-es flakon, Cat. No.9450, NDC 32909-945-03
csak Rx (USA)
használat előtt alaposan fel kell rázni
szabadalmaztatás alatt
gyártó:
E-Z-EM Canada Inc.
Az E-Z-EM, Inc.
a Bracco Diagnostics Inc. leányvállalata.Monroe Township, NJ 08831 Tel: 1-516-333-8230 1-800 544-4624
Rev.05/14 TX1272-3 db 2006 E-Z-EM, Inc.
VoLumen-bárium-szulfát szuszpenzió
NDC: 32909-945-03
| VoLumen barium sulfate suspension |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
Labeler – E-Z-EM Canada Inc (204211163)
regisztráló – E-Z-EM, INC. (002041226)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| E-Z-EM Canada Inc | 204211163 | PACK(32909-945), ANALYSIS(32909-945), LABEL(32909-945), MANUFACTURE(32909-945) | |
More about Volumen (barium sulfate)
- Side Effects
- During Pregnancy or Breastfeeding
- Dosage Information
- Pricing & Kuponok
- En Espa Kb
- 1 felülvizsgálat
- kábítószer osztály: nem jódozott kontrasztanyag
fogyasztói források
- haladó olvasás
szakmai források
- felírási információk
egyéb márkák NeuLumEX, folyékony E-Z Paque, HD 200 Plus, Entrobar,… +30 további
kapcsolódó kezelési útmutatók
- számítógépes tomográfia
orvosi nyilatkozat