Ouabain
Ouabain è un glicoside cardiaco che inibisce lo scambio SODIO-potassio ATP-dipendente attraverso le membrane cellulari. Il legame di ouabain alla pompa sodio-potassio (chiamata anche Na+/K+ ATPasi) impedisce i cambiamenti conformazionali necessari per il suo corretto funzionamento. Ciò influenza la composizione ionica intracellulare in vari modi con vari effetti, a seconda della cellula e del dosaggio. Il composto è stato quindi utilizzato in medicina, sia come terapeutico che nella ricerca relativa al trasporto attivo attivo della membrana.
Proteina bersaglio: Na+/K+ ATPasi

Na+/K+ ATPasi trasporta attivamente il potassio nella cellula e il sodio nello spazio extra-cellulare secondo lo schema generale illustrato di seguito. Questa proteina transmembrana è composta da tre subunità, alfa, beta e gamma, che possono dimerizzare con altre pompe in vivo. La struttura cristallina è un esamero radialmente simmetrico, quando nei tessuti viventi, le proteine si associano molto probabilmente bilateralmente. La catena alfa è mostrata in rosa / blu e la catena beta in giallo / verde. Dei due, la subunità alfa svolge il ruolo principale nel funzionamento della proteina. Il fascio di alfa eliche al centro della proteina posiziona residui idrofobici all’esterno del motivo, aprendo un portale attraverso il doppio strato lipidico. È all’interno di questo dominio transmembrana che i residui della subunità alfa coordinano gli ioni sodio o potassio. Il grande dominio sul lato citoplasmatico del doppio strato (più lontano dalla subunità beta) galleggia in soluzione ed è responsabile del legame e dell’idrolizzazione dell’ATP. Come con molti enzimi proteici dell’idrolisi del fosfoestere, i gruppi fosfatici sono coordinati con a . L’energia rilasciata dalla scissione del fosfato ad alta energia viene trasferita tramite cambiamenti conformazionali al dominio transmembrana, dove gli ioni sono costretti contro il loro gradiente di concentrazione. Sul lato extracellulare, le mosse per prevenire la dissociazione degli ioni di potassio durante il loro ingresso nella cellula. Una terza subunità gamma (viola/arancione), insieme alla subunità beta, contribuisce all’ancoraggio dei domini transmembrana al doppio strato fosfolipidico.
Funzionamento normale Na+ / K+ ATPasi cambia unidirezionalmente tra due fasi, E1 ed E2. Nella fase E1, lega Na + e ATP all’interno della cellula. Dopo l’idrolisi, la proteina fosforelata espelle l’ADP e cambia la conformazione a E2, consentendo a 3Na + di dissociarsi sul lato extracellulare della membrana. La proteina quindi lega 2K + e idrolizza il fosfato inorganico legato, causando il ritorno a E1. Poco prima del legame di K+ allo stato E2, Ouabain si lega ai residui all’interno della pompa, impedendo la transizione verso E1 (quindi il cofattore di magnesio sta coordinando un legame enzimatico )
Struttura Ouabain e legame
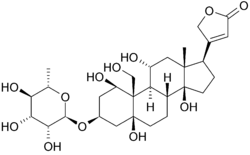
Di seguito è riportata la struttura di oubain in due dimensioni. La molecola è costituita da uno zucchero legato ad un colesterolo modificato da un legame glicosidico (quindi glicoside). I gruppi idrossilici che circondano gran parte della molecola, insieme agli esteri alle due estremità, contribuiscono al suo legame con la pompa sodio-potassio legata alla membrana. può anche essere visto in tre dimensioni. Con la geometria molecolare e la stereochimica visualizzate in questo modo, si può vedere più chiaramente la distribuzione dei legami carbonio-ossigeno polari e carbonio-carbonio non polari nello spazio che circonda la molecola. Ciò rende la visualizzazione del legame dell’inibitore molto più facile. Ouabain è alla proteina lungo l’interno di un fascio dell’alfa-elica. i componenti dei residui aiutano un po ‘ a coordinare ouabain attraverso le forze di Van der Waals, ma residui, glutammina, acido aspartico e treonina, insieme al legame ammidico di un’alanina, circondano i gruppi idrossile e carbonilico del ligando, formando legami idrogeno di 2 a 4 angstrom di lunghezza. Questo non solo tiene il farmaco in posizione, ma impedisce il cambiamento conformazionale necessario per la funzione della proteina.
Muscolo cardiaco e inibizione della pompa ionica
L’inibizione di Na+ / K+ ATPasi ha effetti indiretti sulla forza contrattile, o inotrofia, delle cellule del muscolo cardiaco. Attraverso l’aumento della concentrazione di sodio citoplasmatico, viene attivato uno scambiatore di sodio-calcio, aumentando così la concentrazione cellulare di calcio. Il calcio è un secondo messaggero in molte vie di segnalazione / regolamentazione. Il suo rilascio nel citoplasma delle cellule muscolari segnala la contrazione, spiegando l’effetto positivo delle basse dosi di ouabain sull’introfia cardiaca. L’immagine qui sotto mostra questo effetto di tutti i glicosidi cardiaci sul tessuto miocardico. Come mostrato, l’inibizione della pompa sodio-potassio provoca sodio citoplasmatico elevato, che attiva la pompa sodio-calcio causando in aumento del calcio citoplasmatico. Ciò aumenta la forza con cui la cella si contrae.
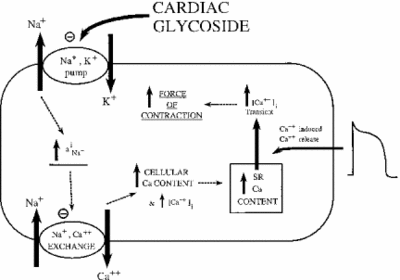
Se dosato correttamente, ouabain si dimostra efficace nel trattamento dell’insufficienza cardiaca e delle aritmie. Tuttavia, l’attività di ouabain può contribuire indirettamente al sovraccarico delle cellule miocardiche con sodio. I canali Na+ passivi sono solitamente inattivati quando il potenziale di membrana è al massimo. Quando si riaprono o non riescono a chiudersi, troppo sodio può fuoriuscire nella cellula, causando lo spreco di ATP e / o la contrazione muscolare non coordinata. Questo si chiama late I-Na. Con l’aumento di sodio e calcio, viene attivata una chinasi Ca2+-calmodulina-dipendente, a sua volta fosforilante e attivante i canali Na+ passivi. Quando gli effetti di ouabain sono amplificati in questo modo, il farmaco può causare più danni che benefici. La ricerca ha dimostrato che un modo efficace per combattere l’I-Na tardiva è l’inibizione della chinasi Ca2 + -calmodulina-dipendente (Hoyer et al. 2011).