Ouabain
Ouabain ist ein Herzglykosid, das den ATP-abhängigen Natrium-Kalium-Austausch über Zellmembranen hemmt. Die Bindung von Ouabain an die Natrium-Kalium-Pumpe (auch Na + / K + -ATPase genannt) verhindert die für die ordnungsgemäße Funktion erforderlichen Konformationsänderungen. Dies beeinflusst die intrazelluläre Ionenzusammensetzung auf verschiedene Weise mit verschiedenen Effekten, abhängig von der Zelle und der Dosierung. Die Verbindung wurde daher in der Medizin sowohl als Therapeutikum als auch in der Forschung im Zusammenhang mit dem aktiven aktiven Membrantransport verwendet.
Zielprotein: Na+/K+ ATPase

Na+/K+ ATPase transportiert aktiv Kalium in die Zelle und Natrium in den extrazellulären Raum gemäß dem unten dargestellten allgemeinen Schema. Dieses Transmembranprotein besteht aus drei Untereinheiten, Alpha, Beta und Gamma, die in vivo mit anderen Proteinen dimerisieren können. Das , Kristallstruktur ist ein radialsymmetrisches Hexamer, wenn in lebenden Geweben, Die Proteine assoziieren höchstwahrscheinlich bilateral. Die Alpha-Kette ist in rosa / blau und die Beta-Kette in gelb / grün dargestellt. Von den beiden spielt die Alpha-Untereinheit die führende Rolle bei der Funktion des Proteins. Das Bündel von Alpha-Helices in der Mitte des Proteins positioniert hydrophobe Rückstände an der Außenseite des Motivs und öffnet ein Portal durch die Lipiddoppelschicht. Innerhalb dieser Transmembrandomäne koordinieren Reste der Alpha-Untereinheit Natrium- oder Kaliumionen. Die große Domäne auf der zytoplasmatischen Seite der Doppelschicht (am weitesten von der Beta-Untereinheit entfernt) schwimmt in Lösung und ist für die Bindung und Hydrolysierung von ATP verantwortlich. Wie bei vielen Proteinenzymen der Phosphoesterhydrolyse sind die Phosphatgruppen mit a koordiniert. Die Energie, die aus der hochenergetischen Phosphatspaltung freigesetzt wird, wird über Konformationsänderungen in die Transmembrandomäne übertragen, wo Ionen gegen ihren Konzentrationsgradienten gezwungen werden. Auf der extrazellulären Seite bewegt sich, um die Dissoziation von Kaliumionen während ihres Eintritts in die Zelle zu verhindern. Eine dritte Gamma-Untereinheit (lila / orange) trägt zusammen mit der Beta-Untereinheit zur Verankerung von Transmembrandomänen an der Phospholipid-Doppelschicht bei.
Normal funktionierende Na +/K+ ATPase ändert sich unidirektional zwischen zwei Phasen, E1 und E2. In der E1-Phase bindet es Na + und ATP im Inneren der Zelle. Nach der Hydrolyse stößt das phosphorelierte Protein ADP aus und ändert die Konformation zu E2, wodurch 3Na + auf der extrazellulären Seite der Membran dissoziieren kann. Das Protein bindet dann 2K + und hydrolysiert das gebundene anorganische Phosphat, wodurch die Reversion zu E1. Kurz vor der Bindung von K + an den E2-Zustand bindet Ouabain an Rückstände in der Pumpe und verhindert so den Übergang zurück zu E1 (somit koordiniert der Magnesium-Cofaktor eine enzymatisch gebundene)
Ouabain-Struktur und Bindung
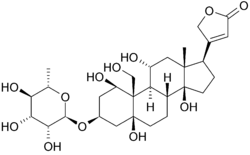
Unten ist die Struktur von Oubain in zwei Dimensionen dargestellt. Das Molekül besteht aus einem Zucker, der durch eine glykosidische Bindung (daher Glykosid) an ein modifiziertes Cholesterin gebunden ist. Die Hydroxylgruppen, die einen Großteil des Moleküls umgeben, tragen zusammen mit den Estern an beiden Enden zu seiner Bindung an die membrangebundene Natrium-Kalium-Pumpe bei. kann auch in drei Dimensionen gesehen werden. Mit der auf diese Weise angezeigten Molekülgeometrie und Stereochemie kann man die Verteilung von polaren Kohlenstoff-Sauerstoff- und unpolaren Kohlenstoff-Kohlenstoff-Bindungen in dem das Molekül umgebenden Raum deutlicher erkennen. Dies erleichtert die Visualisierung der Bindung des Inhibitors erheblich. Ouabain ist das Protein entlang der Innenseite eines Alpha-Helix-Bündels. bestandteile von Resten helfen etwas bei der Koordination von Ouabain durch Van-der-Waals-Kräfte, aber Reste, Glutamin, Asparaginsäure und Threonin umgeben zusammen mit der Amidbindung eines Alanins die Hydroxyl- und Carbonylgruppen des Liganden und bilden Wasserstoffbrückenbindungen von 2 bis 4 Angström Länge. Dies hält nicht nur das Medikament an Ort und Stelle, sondern verhindert auch Konformationsänderungen, die für die Funktion des Proteins notwendig sind.
Hemmung des Herzmuskels und der Ionenpumpe
Die Hemmung der Na+/K+ -ATPase hat indirekte Auswirkungen auf die Kontraktionskraft oder Inotrophie von Herzmuskelzellen. Durch die Erhöhung der zytoplasmatischen Natriumkonzentration wird ein Natrium-Calcium-Tauscher aktiviert, wodurch die zelluläre Calciumkonzentration erhöht wird. Calcium ist ein zweiter Botenstoff in vielen Signal- / Regulationspfaden. Seine Freisetzung in das Zytoplasma der Muskelzellen signalisiert eine Kontraktion, was die positive Wirkung niedriger Dosen von Ouabain auf die Herzdystrophie erklärt. Das Bild unten zeigt diese Wirkung aller Herzglykoside auf das Myokardgewebe. Wie gezeigt, verursacht die Hemmung der Natrium-Kalium-Pumpe ein erhöhtes zytoplasmatisches Natrium, das die Natrium-Calcium-Pumpe aktiviert, was zu einem Anstieg des zytoplasmatischen Calciums führt. Dies erhöht die Kraft, mit der sich die Zelle zusammenzieht.
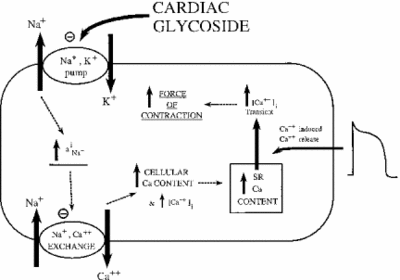
Bei richtiger Dosierung erweist sich Ouabain als wirksam bei der Behandlung von Herzinsuffizienz und Herzrhythmusstörungen. Die Ouabain-Aktivität kann jedoch indirekt zur Überlastung von Myokardzellen mit Natrium beitragen. Passive Na + -Kanäle werden normalerweise inaktiviert, wenn das Membranpotential am höchsten ist. Wenn sie sich wieder öffnen oder nicht schließen, kann zu viel Natrium in die Zelle gelangen, was zu einem verschwenderischen Verbrauch von ATP und / oder einer unkoordinierten Muskelkontraktion führt. Dies nennt man spätes I-Na. Mit dem Anstieg von Natrium und Calcium wird eine Ca2 + -Calmodulin-abhängige Kinase aktiviert, die wiederum passive Na + -Kanäle phosphoryliert und aktiviert. Wenn die Wirkung von Ouabain auf diese Weise verstärkt wird, kann das Medikament mehr Schaden als nützen. Untersuchungen haben gezeigt, dass ein wirksamer Weg zur Bekämpfung der späten I-Na die Hemmung der Ca2 + -Calmodulin-abhängigen Kinase ist (Hoyer et al. 2011).