循環器医学におけるフロンティア
はじめに
異なる生物学的実体に使用できる座標系を調べる際には、特定の特性を考慮する必要があります。 例えば、染色体数および塩基対位置は、参照ゲノム中の位置を定義するのに十分な線形座標系を形成する(1)。 しかし、HuBMAP、HCA、HPA、およびその他のマッピング作業のニーズに応えることができる人体全体の座標系は、いくつかの理由からはるかに複雑です(2-5)。 第一に、細胞は三次元に存在し、そして、データを生成するために使用される任意の組織試料のサイズおよび回転方向を記述するために追加の情報が必 第二に、ゲノム塩基対の位置は、DNAがどのように折り畳まれ、核内に充填されるかに依存しないが、個々の要素の位置(例えば、ゲノム塩基対の位置)は、DNAが 彼らは骨格や筋肉の動き、重力、呼吸、心臓の鼓動、および組織を歪める他の機能や力で変化する可能性があるように、体内の細胞、臓器)は、動的です。 第三に、人々の間のDNAの変動は<1%ですが、人体の幾何学的形状は、性別や人種によって異なり、人の寿命にわたって大きく変化する高さ、重さ、形
一つのオプションは、ボディ内の位置を記述するために3Dデカルト座標系を使用することです。 デカルト座標系には、馴染みがあり、容易に理解できるという利点があります。 身体が標準的な解剖学的位置にある場合、左右、尾頭蓋、および後部前部は3つの垂直(x-y-z)軸を形成する。 小規模な分析では、解剖学的ランドマークに起源を中心にすることが最も有用であり、異なる人々の間で潜在的に変動が少ない可能性があります。 例えば、腎臓から腎臓の上極までの組織サンプルの距離を、人の頭の頂部までの距離よりも測定する方が容易であろう。 デカルト座標の欠点は、その軸が体の自然な形状に従わないことです。 その結果、異なるサイズの人々から収集された組織標本をデジタルで”ステッチ”して参照ボディマップを作成するには、データの反り、回転、整列の複雑なプ 細胞レベルの精度を維持しながら、体全体にスケールする方法でこれを行うことは非常に困難です。
他の3D座標系は、さまざまな用途のために開発されています。 たとえば、緯度、経度、および標高を表す軸を持つ球面座標は、地球の表面上の位置を便利に記述します。 “東1km”のような球面座標の単純なパスは、デカルト座標を使用して通信するのがはるかに困難です。 同様に、人体の座標系は、理想的には、解剖学的構造、遺伝的発現パターン、化学勾配、および/または他の生物学的に関連する経路に従う軸を有するべきである。 機能的な脳イメージングのためのTalairach座標のようないくつかの臓器特異的座標系が開発されているが、これらは全身に及ぶわけではない(6)。
血管ベースの座標系
2017年には、国立衛生研究所、ブロード研究所、サンガー研究所、チャン-ザッカーバーグ-イニシアティブによって共通座標フレームワーク(CCF)会議が開催された。 世界中の解剖学者、病理学者、臨床医、技術専門家を含む会議参加者は、解剖学的に基づく座標系(7)を含む人体の細胞をマッピングするためのいくつかの 血管系を使用するこれらのうちの1つは、特に腎臓細胞を局在化するための2019CCFワークショップでさらに議論されました(8)。 この原稿では、この血管ベースの座標系の概念的な概要を提示し、その利点と制限について説明します(図1)。
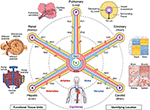
図1。 血管座標系のハブとスポーク構造。 血管座標系は、心臓の室で始まり、終わり、各器官の機能単位(左上から反時計回り:肺胞、糸球体、および肝小葉)に伸びる代表的な血管ループからなる。 細胞の「住所」は、ループの名称(例えば、腎臓の「R」および肝臓の「H」)および最も近い血管の分岐レベル(例えば、腎臓ループ内の求心性細動脈の「RA1」)を含む。 心臓の壁は冠状動脈(”C”)血管ループに沿って存在し、心臓の内部のいくつかの構造の細胞は、実際には血液を提供する毛細血管の近くの座標系の周縁部に位置することに注意してください。 さらに正確な”GPSのような”位置を特定するには、右上から時計回りに行く、血管から遠くに酸素レベルを減少させることから生じる”低酸素指紋”、異なるタイプの血管内皮細胞におけるユニークな”組織学的指紋”と”遺伝子発現指紋”、および異なるタイプの組織に見られる独特の”血管アーキテクチャ指紋”など、複数の方法があります。 血管系は身体のすべての部分(底部)に広がり、すべての器官をすべてのスケールでフレーム化します。 ソースファイル: 肝臓小葉、糸球体、肺胞、遺伝子発現ヒートマップ、および全身血管系の画像は、Wikimedia Commonsから適応されています:https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpghttps://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg(CC BY3.0license);https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svghttps://commons.wikimedia.org/wiki/File:Iris_dendrogram.pngそして、https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg(パブリックドメイン)。 Guo et al.から再現された遺伝子発現ヒートマップ。 (9)シミュレートされたデータを使用します。 Bosettiらに基づく血管アーキテクチャ。 (10)(CC BY4.0ライセンス)。血管座標系の目標は、血管系のマップを構築することではありません。 むしろ、この考え方は、血管系を取り囲む組織における細胞などの解剖学的要素の位置を記述することができる座標系における軸として、身体を通 この提案された枠組みでは、心臓の室は全身マップの起源と見なすことができる。 血管軸には、大動脈または肺動脈を通って伸びる血管ループ(Googleマップのメタファーの「道路」に匹敵する)が含まれており、体内のすべての臓器の他のすべての細胞に近づくにつれて徐々に単一の細胞サイズに先細りになり、心臓に戻ります。 これらの経路に沿って、血管系は、様々な臓器や組織のユニークな生物学に従います;そして、同様に、身体の臓器や組織は、それらの密接に統合された血管系のユニークな特性なしに存在することができませんでした。
ゲノムマップがDNAを線形配列に展開するのと同じように、血管軸の複雑な3D紆余曲折を、心臓の室を中心にした単純な2D”ハブとスポーク”形状に展開することを想像することができます。 血管系のこの模式図は、それが簡単に(1)体内の位置を記述することができます;(2)異なる人々から異なる3D形状が、同等の機能を持つ血管経路を整列させ、(3); そして、(4)異なる器官(スポークを横切って)の同じレベル(例えば、毛細血管)の組織を比較する。
腎臓などの臓器は、すべての毛細血管が明確に考慮されている場合、数万の血管系経路を有する。
すべての毛細血管が明確に考慮されている場 しかし、CCFの構築を実現可能にするために、これらの経路の多くは互いに区別できないという追加の単純化仮定を行います。 特に、最も小さい容器(毛管)は各器官の小さい専門にされた機能単位の中心にあります(例えば。、肝臓における肝小葉、腎臓における糸球体、および肺における肺胞)。 器官全体は、解剖学的および生理学的に類似しているこれらの血管中心の機能単位の多くを必要とする(11)。 この類似性は、多数の血管経路をいくつかの代表的な経路に崩壊させるために使用することができる(図2)。 将来的には、これらの経路の生体分子プロファイルについての詳細を学ぶように、我々は発見された任意のサブタイプに経路を分割することによ

図2。 腎臓の管の細道を単一細胞のレベルに展開すること。 代表的な血管経路は、腎動脈を通って腎臓に入り、糸球体を通過し、腎静脈を戻す。 マクロスケール(左)とメソスケール(中央)では、黄色のボックス内のラベルは、このループに沿って異なる血管に対応する解剖学的構造です。 マイクロスケール(右)では、黄色のボックス内のラベルは、糸球体内の近くの血管の短い距離内にある異なるタイプの細胞である。 個々の細胞の位置は、最も近い容器の住所によって記述することができる(例えば、 の長さに垂直な角度(例えば、「RA0−1 0μ m−1 3 5°」または「RA0−1c−1 3 5°」)である)、血管内皮からの距離または細胞数(マイクロメートル単位)、および血管の長さに垂直な角度( 右端では、各血管とその周囲の組織が元の画像から抽出され、血管経路に沿って細胞の種類と分布がどのように変化するかを容易に見るために垂直 この例では、整列された画像もまた、糸球体の中心が常に右になるように回転されている。 ソースファイル: 腎臓および糸球体の画像は、ウィキメディア・コモンズから適応されています:https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg(CC BY3.0ライセンス);およびhttps://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg(CC BY-SA4.0ライセンス)。
血管座標系の個々のセルの「アドレス」には、4つのコンポーネントがあります。 (1)最初のものは、右腎動脈などの血管ループ(血管領域または「流域」)を最も正確に識別する最も近い解剖学的に命名された血管である。 (2)次の成分は、血管の分岐レベルを表す。 腎臓において、近位から遠位までの例には、小葉間動脈、皮質放射動脈、求心性細動脈、および糸球体毛細血管が含まれる。 分岐レベルは、ゼロレベルの毛細血管で数値的に定義することもでき、より高いレベルではより大きな数値で定義することもできます。 (3)第三の成分は、血管の内皮層からのマイクロメートル単位の垂直距離または細胞数である。 (4)任意の第四成分は、容器の長さに垂直な回転角度であり得る。 ゼロ度は、アプリケーションに応じて多くの方法で定義できます。 例えば、それは、組織標本上のマーカーに対して相対的であり得るか、またはそれは、腎臓における最も近い糸球体の中心などの解剖学的構造に向かって指 これらのコンポーネントの有用性と必要性は、実験的なテストによって確認する必要があります。別のアプローチは、GPSのような様式で他の細胞の相対位置を同定するために内皮細胞を「固定細胞」として使用することである。
内皮は血管系全体を覆う。 異なる内皮細胞(EC)タイプは、独特の細胞特性および隣接する細胞(”組織学的指紋”)を介して組織学的に検出することができるだけでなく、それらの特 血管組織パターン、分岐複雑さ、直径など 各組織のための「血管アーキテクチャ指紋」を形成する追加の認識可能な特徴を提供する(図1偽色蛍光血管系画像)(10、14)。 各組織は特定の酸素勾配を有し、これは血管からの距離を決定するために使用することができる。 PO2を直接測定することができない場合、様々なタイプの細胞における低酸素誘導性遺伝子の誘導/発現勾配から細胞距離を推測することができる(”低酸素フィンガープリント”図1血管の横方向図15-17)。
血管CCFの利点
血管系座標系は生物学的に理にかなっています。 すべての生きている細胞は、酸素を受け取るために、最も近い血管の小さな半径(組織に応じて100μ mから1mm、)内になければなりません(18); そして、すべての血管は、内皮(19)の同じ連続的な層によって裏打ちされています。 したがって、血管系は、マクロスケール(全身/臨床)からメソスケール、マイクロスケール(単一細胞サイズの毛細血管)まで、体のすべての部分に到達する切れ目のない経路を形成する。 これの一部として、それは部門(例えば、糸球体の毛管)によってではなく個々の名前によって認識可能である何百万の顕微鏡の容器にほとんどの人々で 血管系は、個々の体の大きさおよび形状に適応し、個人間の変動を考慮する(20、21)。 それは、肝臓小葉、腎臓糸球体、および肺胞などの異なる器官における機能単位の形状を定義する。 新しい組織の正常な発達は、追加の細胞型がその周りに成長する前に血管形成から始まります(22)。
血管系はまた、連続した方法ですべての器官、組織、および細胞に到達する。
血管系はまた、連続した方法ですべての器官、組織、および細胞に到達す 他の解剖学的構造は、同様の汎用性を持たないようである。 例えば、骨格系は体全体に及ぶ; しかし、臓器内の細胞から最も近い骨までの距離は数センチメートルであり、その骨は臓器の一部ではなく、組織標本の一部である可能性はさらに低い。 神経系は、収縮特性を有するより大きな血管と同じ経路の多くに従うが、それらがすべての組織細胞に到達するより小さな血管に従うように拡張 したがって、細胞の酸素への依存とは異なり、すべての細胞が神経に近接しているという保証はありません。 臓器特異的参照系は、その個々の臓器(例えば、脳の特定の領域)にのみ存在するユニークな構造特性に基づいており、体内の他の場所の細胞位置を表すのに血管座標系には多くの実用的な利点があります。
血管座標系には多くの実用的な利点があります。 全ての器官における血管経路は広範囲に研究されており、文献に詳細に記載されている。 彼らは有用で、よく知られており、多くの専門分野にわたって標準化された名前を持っています。 組織血管形成パターンは、疾患を診断するために臨床的に使用されます; そして、血管は、主要な解剖学的ランドマークとして手術および生検で使用され、「血管領域」を定義するために使用される(23、24)。 3Dデカルト空間内の正確な位置は、切除された組織標本のために決定することは困難であるかもしれないが、外科医は、通常、どの血管流域が標本を含
血管CCFの制限
ゲノム配列内の塩基対を知るだけでは、DNAが特定の細胞内でどのように折り畳まれているかを決定するのに十分な情報 同様に、展開された血管座標系は、マイクロスケールでの近くの細胞の3D空間関係を記述することができるが、血管が取る巻き経路とより大きなスケールでの細胞間の相対的な距離は失われる。 より大きなスケールの構造に関する情報は、臨床イメージングと組織学的および分子パターニングを統合することによ
いくつかの追加の位置情報は、血管経路を崩壊させることによって失われる。 例えば、血管座標系は、最初に腎臓内のすべての糸球体毛細血管を同じ構造として扱い、潜在的に上腎極と下腎極での糸球体の違いをマスキングする しかし、我々はこれらの経路の生体分子プロファイルについての詳細を学ぶように、我々は反復的に発見された任意のサブタイプに経路を分割するこ
これらの制限にもかかわらず、血管座標系は、研究者が機能単位、組織および器官内の個々の細胞を正確に局在化させたり、マクロおよびメソスケールで全身の様々な細胞型に対する文脈の影響を比較することを可能にすることによって、多くのタイプの研究の質問に答えるのに十分な位置情報を保持する。
次のステップと今後の方向性
図1では、一般的な概念を導入するために、血管CCFの非常に単純化された様式化された表現を提示します。 実際の血管経路ははるかに複雑であり、完全な血管CCFは、最終的には数百または数千の構造だけでなく、厳密なハブとスポークのレイアウトに従わない分 例えば、複数の臓器から肝臓に血液を運ぶ肝臓門脈系の静脈、および脳内のウィリスの円のような循環吻合は、図1の”スポーク”に垂直に走り、交差する。
血管CCFはまた、一塩基多型(Snp)がゲノムの正常な変異を記述するのと同じように、チロイデアimaや二重嚢胞動脈などの血管系の正常な解剖学的変異を組 血管CCFの詳細を拡大して記入すると、より雪片やウェブのような外観になり、特定の人でそれらを見つける可能性を示すために異なるセクションに
実際の血管CCFは、その複雑さをより正確に表現し、ソフトウェアアルゴリズムによって”計算可能”にするために、図1に示されているものよりも血管の命名のためのより洗練された符号化方式を必要とする。 一つのアプローチは、UBERONのような既存の解剖学的オントロジーの上に構築することであり、これはすでに多くの血管のための一意のUniform Resource Identifier(Uri)を含み、”branching_part_of”のような様々なリレーションシップタイプを定義して、血管がどのように接続するかを記述する(25)。
セルは複数の容器の近くにあることができ、その場合、各容器に対して別々のアドレスを割り当てることができます。 適切な”カットオフ”距離がどうあるべきかを決定するためには、将来の研究が必要です。 セルの位置を3D空間で三角測量するのに役立つように、複数のアドレスを格納することが望ましい場合があります。
血管CCFのための私たちの最初の動機は、細胞の位置を指定するための座標系を定義することですが、図1に示すように、血管の周りの人体の新 例えば、このフレームワーク内の位置情報は、発生学的発達に類似しており、細胞群から生じる疾患または調節不全を引き起こすメカニズムへの洞察を提 例えば、血管CCFでは、2型糖尿病に関連する大血管疾患(例えば、虚血性心疾患、末梢血管疾患、脳血管疾患)が中心付近に群がり、微小血管疾患(例えば、網膜症、腎症、ニューロパシー)が外側の周りにリングを形成する(26)。
概要
血管系は、以前にCCFが人体内のすべての細胞をマッピングできるようにすることが望ましいと考えられていた特性に応答するいく (1)それは複数のスケールを渡って働きます。 連続的な内皮を通してそれは大きい解剖構造から細胞レベルに継ぎ目が無い転移をする。 (2)それはすべてのボディティッシュに適当です。 臓器は血管の周りに発達するため、血管系はすべてのスケールで臓器アーキテクチャをフレーム化します。 血管パターンは非常に特徴的であるため、他のすべての細胞を除去した血管のみの画像を使用して臓器を識別することが容易にできます。 (3)ドナーの違いを説明します。 血管新生は、組織、体の大きさおよび形状の個々の変化に自然に適応する。 血管CCFは、ある人の各糸球体の3D座標を別の人の糸球体の3D座標にマッピングする代わりに、各人からの代表的な糸球体毛細血管内の各細胞を (4)血管系は、多くの異なる臨床専門分野の開業医によく知られており、病気の診断と手術のガイドの両方を助け、病理学者、放射線科医、および他の臨床医 これにより、組織サンプルを体内に配置し、個々の細胞の位置を登録することが容易になります。 単一のCCFはすべてのユースケースに理想的ではありませんが、血管CCFは、複数の人からの生体分子データを結合し、生物学的に関連する研究の質問を容易に
データ可用性ステートメント
公に利用可能なデータセットは、この研究で分析されました。 このデータは次の場所にあります。https://www.proteinatlas.org。
著者の貢献
GWは、2017CCF会議と2019CCFワークショップからの報告に基づいて、この研究を考案しました。 KBとYJは重要なフィードバックを提供しました。 GWは最初の草案を書き、CCFWS-01スライドプレゼンテーションから転写された追加のテキストを書いた。 すべての著者が原稿の編集に貢献しました。この研究は、国立衛生研究所(NIH)賞OT2OD026671によって支援されました。 この研究は、NIHまたはNational Heart,Lung,and Blood Institute(NHLBI)の意見を表すものではありません。
利益相反
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言し
謝辞
私たちはDr.Zorina Sに感謝しています。 国立衛生研究所のGalisは、2017CCF会議と2019CCFワークショップで血管ベースの座標系のアイデアを開発し、これらのイベントからのプレゼンテーションを提供し、この原稿の基礎を形成する多数の議論に参加したことを支援しました。 レビュアーによる専門家のコメントは、提案された血管ベースの共通座標系を明確にし、詳細に助けた。
3. Uhlén M,Björling E,Agaton C,Szigyarto CA,Amini B,Andersen E,et al. 抗体プロテオミクスに基づく正常組織および癌組織のためのヒトプロテインアトラス。 モルセルプロテオミクス (2005) 4:1920–32. ドイ:10.1074/mcp.M500279-MCP200
PubMed Abstract|CrossRef Full Text|Google Scholar
12。 Vanlandewijck M,He L,Mäe MA,Andrae J,Ando K,Del Gaudio F,et al. 脳血管系における細胞型およびゾーニングの分子アトラス。 自然。 (2018) 554:475–80. 土井:10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V、歌手M.臓器灌流の組織酸素張力モニタリング:理論的根拠、方法論、および文献レビュー。 Br J Anaesth. (2015) 115:357–65. doi:10.1093/bja/aev162
PubMed Abstract|CrossRef Full Text|Google Scholar
17。 コッホCJ. 酸素センサーと2-ニトロイミダゾールEF5を用いた細胞および組織の絶対酸素レベルの測定。 方法Enzymol。 (2002) 352:3–31. 土井:10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi E、Segars WP、チョウザメGM、Roos JE、Ravinのセリウム、Samei E.xcatの一連の幻影の肺建築を模倣する:生理学的に基づかせていた航空路、動脈および静脈。 IEEEトランスメッドイメージング。 (2018) 37:693–702. ドイ:10.1109/TMI。2017.2769640
PubMed Abstract|CrossRef Full Text|Google Scholar
24。 Majno P、Mentha G、Toso C、Morel P、Peitgen HO、Fasel JH。 肝臓の解剖学:複雑さの三つのレベルを持つアウトライン–合わせた領土肝臓切除に向けたさらなるステップ。 J-Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar