普遍的な溶媒
普遍的な溶媒
これは、他の一般的な液体よりも多くの物質が水に溶解するため、もちろん、水の別の重要な特性である。 これは、極性のある水分子が”溶解力”を高めるためです。”溶解は、”塩”を成分”イオンに分解することを含む。”例えば、NaCl(一般的な塩)は、イオンNa+とCl-に分解するため、水分子へのイオン(原子または電荷を有する原子の群)の引力が高い。
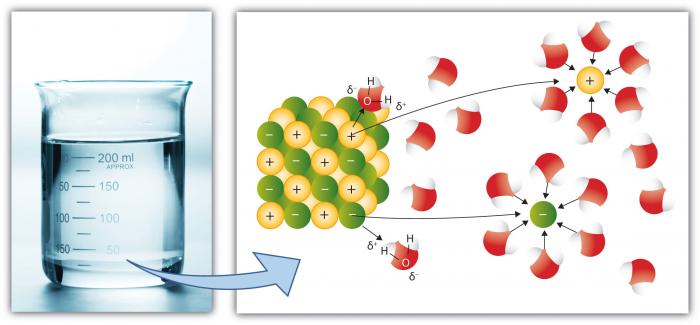
図4。 塩(NaCl)の描画イオンに分解Na+とCl-
出典:Wikimedia Commons
na(ナトリウム)などの陽イオンは正味の正電荷を持ち、アニオン(Cl、塩化物など)は正味の負電荷を持 イオンを形成する多くの個々の元素および化合物が存在する。 したがって、水は、それらの特定の特性に応じて様々な化学種のかなりの濃度を保持することができる。 水分子が個々のイオンをどのように取り囲み、それらを溶液中の他のイオンから分離した状態に保つかに注意してください。 これは、イオンを単離する水の容量を超えるまで起こり、その時点で溶液はそれらのイオンで”飽和”され、より多くを溶解することができない(塩は沈殿し始め、固体を形成する)。