特別な砂糖:シアル酸が代謝、健康、病気にどのように影響するか
私たちは体の外側と内側の表面に生息する微生物が生息しています。 特に腸内微生物叢の理解は、複雑な微生物群集が私たちの食事、他の微生物、そして私たちの細胞表面とどのように相互作用するかを理解し始めると、急速に改善されています。 この環境では多くの化学物質が重要ですが、ここでは、これらの相互作用の多くを支え、代謝、健康、病気に影響を与える重要な分子セットとしてシアル酸に焦点を当てています。
最も一般的なシアル酸、N-アセチル-ノイラミン酸(Neu5Ac)(図。 1)は、その電荷から離れて、それについて本質的に珍しい何も持っていない、比較的単純な糖酸です。 しかし、細胞が他の細胞と接触すると、表面に表示された分子を使用することがよくあり、シアル酸は通常、細胞表面に座っているタンパク質や脂質をペッパーする宿主糖鎖上の末端糖であるため、これが重要になる。 細胞表面または分泌されたムチン糖タンパク質は、呼吸器または胃腸(GI)管などの粘膜表面で微生物が遭遇する可能性のあるシアル酸被覆構造の良 他の人間の細胞、細菌の細胞およびウイルスのための”会い、挨拶する”分子としてこの独特な位置は多くの重要なプロセスのための中心段階にシアル酸
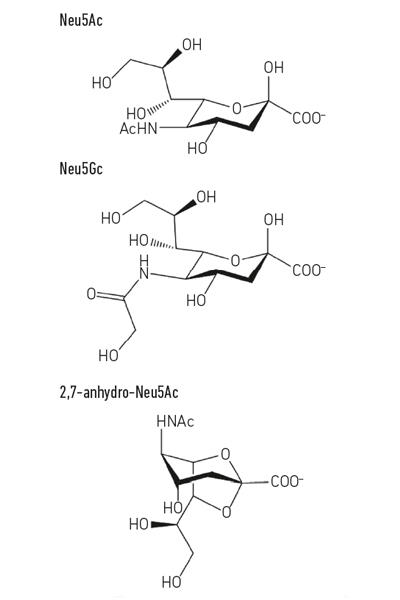
- 図。 1. シアル酸誘導体の例。 Nグリコリルneurnaminic酸(Neu5Gc)は人間、他の大きい類人猿と私達を区別するが、食事療法から得られたとき私達の細胞の表面に組み込むことができる生化学的な
- 糖衣病原菌
- 交差給餌-周りのお菓子を共有する
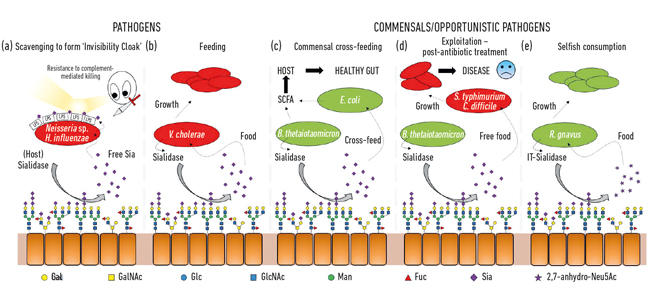
- 図。 2. 宿主糖鎖の範囲上の末端糖として存在する細菌とシアル酸との間の様々な相互作用の漫画のイラスト。 これらはシアリダーゼによって切断され、通常、2,7-アンヒドロ-Neu5Acを放出するIT-シアリダーゼを除いて遊離Neu5Acに変換される。 宿主または病原性シアリダーゼによって放出される遊離シアル酸は、次いで、不可視性クローク(a)として、または摂食(b)のために病原体によって使用され 交差摂食は、腸内微生物叢のメンバー間、または同じニッチを共有する共生細菌と病原菌の間で起こり得る(c、d)が、他の細菌はシアル酸を自分の消費のために確保する利己的なメカニズムを開発している(e)。
- あなた自身のお菓子を保持する
- ウイルスはactに入ります
- さらに読む
- Andrew Bell
- Emmanuele Severi
- Nathalie Juge
- Gavin H.Thomas
- なぜ微生物学は重要なのですか?
- あなたはこの分野で始めて誰かにどのようなアドバイスをしますGavin:”あなたのバグ”を超えて広く読んでください–微生物はほとんどすべてを行うことができ、通常はそれを行うための複数の異なる方法を発明しました!
図。 1. シアル酸誘導体の例。 Nグリコリルneurnaminic酸(Neu5Gc)は人間、他の大きい類人猿と私達を区別するが、食事療法から得られたとき私達の細胞の表面に組み込むことができる生化学的な
糖衣病原菌
シアル酸の最初の微生物機能の一つは、いくつかの病原体が植民地化し、ヒトに病気を引き起こす能力に関連していた。 実際、バーミンガム大学で働いている微生物学協会の元会長であるHarry Smith FRS教授は、Neisseria gonorrhoeaでこの研究を開拓しました。 彼のグループの科学者が体から直接バグを単離したとき、それは人間の血清による殺害(補体媒介殺害)に抵抗性であったが、バグが数世代のために研究室で培養された場合、この保護は失われ、細胞は血清によって殺された。 彼のグループは、これらの病原体が宿主からシアル酸を盗み、それを使用して自分の細胞表面を被覆してヒト化することを発見しました。 しかし、このシアル酸のみを捕捉することができるので、成長培地にその不在は、それ以上のシアル酸が添加されないことを意味し、この”血清保護”を急速に失い、殺される。 他の卑劣なバグの範囲は、Neisseria meningitidis、Campylobacter jejuniまたはHaemophilus influenzaeなどのシアル酸を使用して、同様の戦略を使用して独自の不可視クロークを生成することが判明しました(fig. 2a)
交差給餌-周りのお菓子を共有する
病原体によって不可視マントとして使用されるだけでなく、シアル酸は炭素と窒素の両方を提供し、エネル 以前の研究では、コレラ菌などの病原体はシアル酸を食べるだけで幸せであり、それ自体が宿主の植民地化を成功させるために重要であることが示 2b)。
腸では、シアル酸の主要な供給源は、上皮表面を覆う粘液層の主要な構造成分であるムチンに由来する。 粘液の最も露出した層は、糖がその質量の80%を占めるムチンタンパク質をごちそうする方法を学んだ様々な共生細菌の生息地です。 単純なトポロジカルな観点からは、末端糖としてのシアル酸が最初に収穫され、その後放出されて食べることもできる根底にある糖が露出する。 次世代シーケンシングの出現により、我々はこのニッチに住んでいる微生物に関する知識を得ており、多くはシアル酸の取り込みとその後の異化のための遺伝子を持っています。 刺激的だったのは、bacteroides thetaiotaomicronのような共生嫌気性菌のいくつかは、シアル酸を放出するためにシアリダーゼを分泌するが、実際にそれを使用するためのトランスポーターと異化遺伝子を欠いているという発見でした。 この一見利他的なジェスチャーは、細菌が基礎となる糖にアクセスするために必要とされ、シアリダーゼを持たないが遊離シアル酸を食べるのが得意な共生大腸菌株のように、粘液ニッチに住む他のバグへの代謝交差摂食のプロセスを支えている(図。 2c)。 この概念は現在、植民地化とニッチ適応の重要な側面として認識されています。 これの華麗な例は簡単な定義された腸の微生物叢が付いているマウスモデルを使用してスタンフォード大学からのJustin Sonnenburgのグループによって、記述され 抗生物質治療の後、シアル酸を食べる細菌の多くは一掃され、その結果、腸内に遊離シアル酸が蓄積した。 その後、Salmonella typhimuriumまたはClostridium difficileのような病原体に挑戦されたとき、これらの病原体は、栄養素としての遊離シアル酸から利益を得るであろう(図1 0A)。 2d)。 トランスポーターまたは異化遺伝子を欠いている病原体の変異株は、腸の微生物群集が破壊されたときに病原体の伸長に直接接続を作る、利点を持って したがって、腸内の遊離シアル酸のプールを減少させるメカニズムは、新規な抗感染戦略の一部として提案された。
図。 2. 宿主糖鎖の範囲上の末端糖として存在する細菌とシアル酸との間の様々な相互作用の漫画のイラスト。 これらはシアリダーゼによって切断され、通常、2,7-アンヒドロ-Neu5Acを放出するIT-シアリダーゼを除いて遊離Neu5Acに変換される。 宿主または病原性シアリダーゼによって放出される遊離シアル酸は、次いで、不可視性クローク(a)として、または摂食(b)のために病原体によって使用され 交差摂食は、腸内微生物叢のメンバー間、または同じニッチを共有する共生細菌と病原菌の間で起こり得る(c、d)が、他の細菌はシアル酸を自分の消費のために確保する利己的なメカニズムを開発している(e)。
あなた自身のお菓子を保持する
多くの初期のsialomicrobiologyは病原体に焦点を当てていましたが、より最近の研究は同じニッチに住 腸内微生物叢の分野における今日の研究は、Neu5Acの競争が私たちの腸内でどのように激しいか、そしてそれが病原体と共生体とのバランスをどのよ 特定の細菌がそれだけがアクセスできる形でシアル酸を放出することができればどうなりますか? NorwichのJugeグループの研究では、腸の共生生物Ruminococcus gnavusが、2,7-anhydro-Neu5Acを放出する分子内トランス-シアリダーゼ(IT-シアリダーゼ)と呼ばれる特殊なタイプのシアリダーゼを使用して進化していることが示された(図参照)。 1)Neu5Acの代わりに。 純粋な2,7-脱水-Neu5Acを合成する方法を開発することにより、R.gnavus株は唯一の炭素源として2,7-脱水-Neu5Ac上で成長することができることを示した。 酵素反応を触媒するドメインに加えて、IT-シアリダーゼは、シアル酸に富むムチンへのIT-シアリダーゼの結合を仲介するのに役立つ炭水化物結合ドメ 従って生体内で、これは消化管のシアル酸の豊富な領域の方の細菌を目標とするのを助ける粘液の層内の細菌の植民地化を促進するメカニズム 適切な場所に配置されると、IT-シアリダーゼはムチンの末端鎖からシアル酸を切断し、それを2,7-無水-Neu5Acという形で放出する。 gnavusは、病原体を含む粘液ニッチに生息する他の細菌とNeu5Acを共有するのではなく、独自の食物源として使用することができます(図10)。 2e)。 この機構は、粘液ニッチに生息する他のシアル酸を食べる細菌よりも、優先的にアクセスできる栄養源を提供することによって、競争上の優位性を提 さらに、r.gnavusはまた増加する抗生の抵抗の年齢の新しい治療上の作戦に方法を開ける粘膜の環境のNeu5Acのレベルの減少によって腸病原体の成長
ウイルスはactに入ります
ウイルスはまた、最も有名なインフルエンザウイルスの感染サイクル中に重要な分子としてシアル酸 シアル酸は呼吸器上皮細胞上のウイルスの受容体として機能するため、最初の付着は最初の重要なステップです。 シアル酸のグリカン中の糖への結合のタイプは、インフルエンザウイルスの宿主範囲を制御することが多く、パンデミック株はしばしばヒトのようなシアル酸の結合を認識する接着タンパク質(ヘマグルチニン)を有するため、特に毒性がある。 シアル酸は、感染細胞からの放出が宿主細胞表面からのシアル酸の切断を必要とするため、ウイルスのライフサイクルの最終段階で重要である。 これはシアリダーゼ(またはノイラミニダーゼ)と呼ばれるウイルス酵素によって触媒される。 タミフル®(オセルタミビルリン酸)およびザナミビルに配合されたシアル酸の構造類似体によるこの酵素の阻害は、インフルエンザの最前線の治療であり、構造/機能に触発された薬物設計の勝利である。結論として、シアル酸は、微生物細胞やウイルスが哺乳類細胞表面と相互作用する多くのプロセスにおいて重要な分子であることは明らかである。 この短い記事では、ヒースと病気のさまざまな側面におけるコミュニケーション、ステルス、植民地化、代謝におけるこれらの糖の中心的機能のアイデアを シアル酸は、世界で最も重要な化学物質として記載されており、間違いなく人間の進化とその微生物との相互作用についての詳細を明らかにし続け
さらに読む
トーマス、GH。 細菌中のシアル酸取得-1つの基質、多くの輸送体。 Biochem Soc Trans2016;44:760-765。
Ng KM、Ferreyra JA、Higginbottom SK、Lynch JB、Kashyap PC et al. 微生物叢に遊離した宿主糖は、腸内病原体の抗生物質後の拡張を促進する。 Nature2013;502:96-99。
オーウェンCD、テールフォードLE、モナコS、Šuligoj T、ヴォー Lら。 腸の共生生物Ruminococcus gnavusによるシアル酸認識の特異性とメカニズムを解明する。 2017年8月21日に発売された。
Tailford LE,Owen CD,Walshaw J,Crost EH,Hardy-Goddard J,Le Gall G,de Vos WM,Taylor GL,Juge n.ヒト腸内微生物叢における分子内トランスシアリダーゼの発見は、粘膜適応の新しいメカニズムを示唆している。 2015年6月7日に7624人枠を外れる形でAaa級トレドへ配属された。
Juge N、テールフォードL、オーウェンCD。 腸内細菌からのシアリダーゼ:ミニレビュー。 Biochem Soc Trans2016;44:166-175。

Andrew Bell
Quadram Institute Bioscience,Norwich Research Park,NR4 7UQ,UK
Andrew Bellは、quadram Instituteの腸内微生物と健康学科の大学院生で、シアル酸代謝の新しいメカニズムが腸の恒常性に及ぼす影響を研究しています。 イーストアングリア大学で生化学の学士号を取得し、エンドウ豆(Pisum sativum)のクロロフィル代謝に関するJohn Innes Centreで2年間働いた後、2015年にquadram InstituteのNathalie Jugeのグループに参加し、博士号を取得した。

Emmanuele Severi
ヨーク大学生物学科、ウェントワース-ウェイ、ヨークYO10 5DD、英国
@emm_severi
Emmanuele Severiは、Gavin Thomas教授の研究室で働いているヨーク大学生物学科のポスドク 彼は彼のキャリアの中で異なる時間にシアル酸の輸送と代謝に取り組んでおり、2002年以来、社会のメンバーとなっています。

Nathalie Juge
Quadram Institute Bioscience,Norwich Research Park,NR4 7UQ,UK
Nathalie Jugeは、NorwichのQuadram Institute Bioscience(QIB)の研究リーダーであり、研究所戦略プログラム、腸微生物と健康(GMH)の副リーダーであり、イーストアングリア大学….. 彼女は、腸内微生物叢によるムチン由来シアル酸代謝に焦点を当てて、腸内の宿主-微生物相互作用の糖鎖生物学に関する研究グループをリードしています(https://quadram.ac.uk/nathalie-juge)。

Gavin H.Thomas
ヨーク大学ウェントワースウェイ、ヨークYO10 5DD、英国の生物学部門
@GavinHThomas
Gavin H.Thomasは、ヨーク大学の生物学部門の微生物学の教授であり、十年以上にわたって細菌シアル酸輸送と異化に取り組んできました….. 彼は1995年以来協会のメンバーであり、微生物学の編集者であった今日(2003-2006)、同じ期間に評議会に務め、通信委員会(2012-2015)と平等&多様性委員会(2013-2015)に務めた。 彼は編集者、上級編集者であり、現在は協会の主要なジャーナルMicrobiology(http://thomaslabyork.weebly.com)の副編集長です。なぜ微生物学は重要なのですか?
なぜ微生物学は重要なのですか?
ギャヴィン: それは私たちの健康のために重要です–今だけ、私たちは本当に私たちのマイクロバイオームの分子組成と機能を理解し始めています。あなたはこの分野で始めて誰かにどのようなアドバイスをしますか?
あなたはこの分野で始めて誰かにどのようなアドバイスをしますGavin:”あなたのバグ”を超えて広く読んでください–微生物はほとんどすべてを行うことができ、通常はそれを行うための複数の異なる方法を発明しました!
画像:h3N2インフルエンザウイルス粒子。 CDC/科学フォトライブラリ.
図。 1. アンドリュー-ベル
図。 2. エマヌエーレ-セヴェリ