7.18:ハロゲン化ビニルとハロゲン化アリール
ハロゲン化アリールにおける求核置換
クロロベンゼンの構造をいくつか詳しく見てみましょう。 ブロモベンゼンとヨードベンゼンはちょうど同じです。 クロロベンゼンの構造を描画する最も簡単な方法は次のとおりです。
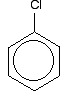
クロロベンゼンを正しく理解するには、これよりも少し深く掘る必要があります。 ベンゼン環の非局在化電子と塩素原子上の孤立電子対の1つとの間に相互作用がある。 これは非局在化環電子系と重複する。 . .p>
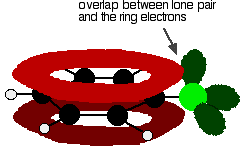
このような構造を与えるには:
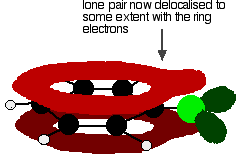
この非局在化は決して完全ではありませんが、炭素-塩素結合と分子の極性の両方….. 非局在化は、炭素と塩素との間にいくつかの余分な結合を導入し、結合をより強くする。 これは、クロロベンゼンのような化合物の反応に大きな影響を及ぼす。
塩素から環に向かって電子が移動することもあります。 塩素は非常に電気陰性であり、通常、炭素-塩素結合の電子をそれ自体に向かって引きます。 この場合、これは非局在化における電子の環への移動によってある程度相殺される。 分子は、あなたがそうでなければ予想していたよりも極性が低いです。
クロロベンゼンのような単純なアリールハライドは、求核置換に対して非常に耐性があります。 塩素を-OHで置換することは可能ですが、200℃および200気圧などの非常に厳しい工業的条件下でのみ可能です。 実験室では、これらの反応は起こりません。 これには2つの理由があります-あなたが話している上記のメカニズムのどれに応じて。ハロゲン化アリール中の炭素-ハロゲン結合の余分な強さ:クロロベンゼン中の炭素-塩素結合は、あなたが期待するよりも強いです。
- ハロゲン化アリール中の炭素-ハロゲン結合の余分な強さ:クロロベンゼン中の炭素-塩素結合は、あなたが期待するよりも強いです。 塩素原子上の孤立電子対の1つと非局在化した環電子との間に相互作用があり、これが結合を強化する。 上記の機構の両方は、ある段階で炭素-ハロゲン結合を破壊することを含む。 壊れることがより困難であればあるほど、反応は遅くなります。
- 環電子による反発:これは、水酸化物イオンが上記の最初のもののような機構によってクロロベンゼンを攻撃した場合にのみ適用 その機構では、水酸化物イオンはハロゲン原子が結合しているわずかに正の炭素を攻撃する。ハロゲン原子がベンゼン環に結合している場合、入ってくる水酸化物イオンは、その炭素原子の上下に非局在化した環電子に直面することになる。 否定的な水酸化物イオンは単に撃退されます。 その特定のメカニズムは、単に非スターターです!