Ouabain
Ouabain er et hjerteglykosid som hemmer ATP-avhengig natrium-kalium utveksling over cellemembraner. Bindingen av ouabain til natrium-kaliumpumpen (Også kalt Na+/K+ ATPase) forhindrer de konformasjonsendringene som er nødvendige for riktig funksjon. Dette påvirker intracellulær ionsammensetning på forskjellige måter med ulike effekter, avhengig av celle og dosering. Forbindelsen har derfor blitt benyttet i medisin, både som terapeutisk og i forskning relatert til aktiv aktiv membrantransport.
Målprotein: Na + / K + ATPase

Na+ / K + atpase transporterer aktivt kalium inn i cellen og natrium til ekstracellulært rom i henhold til det generelle skjemaet som er vist nedenfor. Dette transmembrane proteinet består av tre underenheter, alfa, beta og gamma, som kan dimerize med andre pumper in vivo. Krystallstrukturen er en radialt symmetrisk heksamer, når de er i levende vev, forbinder proteinene mest sannsynlig bilateralt. Alfa-kjeden er vist i rosa / blå og beta-kjeden i gul / grønn. Av de to spiller alfa-underenheten den ledende rollen i proteinets funksjon. Bunten av alfa-helikser i midten av proteinposisjonen hydrofobe rester på utsiden av motivet, åpner en portal gjennom lipid-dobbeltlaget. Det er inne i dette transmembrane domenet at rester av alfa-underenheten koordinerer natrium-eller kaliumioner. Det store domenet på den cytoplasmatiske siden av dobbeltlaget (lengst fra beta-underenheten) flyter i oppløsning og er ansvarlig for binding OG hydrolysering AV ATP. Som med mange protein enzymer av fosfoesterhydrolyse, er fosfatgruppene koordinert med a . Energien som frigjøres fra fosfatspaltning med høy energi overføres via konformasjonsendringer til transmembrandomenet, hvor ioner presses mot konsentrasjonsgradienten. På den ekstracellulære siden beveger seg for å forhindre dissosiasjon av kaliumioner under inngangen til cellen. En tredje gamma-underenhet (lilla/oransje), sammen med beta-underenheten, bidrar til forankring av transmembrane domener til fosfolipid-dobbeltlaget.
Normal funksjon Na + / K + ATPase endres ensrettet mellom to faser, E1 og E2. I e1-fasen binder Den Na + og ATP på innsiden av cellen. Etter hydrolyse utløser det fosforelerte proteinet ADP og endrer konformasjon Til E2, slik at 3Na+ kan dissocieres på den ekstracellulære siden av membranen. Proteinet binder DERETTER 2K+ og hydrolyserer det bundet uorganiske fosfatet, noe som forårsaker reversering Til E1. Like før bindingen Av K+ Til e2-tilstanden binder Ouabain seg til rester inne i pumpen, og forhindrer overgangen tilbake til E1 (dermed magnesiumkofaktoren koordinerer en enzymatisk bundet )
Ouabain Struktur og Binding
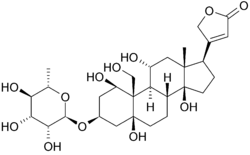
Nedenfor er strukturen av oubain i to dimensjoner. Molekylet består av et sukker bundet til et modifisert kolesterol ved en glykosidisk kobling(dermed glykosid). Hydroksylgruppene som omgir mye av molekylet, sammen med esterne i hver ende, bidrar til bindingen til membranbundet natrium-kaliumpumpe. kan også sees i tre dimensjoner. Med molekylær geometri og stereokjemi som vises på denne måten, kan man se tydeligere fordelingen av polare karbon-oksygen og ikke-polare karbon-karbonbindinger i rommet rundt molekylet. Dette gjør visualisering av bindingen av inhibitoren mye lettere. Ouabain er til proteinet langs innsiden av en alfa-helix bunt. komponenter av rester hjelper noe med å koordinere ouabain gjennom Van Der Waals krefter, men rester, glutamin, asparaginsyre og treonin, sammen med amidbindingen av en alanin, omgir hydroksyl-og karbonylgruppene i liganden, og danner hydrogenbindinger av 2 til 4 ångstrømmer i lengde. Dette holder ikke bare stoffet på plass, men forhindrer konformasjonsendring som er nødvendig for proteinets funksjon.
Hjertemuskel-Og Ionpumpehemming
hemmingen Av Na + / K + ATPase har indirekte effekter på kontraktil styrke eller inotrofi hos hjertemuskelceller. Gjennom økningen i cytoplasmatisk natriumkonsentrasjon aktiveres en natriumkalsiumbytter, og øker dermed den cellulære konsentrasjonen av kalsium. Kalsium er en annen messenger i mange signalerings – / reguleringsveier. Frigjøringen i cytoplasma av muskelceller signalerer sammentrekning, og forklarer den positive effekten av lave doser ouabain på hjerteintrofi. Bildet nedenfor viser denne effekten av alle hjerteglykosider på myokardvev. Som vist, forårsaker inhiberingen av natriumkaliumpumpen forhøyet cytoplasmisk natrium, som aktiverer natriumkalsiumpumpen som forårsaker økning i cytoplasmisk kalsium. Dette øker kraften som cellen samler sammen.
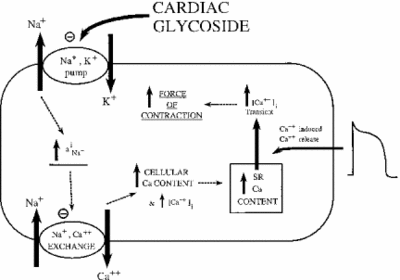
hvis dosert riktig, viser ouabain å være effektiv i behandling av hjertesvikt og arytmier. Imidlertid kan ouabainaktivitet indirekte bidra til overbelastning av myokardceller med natrium. Passive Na + kanaler er vanligvis inaktivert når membranpotensialet er på sitt høyeste. Når de åpner eller ikke lukker, kan for mye natrium lekke inn i cellen, noe som forårsaker sløsing med ATP og/eller ukoordinert muskelkontraksjon. Dette kalles sent I-Na. Med økningen av natrium og kalsium aktiveres En Ca2 + – kalmodulinavhengig kinase, som igjen fosforylerer Og aktiverer passive Na + – kanaler. Når effekten av ouabain forsterkes på denne måten, kan stoffet forårsake mer skade enn godt. Forskning har vist at en effektiv måte å bekjempe sent I-Na er ved inhibering Av Ca2 + – calmodulin-avhengig kinase (Hoyer et al. 2011).