Refissa
Generisk Navn: tretinoin
Doseringsform: krem
Medisinsk anmeldt Av Drugs.com. sist oppdatert 1.April 2020.
- Oversikt
- Bivirkninger
- Dosering
- Profesjonell
- Interaksjoner
- Mer
FOR AKTUELL BRUK PÅ ANSIKTET BARE.
- Refissa Beskrivelse
- Refissa-Klinisk Farmakologi
- Indikasjoner og Bruk For Refissa
- KLINISKE STUDIER DATA
- Kontraindikasjoner
- Advarsler
- Forholdsregler
- Generelt
- Informasjon til Pasienter
- Legemiddelinteraksjoner
- Karsinogenese, Mutagenese, Nedsatt Fertilitet
- Graviditet
- Graviditetskategori C
- Ammende Mødre
- Pediatrisk Bruk
- Geriatrisk Bruk
- Bivirkninger
- Overdosering
- Refissa Dosering og Administrasjon
- Hvordan Leveres Refissa
- Lagring
- HOVEDSKJERMPANEL – 40 G Rørkartong
- Mer Om Refissa (tretinoin aktuell)
- forbruker ressurser
- profesjonelle ressurser
- Relaterte behandlingsveiledninger
Refissa Beskrivelse
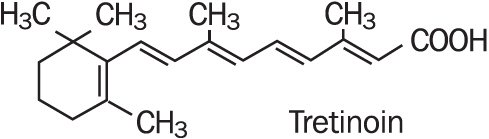
Refissa, inneholder virkestoffet tretinoin (et retinoid) i en mykgjørende krem base. Tretinoin er et gul-til-oransje krystallinsk pulver som har en karakteristisk floral lukt. Tretinoin er løselig i dimetylsulfoksid, lett løselig i polyetylenglykol 400, oktanol og 100% etanol. Det er praktisk talt uoppløselig i vann og mineralolje, og det er uoppløselig i glyserin. Det kjemiske navnet for tretinoin er (all-E) – 3,7-dimetyl-9 – (2,6,6-trimetyl-1-cyclonexen-1-yl)-2,4,6,8-nonatetraenoic syre. Tretinoin er også referert til som all-trans-retinsyre og har en molekylvekt på 300,44. Strukturformelen er representert nedenfor.
Refissa inneholder tretinoin i en konsentrasjon på 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa-Klinisk Farmakologi
den eksakte virkningsmekanismen til tretinoin er ukjent, selv om retinoider antas å utøve en effekt på veksten og differensieringen av forskjellige epitelceller. Når det ble påført topisk, var det imidlertid ingen registrert økning i desmosin, hydroksyprolin eller elastin mRNA i human hud. I tillegg er rollen som dette produktets irriterende natur ved å utføre de positive effektene som tilskrives dette produktet for indikasjonen, ennå ikke fullstendig bestemt.
transdermal absorpsjon av tretinoin fra forskjellige topiske formuleringer varierte fra 1% til 31% av den påførte dosen, avhengig av om den ble påført sunn hud eller dermattisk hud. Når perkutan absorpsjon Av Tretinoin Krem, USP (Mykgjørende) 0,05% ble vurdert hos friske menn (n=14) etter en enkelt applikasjon, samt etter gjentatte daglige applikasjoner i 28 dager, var absorpsjonen av tretinoin mindre enn 2% og endogene konsentrasjoner av tretinoin og dets hovedmetabolitter var uendret.
Indikasjoner og Bruk For Refissa
(for å forstå fullt ut indikasjonen for dette produktet, vennligst les hele INDIKASJONER og BRUK delen av merkingen.Refissa er indisert som et tilleggsmiddel (se andre punkt nedenfor) for bruk i reduksjon (palliasjon) av fine rynker, spettet hyperpigmentering og taktil grovhet i ansiktshuden hos pasienter som ikke oppnår slik palliasjon ved bruk av omfattende hudpleie-og solavviksprogrammer (se punkt 3 for populasjoner der effektivitet ikke er fastslått). Refissa ELIMINERER IKKE RYNKER, REPARERER SOLSKADET HUD, REVERSERER FOTOGRAFERING, ELLER GJENOPPRETTER ET MER UNGDOMMELIG ELLER YNGRE HUDHISTOLOGISK MØNSTER. Mange pasienter oppnår ønsket palliativ effekt på fine rynker, spettet hyperpigmentering og taktil grovhet i ansiktshuden ved bruk av omfattende hudpleie og solavviksprogrammer, inkludert solkrem, beskyttende klær og mykgjørende kremer SOM ikke inneholder tretinoin.
- Tretinoin Krem, USP (Mykgjørende) 0.05% har ikke vist NOEN FORMILDENDE EFFEKT på signifikante tegn på kronisk soleksponering som grov eller dyp rynke, hudguling, lentiginer, telangiektasi, hudslapphet, keratinocytisk atypi, melanocytisk atypi eller dermal elastose.Refissa bør brukes under medisinsk tilsyn som et supplement til et omfattende hudpleie-og solavviksprogram som inkluderer bruk av effektive solkrem (minimun SPF på 15) og beskyttende klær når ønskede resultater på fine rynker, spettet hyperpigmentering og grovhet av ansiktshud ikke er oppnådd med et omfattende hudpleie-og solavviksprogram alene.
- Effektiviteten Av Refissa i reduksjon av fine rynker, spettet hyperpigmentering og taktil grovhet av ansiktshud er ikke fastslått hos personer over 50 år ELLER hos personer med moderat til tungt pigmentert hud. I tillegg ble pasienter med synlige aktiniske keratoser og pasienter med tidligere hudkreft ekskludert fra kliniske studier Med Tretinoinkrem, USP (Mykgjørende) 0,05%. Effekt og sikkerhet av Refissa i disse populasjonene er derfor ikke kjent på dette tidspunkt.
- Verken Sikkerhet eller effekt Av Refissa for forebygging eller behandling av aktiniske keratoser eller hud-neoplasmer er fastslått.Verken sikkerhet eller effekt ved Bruk Av Refissa daglig i mer enn 48 uker er fastslått, og daglig bruk utover 48 uker har ikke blitt systematisk og histologisk undersøkt i adekvate og velkontrollerte studier. (SE AVSNITTET ADVARSLER.)
KLINISKE STUDIER DATA
To adekvate og velkontrollerte studier ble utført med totalt 161 evaluerbare pasienter (under 50 år) behandlet Med Tretinoin Krem, USP (Emollient) 0,05% og 154 evaluerbare pasienter behandlet med vehicle emollient cream i ansiktet i 24 uker som et supplement til et omfattende hudpleie og sol unngåelse program, for å vurdere effekten på fine rynker, spraglete hyperpigmentering, og taktile hudproblemer.hud ruhet. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | Reduksjon av 2 enheter eller mer |
i disse forsøkene ble de fine rynkene, flekkete hyperpigmenteringene og den taktile ujevnheten i ansiktshuden antatt å være forårsaket av flere typer hud.faktorer som inkluderte iboende aldring eller miljøfaktorer, for eksempel kronisk soleksponering.
resultatene av disse vurderingene er som følger:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 16% | |
| kjøretøy + csp | 67% | 10% | |
de fleste forbedringene i disse tegnene ble observert i løpet av de første 24 ukene av behandlingen. Deretter opprettholdt behandlingen primært forbedringen som ble oppnådd i løpet av de første 24 ukene.Et flertall av pasientene vil miste de mest formildende effektene Av Refissa på fine rynker, spettet hyperpigmentering og taktil grovhet i ansiktshuden ved seponering av et omfattende hudpleie-og solavviksprogram inkludert Refissa; imidlertid er sikkerheten og effektiviteten ved Bruk Av Refissa daglig i mer enn 48 uker ikke fastslått.
Kontraindikasjoner
dette legemidlet er kontraindisert hos personer med en historie med følsomhetsreaksjoner på noen av dets komponenter. Det bør seponeres dersom overfølsomhet overfor noen av ingrediensene er notert.
Advarsler
- Refissa Er en dermal irriterende, og resultatene av fortsatt irritasjon av huden i mer enn 48 uker ved kronisk langvarig bruk er ikke kjent. Det er tegn på atypiske endringer i melanocytter og keratinocytter, og økt dermal elastose hos noen pasienter behandlet Med Tretinoinkrem, USP (Mykgjørende) 0,05% i mer enn 48 uker. Betydningen av disse funnene er ukjent.
- Sikkerhet Og effekt Av Refissa hos personer med moderat eller sterkt pigmentert hud er ikke fastslått.Refissa skal ikke administreres dersom pasienten også tar legemidler som er kjent for å være fotosensibilisatorer (f.eks. tiazider, tetracykliner, fluorokinoloner, fenotiaziner, sulfonamider) på grunn av muligheten for økt fototoksisitet.
på grunn av økt brennende følsomhet, bør eksponering for sollys (inkludert sollys) unngås eller minimeres ved Bruk Av Refissa. Pasienter må advares om å bruke solkrem (minimum SPF 15) og verneklær ved Bruk Refissa. Pasienter med solbrenthet bør rådes til ikke å bruke Refissa før de er helt restituert. Pasienter som kan ha betydelig soleksponering, f.eks. på grunn av sitt yrke og de pasientene med iboende følsomhet for sollys, bør utvise særlig forsiktighet ved Bruk Av Refissa og forsikre seg om at forholdsregler som er beskrevet I Pakningsvedlegget til Pasienten er observert.
Tretinoin Krem, USP (Mykgjørende) 0,05% bør holdes ut av øyne, munn, vinkler av nesen, og slimhinner. Lokal bruk kan forårsake alvorlig lokal erytem, kløe, brennende, stikkende og peeling på applikasjonsstedet. Hvis graden av lokal irritasjon tilsier det, bør pasientene instrueres til å bruke mindre medisiner, redusere hyppigheten av påføring, slutte å bruke midlertidig eller slutte å bruke helt.
Tretinoin er rapportert å forårsake alvorlig irritasjon på eksematøs hud og bør kun brukes med forsiktighet hos pasienter med denne tilstanden.Bruk av større mengder medisiner enn anbefalt vil ikke føre til raskere eller bedre resultater, og merket rødhet, peeling eller ubehag kan oppstå.
Forholdsregler
Generelt
Refissa bør bare brukes som et supplement til en omfattende hudpleie og sol unngåelse program. (SE AVSNITT INDIKASJONER og BRUK.)
hvis det utvikles en sensitivitet for legemidlet, kjemisk irritasjon eller en systemisk bivirkning, bør Bruk Av Refissa seponeres.vær ekstremer, som vind eller kulde, kan være mer irriterende for pasienter som bruker Refissa.
Informasjon til Pasienter
Se Pakningsvedlegg For Pasienter.
Legemiddelinteraksjoner
Samtidig aktuelle medisiner, medisinert eller slipende såper, sjampo, rensemidler, kosmetikk med en sterk tørkeeffekt, produkter med høye konsentrasjoner av alkohol, astringents, krydder eller lime, permanent bølge løsninger, elektrolyse, hår depilatories eller voks, og produkter som kan irritere huden bør brukes med forsiktighet hos pasienter som behandles med Refissa fordi de kan øke irritasjon Med Refissa.
Refissa skal ikke administreres dersom pasienten også tar legemidler som er kjent for å være fotosensibilisatorer (f. eks., tiazider, tetracykliner, fluorokinoloner, fenotiaziner, sulfonamider) på grunn av muligheten for forstørret fototoksisitet.
Karsinogenese, Mutagenese, Nedsatt Fertilitet
i en livslang dermal studie med CD-1-mus ved 100 og 200 ganger gjennomsnittlig anbefalt human topisk klinisk dose ble det observert noen få hudtumorer hos hunnmus og levertumorer hos hannmus. Den biologiske betydningen av disse funnene er ikke klar fordi de forekom ved doser som oversteg den dermale maksimalt tolererte dosen (MTD) av tretinoin, og fordi de var innenfor bakgrunnen naturlig forekomst rate for disse svulstene i denne stammen av mus. Det var ingen tegn på karsinogent potensiale når tretinoin ble administrert topisk i en dose 5 ganger den gjennomsnittlige anbefalte humane topikale kliniske dosen. For sammenligninger av dyrs eksponering for human eksponering, er» anbefalt human topisk klinisk dose » definert som 500 mg Refissa påført daglig til en 50 kg person.
i en kronisk, toårig bioassay Av Vitamin a-syre hos mus utført Av Tsubura og Yamamoto, ble generalisert amyloidavsetning rapportert i alle grupper i basallaget Av Vitamin a-behandlet hud. I CD – 1-mus rapporterte en lignende studie hyalinisering av de behandlede hudstedene, og forekomsten av dette funnet var henholdsvis 0/50, 3/50 og 2/50 hos hannmus og 1/50, 0/50, 4/50 og 2/50 hos hunnmus fra vehicle control, 0,25 mg/kg, 0,5 mg/kg og 1 mg/kg grupper.
Studier på hårløse albinomus tyder på at tretinoin kan øke det tumorigene potensialet for kreftfremkallende doser AV UVB og UVA-lys fra en solsimulator. I andre studier, da lettpigmenterte hårløse mus behandlet med tretinoin ble eksponert for kreftfremkallende doser AV UVB-lys, var forekomsten og frekvensen av utvikling av hudtumorer enten redusert eller ingen effekt ble sett. På grunn av vesentlig forskjellige eksperimentelle forhold er det ikke mulig å sammenligne disse ulike dataene på dette tidspunktet. Selv om betydningen av disse studiene hos mennesker ikke er klar, bør pasientene minimere eksponering for sol.
det mutagene potensialet til tretinoin ble evaluert I ames-analysen og i in vivo mikronukleustesten til mus, som begge var negative.Dermal Segment I og III studier Med Tretinoin Krem, USP (Mykgjørende) 0,05% har ikke blitt utført i noen arter. I orale Segment I-og Segment III-studier hos rotter med tretinoin ble det observert redusert overlevelse for nyfødte og vekstretardasjon ved doser over 2 mg/kg / dag (> 400 ganger gjennomsnittlig human topisk klinisk dose).
Graviditet
Teratogene effekter
Graviditetskategori C
ORAL tretinoin har vist seg å være teratogent hos rotter, mus, kaniner, hamstere og subhumane primater. Det var teratogent og fetotoksisk hos rotter når det ble gitt oralt eller lokalt i doser 1000 ganger gjennomsnittlig anbefalt human aktuell klinisk dose. Imidlertid har variasjoner i teratogene doser blant ulike stammer av rotter blitt rapportert. Hos cynomolgusaper, som metabolisk er nærmere mennesker for tretinoin enn de andre undersøkte artene, ble føtale misdannelser rapportert ved doser på 10 mg/kg/dag eller høyere, men ingen ble observert ved 5 mg/kg/dag (1000 ganger gjennomsnittlig anbefalt human topisk klinisk dose), selv om økte skjelettvariasjoner ble observert ved alle doser. En doserelatert økning i embryoletalitet og abort ble rapportert. Lignende resultater har også blitt rapportert i pigtail macaques.
TOPISK tretinoin i dyrs teratogenitetstester har generert tvetydige resultater. Det er holdepunkter for teratogenisitet (forkortet eller knekt hale) av topikal tretinoin hos wistar-rotter ved doser større enn 1 mg / kg / dag (200 ganger anbefalt human topikal klinisk dose). Anomalier (humerus: kort 13%, bøyd 6%, os parietal ufullstendig ossified 14%) er også rapportert når 10 mg/kg/dag ble dermalt påført.
Det er andre rapporter hos New Zealand Hvite kaniner administrert med doser på omtrent 80 ganger den anbefalte humane topikale kliniske dosen med økt forekomst av hvelvet hode og hydrocefali, typisk for retinoidinduserte føtale misdannelser hos denne arten.i motsetning til dette har flere velkontrollerte dyrestudier vist at dermalt påført tretinoin ikke var teratogent, ved doser på henholdsvis 100 og 200 ganger den anbefalte humane topikale kliniske dosen, hos rotter og kaniner.
med utbredt bruk av et hvilket som helst legemiddel, vil et lite antall fødselsdefektrapporter knyttet midlertidig til administrasjonen av legemidlet forventes ved en tilfeldighet alene. Tretti tilfeller av midlertidig assosierte medfødte misdannelser er rapportert i løpet av to tiår med klinisk bruk av en annen formulering av topisk tretinoin (Retin-A). Selv om det ikke er fastslått noe bestemt mønster av teratogenisitet og ingen tilfeldig sammenheng fra disse tilfellene, beskriver 5 av rapportene den sjeldne fødselsdefektkategorien holoprosencefali(defekter forbundet med ufullstendig midtlinjeutvikling av forebrain). Betydningen av disse spontanrapportene når det gjelder risiko for fosteret er ikke kjent.
Ikke-teratogene effekter
Dermal tretinoin har vist seg å være fetotoksisk hos kaniner når det gis i doser 100 ganger den anbefalte topikale humane kliniske dosen. Oral tretinoin har vist seg å være fetotoksisk hos rotter når det administreres i doser 500 ganger anbefalt aktuell human klinisk dose.
det finnes imidlertid ingen adekvate og velkontrollerte studier hos gravide kvinner. Refissa skal ikke brukes under graviditet.
Ammende Mødre
det er ikke kjent om dette legemidlet utskilles i morsmelk. Fordi mange legemidler utskilles i morsmelk, bør forsiktighet utvises når Refissa administreres til en ammende kvinne.
Pediatrisk Bruk
Sikkerhet og effekt hos pasienter under 18 år er ikke fastslått.
Geriatrisk Bruk
Sikkerhet Og effekt hos personer eldre enn 50 år er ikke fastslått.
Bivirkninger
(SE AVSNITT ADVARSLER og FORSIKTIGHETSREGLER.)
i dobbeltblinde, kjøretøykontrollerte studier med 179 pasienter som brukte Tretinoinkrem, USP (Mykgjørende) 0,05% i ansiktet, var bivirkninger forbundet med Bruk Av Tretinoinkrem, USP (Mykgjørende) 0,05% begrenset primært til huden. Under disse studiene måtte 4% av pasientene slutte å bruke Tretinoinkrem, USP (Mykgjørende) 0,05% på grunn av bivirkninger. Disse seponeringene skyldtes hudirritasjon eller relaterte kutane bivirkninger.Lokale reaksjoner som flassing, tørr hud, brennende, stikkende, erytem og kløe ble rapportert hos nesten alle forsøkspersoner under Behandling Med Tretinoinkrem, USP (Mykgjørende) 0,05%. Disse tegnene og symptomene var vanligvis av mild til moderat alvorlighetsgrad og forekom vanligvis tidlig i behandlingen. I de fleste pasienter tørrhet, peeling, og rødhet dukket opp igjen etter en innledende (24 uke) nedgang.
Overdosering
Bruk av større mengder medisiner enn anbefalt har ikke vist seg å føre til raskere eller bedre resultater, og merket rødhet, peeling eller ubehag kan oppstå. Oral inntak av stoffet kan føre til de samme bivirkningene som de som er forbundet med overdreven oral inntak Av Vitamin A.
Refissa Dosering og Administrasjon
- Ikke bruk Refissa hvis pasienten er gravid eller forsøker å bli gravid eller har høy risiko for graviditet
- Ikke bruk Refissa hvis pasienten er solbrent eller hvis pasienten har eksem eller andre kroniske hudtilstander
- ikke bruk Refissa hvis pasienten er iboende følsom for sollys
- ikke bruk Refissa hvis pasienten også tar legemidler kjent som fotosensibilisatorer(f.eks. tiazider, Tetracykliner, fluorokinoloner, fenotiaziner, SULFONAMIDER) på grunn av muligheten for økt fototoksisitet.
Pasienter krever detaljert instruksjon for å oppnå maksimale fordeler og å forstå alle forholdsregler som er nødvendige for å bruke dette produktet med størst sikkerhet. Legen bør gjennomgå Pakningsvedlegget for Pasienten.
Refissa skal påføres ansiktet en gang daglig før du legger deg, og bruker bare nok til å dekke hele det berørte området lett. Pasienter bør forsiktig vaske ansiktene med en mild såpe, klapp huden tørr og vent 20 til 30 minutter før Du bruker Refissa. Pasienten bør bruke en ert størrelse mengde krem for å dekke hele ansiktet lett. Spesiell forsiktighet bør tas ved påføring av krem for å unngå øyne, ører, nesebor og munn.
Bruk Av Refissa kan føre til en forbigående følelse av varme eller svak svie.
Reduksjon (palliasjon) av ansikts fin rynker, spraglete hyperpigmentering, og taktil ruhet kan oppstå gradvis i løpet av behandlingen. Opptil seks måneders behandling kan være nødvendig før effektene blir sett. Det meste av forbedringen med Refissa ses i løpet av de første 24 ukene av behandlingen. Deretter opprettholder behandlingen primært forbedringen realisert i løpet av de første 24 ukene.med seponering Av Refissa terapi, vil et flertall av pasientene miste mest formildende effekter Av Refissa på fine rynker, spraglete hyperpigmentering, og taktile ruhet av ansiktshuden; men sikkerheten og effektiviteten av Å bruke Refissa daglig i mer enn 48 uker har ikke blitt fastslått.Bruk av større mengder medisiner enn anbefalt kan ikke føre til raskere resultater eller bedre resultater, og merket rødhet, peeling eller ubehag kan oppstå.
Pasienter som behandles Med Refissa kan bruke kosmetikk, men områdene som skal behandles bør renses grundig før medisinen påføres. (SE AVSNITTET FORHOLDSREGLER.)
Hvordan Leveres Refissa
Refissa er tilgjengelig i:
20 g RØR NDC 42851-012-20
40 g rør NDC 42851-012-40
Lagring
Lagre ved 20-25°C (68-77°F). MÅ IKKE FRYSES.
Bare Rx.
Trykt I USA
140904-0118
Produsert AV DPT Laboratories, San Antonio, TX 78215
Distribuert AV ZO Skin Health, Inc., Irvine, CA 92618
refissa®
TIL UTVORTES BRUK I ANSIKTET
Hva Er Den Viktigste Informasjonen Om Refissa?
Refissa er en alvorlig medisinering. Det eliminerer ikke rynker eller reparerer solskadet hud. Det kan bidra til å behandle fine rynker, flekkete misfarging, og grov følelse hud, men det betyr ikke «kurere» disse forholdene. Refissa bør bare brukes under tilsyn av helsepersonell som en del av et bredt hudpleie program. Dette programmet bør omfatte å unngå direkte sollys (ved å bruke verneklær og solkrem med MINIMUM SPF PÅ 15) og bruke andre fuktighetsgivende ansikts kremer som ikke inneholder tretinoin.
Du bør bare bruke Refissa ved sengetid. Ikke bruk tørke hudpleieprodukter. Bruk den minste Mengden Refissa nødvendig og unngå å få det i dine øyne, ører, nese eller munn.
ADVARSEL: bruk Ikke Refissa hvis du er gravid eller forsøker å bli gravid. Unngå sollys og andre legemidler som kan øke følsomheten for sollys (se nedenfor).
Refissa har ikke blitt studert hos personer over 50 år eller hos personer med moderat eller mørk pigmentert hud.
Hva Er Refissa?
(Hva kan jeg forvente Fra Refissa?Refissa Er en alvorlig medisin som kan bidra til å behandle, men vil ikke «kurere» fine rynker, flekkete hud misfarging, og grov følelse hud.Studier viser at etter 24 uker, ca 30% av de som brukte Tretinoin Krem, USP (Mykgjørende) 0,05% for fine rynker eller flekkete misfarging hadde moderat forbedring, en annen 35% hadde minimal forbedring og 35% hadde ingen forbedring. Omtrent 16% av de som brukte Tretinoin Krem, USP (Mykgjørende) 0,05% for grov hud hadde moderat forbedring, 35% hadde minimal forbedring, og 49% hadde ingen forbedring. Det er ingen bevis for At Refissa behandler grov hud, dype rynker, gulende hud eller andre hudpleieproblemer.
Refissa skal brukes som en del av et bredt hudpleieprogram. Dette programmet bør omfatte å unngå direkte sollys (ved å bruke verneklær og solkrem med MINIMUM SPF PÅ 15) og bruke andre fuktighetsgivende ansikts kremer som ikke inneholder tretinoin. Mange mennesker kan oppnå ønskede effekter ved å bruke dette programmet uten Å bruke Refissa. Du bør ikke bruke Refissa før du har prøvd et bredt hudbehandlingsprogram uten Refissa.
når Du bruker Refissa, forbedring i fine rynker, flekkete hud misfarging og grov hud er ikke umiddelbar og skjer gradvis over tid. Vanligvis kan du merke noen effekter i 3 til 4 måneder. Effektene er vanligvis mest merkbare på ca 6 måneder med liten ekstra forbedring etter den tiden. Hvis Refissa stoppes, vil forbedringen gradvis redusere.
sikkerheten ved Bruk Av Refissa daglig i mer enn 48 uker er ikke fastslått.
Hvem Bør Ikke Bruke Refissa?
Du bør ikke bruke Refissa hvis du er solbrent eller svært følsom for solen, hvis du har eksem, eller hvis huden din er irritert. Refissa kan forårsake økt hudirritasjon og økt følsomhet for solbrenthet.
Siden Refissa kan gjøre huden mer følsom for sollys, bør du informere helsepersonell dersom du også bruker andre legemidler som øker følsomheten for sollys fordi Du ikke skal bruke Refissa sammen med disse legemidlene. Disse inkluderer, men er ikke begrenset til: tiazider (brukes til å behandle høyt blodtrykk), tetracykliner, fluorokinolner eller sulfonamider (brukes til å behandle infeksjoner) og fenotiaziner(brukes til å behandle alvorlige emosjonelle problemer). Hvis du tar noen reseptbelagte medisiner, reseptfrie medisiner eller bruker noen ansikts kremer, sjekk med helsepersonell for å sørge for at de ikke samhandler med Refissa.
Graviditet Advarsel: Sikker bruk under graviditet er ikke vist. Det er rapporter om fødselsskader hos forsøksdyr og mennesker som fikk tretinoin gjennom munnen. Du bør ikke bruke Refissa hvis du er gravid eller prøver å bli gravid.
Det er ikke kjent om Refissa overføres til spedbarn gjennom morsmelk. Sikker bruk hos barn er ikke vist.
Sikkerhet Og effekt Av Refissa for personer over 50 år eller med mørkere hudfarge har ikke blitt bevist.
hvordan skal Jeg bruke Refissa?
Du bør bruke Refissa til ansiktet ditt en gang om dagen før du trekker deg med bare nok til å dekke hele det berørte området lett. Vask ansiktet forsiktig med en mild såpe, klapp huden tørr og vent 20 til 30 minutter før Du bruker Refissa. Påfør en ert størrelse mengde krem for å dekke hele ansiktet. Du kan føle en varme eller svak svie når Refissa er først brukt.
du må være spesielt forsiktig når du bruker krem for å unngå øyne, ører, nesebor eller munn. Refissa kan forårsake alvorlig rødhet, kløe, svie, svie, og peeling hvis brukt til disse områdene.
Bruk av Større enn nødvendige mengder Refissa vil ikke få fart på resultatene og kan føre til overdosering. En overdose kan resultere i rød og peeling hud samt noen smerte eller ubehag.
du kan bruke kosmetikk etter Bruk Refissa. Sørg for å rengjøre ansiktet grundig før Du bruker Refissa igjen.
Hva Bør Jeg Unngå Når Jeg Bruker Refissa?
Refissa øker følsomheten for sollys. Unngå sollys så mye som mulig. Bruk verneklær og solkrem med MINIMUM SPF på 15. Ikke solbat eller bruk sollamper. Hvis du er følsom for sollys eller har en jobb som krever at du er ute i solen i lange perioder, må du bruke ekstrem forsiktighet.
mens Du bruker Refissa, unngå produkter som kan tørke eller irritere huden. Unngå for eksempel produkter som påføres huden som inneholder alkohol, krydder eller kalk. Unngå også rensemidler, hårfjerning eller andre produkter som kan irritere huden.
Hva Er De Mulige Bivirkningene Av Refissa?
de vanligste bivirkningene er hudreaksjoner. Kløe, rød og tørr hud er rapportert. Så har brennende, stikkende og peeling hud. Disse er oftest milde og er vanligst når behandlingen påbegynnes.
Hvordan Kan Jeg Få Mer Informasjon?
Dette pakningsvedlegget oppsummert den viktigste informasjonen om Refissa. Hvis du ønsker mer informasjon, snakk med legen din eller annet helsepersonell. Det er også en brosjyre skrevet for helsepersonell som apoteket kan gi deg.
RING LEGEN DIN FOR MEDISINSKE RÅD OM BIVIRKNINGER. DU KAN RAPPORTERE BIVIRKNINGER TIL FDA PÅ 1-800-FDA-1088.
HOVEDSKJERMPANEL – 40 G Rørkartong
NDC 42851-012-40
117471-0118
refissa ®
Tretinoin Krem,
USP (Mykgjørende) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
Mer Om Refissa (tretinoin aktuell)
- Bivirkninger
- Under Graviditet eller Amming
- Doseringsinformasjon
- Legemiddelinteraksjoner
- Priser& Kuponger
- En Españ
- Legemiddelklasse: aktuelle aknemidler
forbruker ressurser
- pasientinformasjon
- refissa aktuell (Avansert Lesing)
profesjonelle ressurser
andre merker retin-a, Renova, Atralin, altreno, … +2 mer
Relaterte behandlingsveiledninger
- Fotoaldring Av Huden
Medisinsk Ansvarsfraskrivelse