Ouabain
Ouabain is een hartglycoside dat ATP-afhankelijke natrium-kaliumuitwisseling door celmembranen remt. De binding van ouabain aan de natrium-kaliumpomp (ook wel Na+/K+ ATPase genoemd) voorkomt de conformationele veranderingen die nodig zijn voor de juiste functie. Dit beà nvloedt intracellular ionensamenstelling op verschillende manieren met diverse gevolgen, afhankelijk van de cel en de dosering. De verbinding is daarom gebruikt in geneeskunde, zowel als therapeutisch als in onderzoek met betrekking tot actief actief membraanvervoer.
doeleiwit: Na+ / K+ ATPase

Na+/K+ ATPase transporteert actief kalium in de cel en natrium naar de extracellulaire ruimte volgens het onderstaande algemene schema. Deze transmembraanproteã ne bestaat uit drie subeenheden, alfa, bèta, en gamma, die met andere pompen in vivo kunnen dimeriseren. De, kristalstructuur is een radiaal symmetrische hexamer, wanneer in levende weefsels, de proteã nen hoogstwaarschijnlijk bilateraal associëren. De alpha chain is weergegeven in roze / blauw en de beta chain in geel / groen. Van de twee, speelt de alpha-subeenheid de belangrijke rol in het functioneren van de proteã ne. De bundel alpha-helices in het centrum van de eiwitpositie hydrophobic residuen bij de buitenkant van het motief, het openen van een portaal door de lipide bilayer. Het is binnen dit transmembraandomein dat residuen van de Alfa-subeenheid natrium-of kaliumionen coördineren. Het grote domein aan de cytoplasmatische kant van de bilayer (verst van BÃ ta-subeenheid) drijft in oplossing en is verantwoordelijk voor het binden en hydrolyseren van ATP. Zoals bij veel eiwitenzymen van fosfoesterhydrolyse, worden de fosfaatgroepen gecoördineerd met a . De energie die vrijkomt uit de splitsing van hoog-energetisch fosfaat wordt via conformationele veranderingen overgebracht naar het transmembraandomein, waar de ionen tegen hun concentratiegradiënt worden gedwongen. Aan de extracellulaire kant, de bewegingen om de dissociatie van kaliumionen tijdens hun ingang in de cel te verhinderen. Een derde gamma-subeenheid (paars/oranje), samen met de BÃ ta-subeenheid, draagt bij tot de verankering van transmembraandomeinen aan de fosfolipide bilayer.
normaal functioneren Na+ / K+ ATPase verandert unidirectioneel tussen twee fasen, E1 en E2. In de E1 fase, bindt het Na+ en ATP aan de binnenkant van de cel. Na hydrolyse, werpt de phosphorelated proteã ne ADP uit en verandert bouw aan E2, toestaand voor 3Na+ om op de extracellulaire kant van het membraan te scheiden. De proteã ne bindt dan 2K+ en hydrolyseert het gebonden anorganische fosfaat, veroorzakend de terugkeer naar E1. Vlak voor de binding van K + aan de E2-toestand bindt Ouabain zich aan residuen in de pomp, waardoor de overgang naar E1 wordt voorkomen (dus coördineert de magnesiumcofactor een enzymatisch gebonden)
Ouabainstructuur en Binding
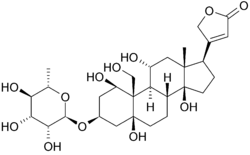
Hieronder is de structuur van oubain in twee dimensies. Het molecuul bestaat uit een suiker gebonden aan een gemodificeerd cholesterol door een glycoside linkage (vandaar glycoside). De hydroxylgroepen die een groot deel van het molecuul omringen, samen met de esters aan beide uiteinden, dragen bij tot zijn binding aan de membraan gebonden natrium-kaliumpomp. kan ook worden gezien in drie dimensies. Met de moleculaire geometrie en stereochemie die op deze manier wordt weergegeven, kan men duidelijker de verdeling van polaire koolstof-zuurstof en apolaire koolstof-koolstofbindingen in de ruimte rond het molecuul zien. Dit maakt het visualiseren van de binding van de remmer veel gemakkelijker. Ouabain is het eiwit langs de binnenkant van een alpha-helix bundel. componenten van residuen helpen enigszins bij het coördineren van ouabain door Van der Waals krachten, maar residuen, glutamine, asparaginezuur en threonine, samen met de amidebinding van een alanine, omringen de hydroxyl-en carbonylgroepen van het ligand en vormen waterstofbindingen van 2 tot 4 angstroms in lengte. Dit houdt niet alleen de drug op zijn plaats, maar verhindert conformational verandering noodzakelijk voor de functie van de proteã ne.
hartspier-en Ionenpompremming
de remming van Na+/K+ ATPase heeft indirecte effecten op de contractiele sterkte of inotrofie van hartspiercellen. Door de verhoging van de cytoplasmatische natriumconcentratie wordt een natrium-calciumwisselaar geactiveerd, waardoor de cellulaire concentratie van calcium wordt verhoogd. Calcium is een tweede boodschapper in vele signalerende / regulerende wegen. De afgifte ervan in het cytoplasma van spiercellen signaleert samentrekking, wat het positieve effect van lage doses ouabain op hartintrofie verklaart. De afbeelding hieronder toont dit effect van alle hartglycosiden op het myocardiale Weefsel. Zoals wordt aangetoond, veroorzaakt de remming van de natrium-kaliumpomp verhoogd cytoplasmatisch natrium, wat de natrium-calciumpomp activeert die een toename van cytoplasmatisch calcium veroorzaakt. Dit verhoogt de kracht waarmee de cel samentrekt.
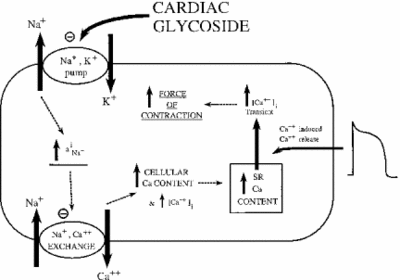
indien correct gedoseerd, blijkt ouabain effectief te zijn bij de behandeling van hartfalen en aritmieën. De activiteit van ouabain kan echter indirect bijdragen aan de overbelasting van myocardiale cellen met natrium. De passieve na + kanalen worden gewoonlijk geïnactiveerd wanneer het membraanpotentieel op zijn hoogste is. Wanneer ze opnieuw openen of niet te sluiten, te veel natrium kan lekken in de cel, waardoor de verspilling van ATP en/of ongecoördineerde spiercontractie. Dit heet late I-Na. Met de stijging van natrium en calcium, wordt een Ca2+-calmoduline-afhankelijk kinase geactiveerd, op zijn beurt phosphorylating en activerende passieve na+ kanalen. Wanneer de effecten van ouabain op deze manier worden versterkt, kan het medicijn meer kwaad dan goed veroorzaken. Onderzoek heeft aangetoond dat een effectieve manier om laat I-Na te bestrijden is door de remming van het Ca2 + -calmoduline-afhankelijke kinase (Hoyer et al. 2011).