19.11: Racemizacja
optycznie aktywne pochodne bifenylu (sekcja 13-5A) są racemizowane, jeśli dwa pierścienie aromatyczne w dowolnym momencie przechodzą przez konfigurację współpłaszczyznową przez obrót wokół wiązania centralnego. Można to osiągnąć mniej lub bardziej łatwo przez ciepło, chyba że podstawniki 2,2 ’ – Orto są bardzo duże.
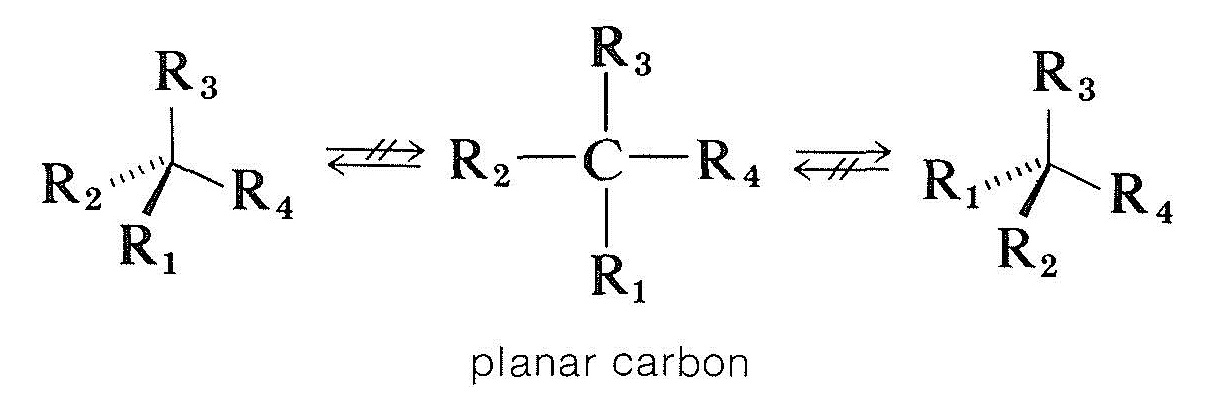
sposób racemizacji związków o asymetrycznych atomach węgla jest bardziej skomplikowany. Jedną z możliwości jest czworościenny chiralny węgiel przyłączony do czterech grup, aby stał się planarny i achiralny bez zerwania żadnych wiązań. Obliczenia teoretyczne wskazują, że nie jest to prawdopodobny proces dla chiralnego tetrawalentnego węgla, ale, jak zobaczymy, zachodzi on z chiralnym węglem i innymi chiralnymi atomami, które są przyłączone do trzech grup:
optycznie aktywne związki karbonylowe typu \(\ce{-CHC=O}\), w których węgiel alfa jest asymetryczny, są racemizowane zarówno przez kwasy, jak i zasady, a z sekcji 17-1 możemy być pewni, że jest to związane z enolizacją. Powstanie enolu lub anionu enolowego zniszczy asymetrię węgla \(\alpha\) tak, że nawet jeśli w danym momencie obecne są tylko śladowe ilości enolu, ostatecznie cały związek zostanie racemizowany. Jednak mechanizm wymaga zarówno, aby istniał\ (\alpha\) Wodór, jak i aby środek symetrii znajdował się w tym \(\alpha\) węglu. W przeciwnym razie kwasy i zasady są nieskuteczne w katalizowaniu racemizacji.
.jpg?revision=1)
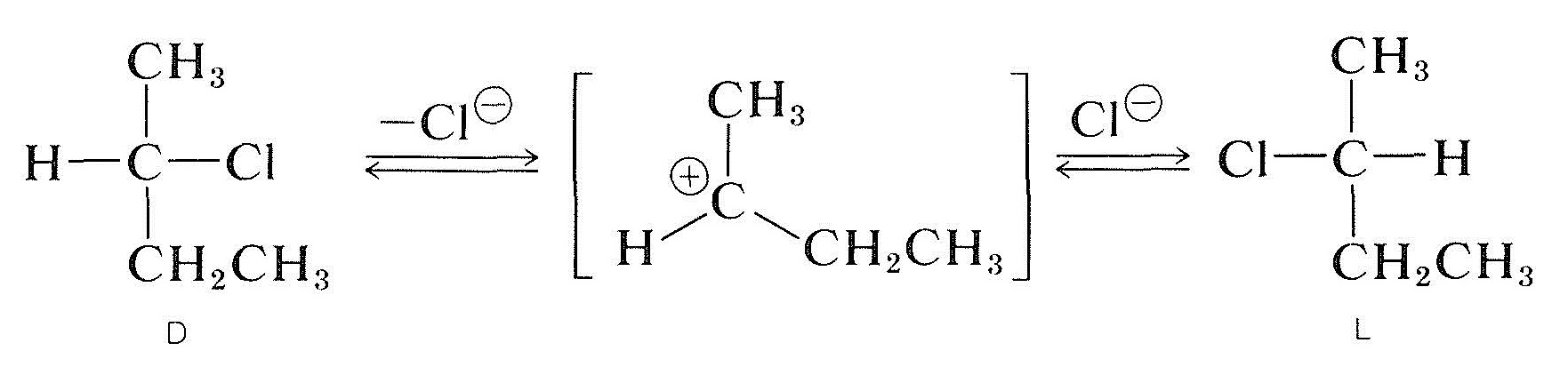
racemizacja optycznie aktywnego halogenku wtórnego z chiralnym węglem przenoszącym halogen (np., 2-chlorobutan) może wystąpić roztwór ih i, zwykle, im bardziej polarny i lepiej jonizujący jest rozpuszczalnik, tym łatwiej substancja jest racemizowana. Jonizacja halogenku przez proces \(S_ \ text{N}1\) prawdopodobnie jest odpowiedzialna, a to z pewnością byłoby promowane przez rozpuszczalniki polarne (sekcja 8-6). Wszystko wskazuje na to, że karbokacja alkilowa po dysocjacji z towarzyszącego jej anionu jest planarna; a gdy taki jon rekombinuje z anionem, ma równe prawdopodobieństwo utworzenia enancjomerów \(D\) i \(l\):
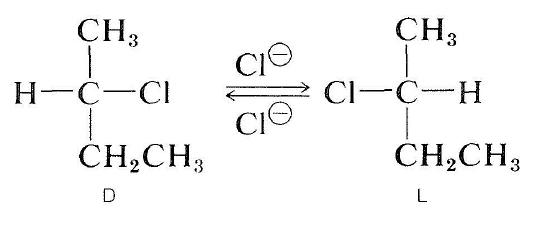
optycznie aktywne halogeny można również racemizować za pomocą mechanizmu \(S_\text{N}2\). Roztwór aktywnego 2-chlorobutanu w 2-propanonie zawierającym rozpuszczony chlorek litu staje się racemiczny. Przemieszczenie chlorku halogenku przez Jon chlorkowy zmienia konfigurację w atomie poddanym podstawieniu (patrz sekcja 8-5). Druga substytucja regeneruje oryginalny enancjomer. Ostatecznie, ten proces tam i z powrotem wytwarza równe liczby form \(D\) i \(L\); substancja jest racemiczna:
Niewątpliwie zachodzi jonizacja, a rekombinacja karbokacji z wodą prowadzi do enancjomeru:
.jpg?revision=1&size=bestfit&width=590&height=243)
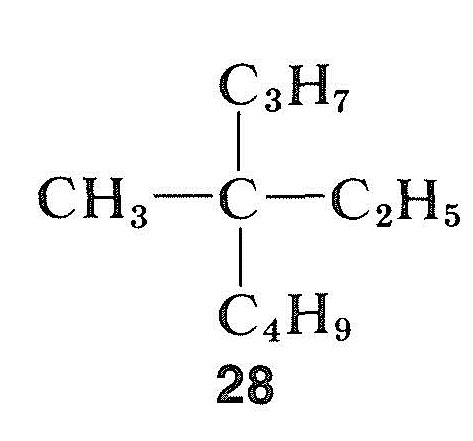
w przeciwieństwie do halogenków, alkoholi i związków karbonylowych węglowodory mogą być niezwykle trudne do racemizacji. Jest to szczególnie prawdziwe w przypadku związku z czwartorzędowym środkiem asymetrycznym, takim jak metyloetylopropylobutylometan, \(28\), który nie ma „uchwytu”, aby umożliwić konwersję asymetrycznego węgla do symetrycznego stanu za pomocą prostych środków chemicznych:
jednak węglowodory, które mają atom wodoru przy asymetrycznym węglu, mogą być racemizowane, jeśli można je przekształcić w karbokacje albo do karbanionów. Łatwość racemizacji typu karbanionowego zależy od kwasowości dołączonego wodoru i stabilności stereochemicznej powstającego pośredniego karbanionu. Jeśli konfiguracja karbanionu pośredniego odwróci się, spowoduje to racemizację (patrz również sekcja 6-4E):
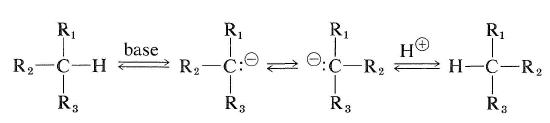
karbokacyjny Typ racemizacji optycznie aktywnego węglowodoru może wystąpić w reakcji wymiany opisanej w sekcji 10-9.
autorzy i atrybuty
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Ta treść jest chroniona prawem autorskim pod następującymi warunkami: „udzielamy zgody na indywidualne, edukacyjne, badawcze i niekomercyjne powielanie, dystrybucję, wyświetlanie i wykonywanie tej pracy w dowolnym formacie.”