7.18: halogenki winylu i halogenki Arylu
podstawienie Nukleofilowe w halogenkach arylu
przyjrzymy się szczegółowo strukturze chlorobenzenu. Bromobenzen i jodobenzen są takie same. Najprostszym sposobem na narysowanie struktury chlorobenzenu jest:
aby poprawnie zrozumieć chlorobenzen, musisz Kop głębiej. Zachodzi interakcja między zdelokalizowanymi elektronami w pierścieniu benzenowym a jedną z samotnych par na atomie chloru. Pokrywa się to z delokalizowanym pierścieniowym układem elektronowym . . .
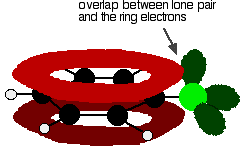
aby nadać strukturę podobną do tej:
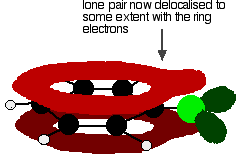
Wiązanie chloru i polaryzacja cząsteczki. Delokalizacja wprowadza pewne dodatkowe wiązanie między węglem a chlorem, dzięki czemu Wiązanie jest silniejsze. Ma to duży wpływ na reakcje związków takich jak chlorobenzen.
istnieje również pewien ruch elektronów z dala od chloru w kierunku pierścienia. Chlor jest dość elektroujemny i zwykle przyciąga elektrony w wiązaniu węgiel-chlor ku sobie. W tym przypadku jest to w pewnym stopniu kompensowane przez ruch elektronów z powrotem w kierunku pierścienia w delokalizacji. Cząsteczka jest mniej polarna niż można by się spodziewać.
proste halogenki arylowe, takie jak chlorobenzen, są bardzo odporne na podstawienie nukleofilowe. Możliwe jest zastąpienie chloru przez-OH, ale tylko w bardzo trudnych warunkach przemysłowych-na przykład w temperaturze 200°C i 200 atmosferach. W laboratorium takie reakcje nie występują. Istnieją dwa powody tego – w zależności od tego, o którym z powyższych mechanizmów mówisz.
- Dodatkowa siła wiązania węgiel-halogen w halogenkach arylu: Wiązanie węgiel-chlor w chlorobenzenie jest silniejsze niż można się spodziewać. Zachodzi interakcja między jedną z samotnych par na atomie chloru a zdelokalizowanymi elektronami pierścienia, co wzmacnia Wiązanie. Oba powyższe mechanizmy obejmują zerwanie wiązania węgiel-halogen na pewnym etapie. Im trudniej jest go złamać, tym wolniejsza będzie reakcja.
- odpychanie przez elektrony pierścieniowe: będzie to miało zastosowanie tylko wtedy, gdy jon wodorotlenku zaatakował chlorobenzen za pomocą mechanizmu podobnego do pierwszego opisanego powyżej. W tym mechanizmie jon wodorotlenku atakuje lekko dodatni węgiel, do którego przyłączony jest atom halogenu.Jeśli atom halogenu jest przyłączony do pierścienia benzenowego, przychodzący jon wodorotlenku będzie miał do czynienia z zdelokalizowanymi elektronami pierścienia powyżej i poniżej tego atomu węgla. Ujemny jon wodorotlenkowy zostanie po prostu odparty. Ten konkretny mechanizm to po prostu nie starter!