Frontiers in Cardiovascular Medicine
wprowadzenie
badając układy współrzędnych, które mogą być używane dla różnych jednostek biologicznych, należy wziąć pod uwagę szczególne cechy. Na przykład liczba chromosomów i pozycja pary zasad tworzą liniowy układ współrzędnych, który jest wystarczający do określenia położenia w genomie referencyjnym (1). Jednak układ współrzędnych dla całego ludzkiego ciała, który może służyć potrzebom HuBMAP, HCA, HPA i innych wysiłków mapowania, jest znacznie bardziej złożony z kilku powodów (2-5). Po pierwsze, komórki żyją w trzech wymiarach; i, dodatkowe informacje są potrzebne do opisania wielkości i orientacji obrotowej każdej próbki tkanki używane do generowania danych. Po drugie, o ile pozycja pary zasad genomu nie zależy od sposobu składania i upakowywania DNA w jądrze, o tyle pozycje poszczególnych elementów (np., komórki, narządy) w ciele są dynamiczne, ponieważ mogą się zmieniać wraz z ruchami szkieletu i mięśni, grawitacją, oddychaniem, biciem serca i innymi funkcjami i siłami, które zniekształcają tkankę. Po trzecie, chociaż zmienność DNA między ludźmi wynosi <1%, geometria ludzkiego ciała obejmuje szeroki zakres wysokości, wagi i kształtów, które różnią się w zależności od płci i rasy i zmieniają się znacząco w ciągu życia danej osoby.
jedną z opcji jest użycie kartezjańskiego układu współrzędnych 3D do opisania pozycji w ciele. Kartezjańskie układy współrzędnych mają tę zaletę, że są znane i łatwo zrozumiałe. Z ciałem w standardowej pozycji anatomicznej, lewo-prawo, ogonowo-czaszkowy i tylno-przedni tworzą trzy prostopadłe (x-y-z) osie. W przypadku analiz na mniejszą skalę, centrowanie pochodzenia na punkcie anatomicznym może być najbardziej przydatne i potencjalnie mniej zmienne między różnymi ludźmi. Na przykład łatwiej byłoby zmierzyć odległość próbki tkanki od nerki do górnego bieguna nerki niż do czubka głowy danej osoby. Wadą współrzędnych kartezjańskich jest to, że ich osie nie odpowiadają naturalnemu kształtowi ciała. W rezultacie stworzenie referencyjnej mapy ciała poprzez cyfrowe „zszywanie” próbek tkanek pobranych od osób o różnych rozmiarach wymagałoby złożonego procesu wypaczania, obracania i wyrównywania danych. Robienie tego w sposób, który skaluje się do całego ciała, zachowując precyzję na poziomie komórkowym, byłoby niezwykle trudne.
inne układy współrzędnych 3D zostały opracowane dla różnych zastosowań. Na przykład współrzędne sferyczne, z osiami reprezentującymi szerokość, długość i wysokość, wygodnie opisują położenie na powierzchni Ziemi. Prosta ścieżka we współrzędnych sferycznych, np. „1 km na wschód”, jest znacznie trudniejsza do komunikowania za pomocą współrzędnych kartezjańskich. Podobnie, układy współrzędnych dla ludzkiego ciała powinny idealnie mieć osie, które podążają za strukturami anatomicznymi, wzorcami ekspresji genetycznej, gradientami chemicznymi i/lub innymi biologicznie istotnymi ścieżkami. Opracowano kilka specyficznych dla organów układów współrzędnych, takich jak współrzędne Talairacha do obrazowania czynnościowego mózgu, ale nie obejmują one całego ciała (6).
układ współrzędnych oparty na naczyniach
w 2017 r.wspólne spotkanie w ramach współrzędnych (CCF) zostało zorganizowane przez Narodowe Instytuty Zdrowia, Broad Institute, Instytut Sangera i inicjatywę Chan Zuckerberg. Uczestnicy spotkania, w tym anatomowie, patolodzy, klinicyści i eksperci technologiczni z całego świata, zaproponowali kilka podejść do mapowania komórek ludzkiego ciała, w tym anatomicznie oparte układy współrzędnych (7). Jeden z nich, który wykorzystuje unaczynienie, został następnie omówiony na warsztatach CCF 2019, specjalnie do lokalizacji komórek nerek (8). W tym manuskrypcie przedstawiamy koncepcyjny przegląd tego układu współrzędnych naczyniowych i opisujemy jego zalety i ograniczenia (ryc. 1).
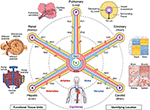
Rysunek 1. Struktura układu współrzędnych naczyniowych. Układ współrzędnych naczyniowych składa się z reprezentatywnych pętli naczyń, które rozpoczynają się i kończą w komorach serca i rozciągają się na jednostki funkcjonalne każdego narządu (w lewo od lewego górnego rogu: pęcherzyki płucne, kłębuszki i zrazy wątrobowe). „Adres” komórki zawiera nazwę pętli (np. „R” dla nerek i „H” dla wątroby) oraz stopień rozgałęzienia najbliższego naczynia (np. „RA1” dla tętniczek aferentnych w pętli nerkowej). Zauważ, że ściany serca leżą wzdłuż wieńcowej („C”) pętli naczyniowej, a komórki niektórych struktur wewnętrznych serca są faktycznie umieszczone na obrzeżach układu współrzędnych, w pobliżu naczyń włosowatych, które dostarczają im krwi. Istnieje wiele sposobów, aby wskazać jeszcze bardziej precyzyjną pozycję „podobną do GPS”, w tym, idąc zgodnie z ruchem wskazówek zegara z prawej górnej części,” odcisk palca niedotlenienia”, który wynika z obniżenia poziomu tlenu dalej od naczynia, unikalny” odcisk palca histologicznego „i” odcisk ekspresji genu „w różnych typach naczyń śródbłonka komórkowego oraz charakterystyczny” odcisk palca architektury naczyniowej ” występujący w różnych typach tkanek. Unaczynienie rozciąga się na wszystkie części ciała (dół) i oprawia wszystkie narządy we wszystkich skalach. Pliki Źródłowe: Zdjęcia z lobules, glomeruli, pęcherzyków płucnych, mapy termicznej ekspresji genów i naczyń całego ciała są adaptowane z Wikimedia Commons: https://commons.wikimedia.org/wiki/File:2423_Microscopic_Anatomy_of_Liver.jpg (domena publiczna); https://commons.wikimedia.org/wiki/File:Juxtaglomerular_Apparatus_and_Glomerulus.jpg (licencja CC BY 3.0); https://commons.wikimedia.org/wiki/File:Alveolus_diagram.svg (domena publiczna); https://commons.wikimedia.org/wiki/File:Iris_dendrogram.png (licencja CC BY-SA 4.0); oraz https://commons.wikimedia.org/wiki/File:Circulatory_System_en.svg (domena publiczna). Mapa ciepła ekspresji genów odtworzona z Guo et al. (9) korzystanie z symulowanych danych. Architektura naczyniowa na podstawie Bosetti et al. (10) (licencja CC BY 4.0).
celem układu współrzędnych naczyniowych nie jest zbudowanie mapy naczyń. Chodzi raczej o wykorzystanie znanych dróg naczyniowych przez ciało jako osi w układzie współrzędnych, która może opisywać położenie elementów anatomicznych, takich jak komórki,w tkance otaczającej naczynie. W proponowanych ramach, komory serca mogą być postrzegane jako początek w mapie całego ciała. Oś naczyniowa zawiera pętle naczyniowe (porównywalne z „drogami” w metaforze Mapy Google), które rozciągają się przez aortę lub tętnicę płucną, stopniowo zwężają się do wielkości pojedynczej komórki, gdy zbliżają się do każdej innej komórki w każdym narządzie ciała i wracają do serca. Wzdłuż tych szlaków unaczynienie podąża za unikalną biologią różnych narządów i tkanek; podobnie narządy i tkanki ciała nie mogłyby istnieć bez unikalnych właściwości ich ściśle zintegrowanej unaczynienia.
tak jak mapa genomu rozwija DNA w liniową sekwencję, możemy sobie wyobrazić rozkładanie złożonych 3D zakrętów i zakrętów osi naczyń w prostszy 2D kształt „piasty i szprychy” z komorami serca w centrum. Ta schematyczna reprezentacja naczyń ułatwia (1) opisanie lokalizacji w ciele; (2) wyrównanie szlaków naczyniowych o różnych kształtach 3D, ale równoważnej funkcji od różnych osób; (3) identyfikowanie wzorców, takich jak zmiany typu komórki i ekspresji genów, gdy jeden przechodzi z większych do mniejszych naczyń w obrębie narządu (wzdłuż szprychy); i (4) porównaj tkankę na tym samym poziomie (np. naczynia włosowate) w różnych narządach (w poprzek szprych).
narząd, taki jak nerka, ma dziesiątki tysięcy dróg unaczynienia, jeśli każda kapilara jest uważana za wyraźną. Jednakże, aby Budowa CCF była wykonalna, podejmiemy dodatkowe uproszczenie, że wiele z tych ścieżek jest nie do odróżnienia od siebie. Należy zauważyć, że najmniejsze naczynia (naczynia włosowate) znajdują się w centrum małych wyspecjalizowanych jednostek funkcjonalnych w każdym narządzie (np., lobules wątrobowych w wątrobie, kłębuszków nerkowych i pęcherzyków płucnych). Cały narząd wymaga wielu z tych jednostek funkcjonalnych skoncentrowanych na naczyniach, które są anatomicznie i fizjologicznie podobne (11). Podobieństwo to można wykorzystać do rozpadu licznych dróg naczyniowych na kilka reprezentatywnych (ryc. 2). W przyszłości, gdy dowiemy się więcej o profilach biomolekularnych tych ścieżek, możemy udoskonalić CCF, dzieląc ścieżki na dowolne odkryte podtypy.

Rysunek 2. Rozkłada szlak naczyń nerkowych do poziomu pojedynczych komórek. Reprezentatywny szlak naczyniowy wchodzi do nerki przez tętnicę nerkową, przechodzi przez kłębuszek nerkowy i powraca do żyły nerkowej. Na makroskali (po lewej) i mezoskali (w środku) etykiety w żółtych polach są strukturami anatomicznymi, które odpowiadają różnym naczyniom wzdłuż tej pętli. W mikroskopie (po prawej), etykiety w żółtych polach są różne rodzaje komórek, które znajdują się w niewielkiej odległości od pobliskiego naczynia w kłębuszku. Położenie poszczególnych komórek można opisać za pomocą adresu najbliższego statku (np.”RA0″ dla kłębuszków włosowatych), odległość w mikrometrach lub liczba komórek od śródbłonka naczynia i kąt prostopadły do długości naczynia (np. „RA0-10 µm-135°” lub „RA0-1c-135°”). Po prawej stronie każde naczynie i otaczająca je tkanka zostały wyodrębnione z oryginalnego obrazu i ustawione pionowo, aby ułatwić obserwację zmian typów komórek i ich dystrybucji wzdłuż ścieżki naczyniowej. W tym przykładzie wyrównane obrazy również zostały obrócone tak, że środek kłębuszka jest zawsze po prawej stronie. Pliki Źródłowe: Zdjęcia nerek i kłębuszków są adaptowane z Wikimedia Commons: https://commons.wikimedia.org/wiki/File:KidneyStructures_PioM.svg (licencja CC BY 3.0); oraz https://commons.wikimedia.org/wiki/File:Renal_corpuscle-en.svg (licencja CC BY-SA 4.0).
„adres” pojedynczej komórki w układzie współrzędnych naczyniowych składa się z czterech elementów. (1) pierwszy jest najbliższym anatomicznie nazwanym naczyniem, które najbardziej precyzyjnie identyfikuje pętlę naczyniową (terytorium naczyniowe lub „dział wodny”), taką jak tętnica nerkowa prawa. (2) następny element reprezentuje poziom rozgałęzienia statku. W nerce, przykłady od bliższego do dystalnego obejmują tętnice międzyzębowe, tętnice promieniowe korowe, tętnice aferentne i kłębuszkowe naczynia włosowate. Poziom rozgałęzień można również zdefiniować numerycznie, z kapilarami na poziomie zerowym, a wyższymi z większymi liczbami. (3) trzecim składnikiem jest odległość prostopadła w mikrometrach lub liczba komórek od warstwy śródbłonka naczynia. (4) opcjonalnym czwartym elementem może być kąt obrotu prostopadły do długości naczynia. Stopnie zerowe można definiować na wiele sposobów w zależności od zastosowania. Na przykład, może być w stosunku do markera na próbce tkanki, lub może wskazywać w kierunku struktury anatomicznej, takich jak Centrum najbliższego kłębuszków nerkowych. Użyteczność i zapotrzebowanie na te komponenty musiałyby zostać potwierdzone eksperymentalnymi testami.
innym podejściem jest użycie komórek śródbłonka jako „komórek zakotwiczających” w celu identyfikacji względnych pozycji innych komórek w sposób podobny do GPS. Śródbłonek łączy całe naczynie. Różne typy komórek śródbłonka (EC) pojawiają się w różnych częściach naczyń, które można wykryć histologicznie poprzez unikalne cechy komórek i sąsiednie komórki („histologiczny odcisk palca”), jak również poprzez analizę ich specyficznych profili genowych („odcisk palca ekspresji genu”, ryc. 1 mapa cieplna) (9, 12, 13). Naczyniowy wzór organizacyjny, złożoność rozgałęzień, średnica itp. zapewnij dodatkowe rozpoznawalne cechy, które tworzą „odcisk palca architektury naczyniowej” dla każdej tkanki (ryc. 1 fałszywie kolorowe fluorescencyjne obrazy naczyń) (10, 14). Każda tkanka ma określone gradienty tlenu,które mogą być wykorzystane do określenia odległości od naczynia. Gdy PO2 nie może być zmierzony bezpośrednio, można wnioskować o odległości komórki od gradientów indukcji / ekspresji genów indukowanych hipoksją w różnych typach komórek („odcisk palca hipoksji”, ryc. 1 widok poprzeczny naczynia) (15-17).
korzyści płynące z CCF naczyniowego
układ współrzędnych naczyniowych ma sens biologicznie. Każda żywa komórka musi znajdować się w małym promieniu najbliższego naczynia krwionośnego (100 µm do 1 mm, w zależności od tkanki), aby otrzymać tlen (18); i każde naczynie jest wyłożone tą samą ciągłą warstwą śródbłonka (19). W ten sposób unaczynienie tworzy nieprzerwaną ścieżkę, która dociera do wszystkich części ciała, płynnie zwężając się w różnych skalach, od skali makroskali (całe ciało/kliniczne) do mezoskali do mikroskopu (naczynia włosowate o pojedynczej wielkości komórki). W ramach tego, obsługuje stopniowe przejście od dużych tętnic i żył, które są zachowane u większości ludzi, do milionów mikroskopijnych naczyń, które są rozpoznawalne według kategorii (np. kłębuszków włosowatych), ale nie według indywidualnych nazw. Układ naczyniowy dostosowuje się do indywidualnej wielkości i kształtu ciała, uwzględniając różnice międzyosobnicze (20, 21). Określa kształt jednostek funkcjonalnych w różnych narządach, takich jak zranienia wątroby, kłębuszki nerkowe i pęcherzyki płucne. Prawidłowy rozwój nowej tkanki rozpoczyna się od utworzenia naczynia, zanim wokół niego mogą rosnąć dodatkowe typy komórek (22).
układ naczyniowy dociera również do wszystkich narządów, tkanek i komórek w sposób ciągły. Inne struktury anatomiczne nie wydają się mieć podobnej wszechstronności. Na przykład układ kostny rozciąga się na całe ciało; jednak odległość od komórki w narządzie do najbliższej kości może wynosić kilka centymetrów, a ta kość jest mało prawdopodobne, aby była częścią narządu, a jeszcze mniej prawdopodobne, aby była częścią próbki tkanki. Układ nerwowy podąża wieloma tymi samymi ścieżkami, co większe naczynia o właściwościach kurczliwych, ale nie wiadomo, czy rozciągają się one w ślad za mniejszymi naczyniami, które docierają do wszystkich komórek tkanki. Tak więc, w przeciwieństwie do zależności komórek od tlenu, nie ma gwarancji, że każda komórka znajduje się w pobliżu nerwu. Specyficzne dla danego narządu systemy odniesienia opierają się na unikalnych cechach strukturalnych, które istnieją tylko w tym pojedynczym narządzie (np. określonych regionach mózgu) i są mało prawdopodobne, aby były użyteczne do reprezentowania lokalizacji komórek w innych częściach ciała.
istnieje wiele praktycznych zalet układu współrzędnych naczyniowych. Szlaki naczyniowe we wszystkich narządach zostały szeroko przebadane i szczegółowo opisane w literaturze. Są one przydatne, dobrze znane i mają znormalizowane nazwy w wielu dziedzinach specjalistycznych. Wzorce unaczynienia tkanek są wykorzystywane klinicznie do diagnozowania choroby; naczynia są wykorzystywane w chirurgii i biopsji jako główne punkty anatomiczne i do definiowania „terytoriów naczyniowych” (23, 24). Chociaż dokładna pozycja w przestrzeni kartezjańskiej 3D może być trudna do określenia dla wyciętej próbki tkanki, chirurg Zazwyczaj będzie w stanie wskazać, który dział naczyniowy zawierał próbkę.
ograniczenia naczyniowego CCF
tylko znajomość par zasad w sekwencji genomu nie dostarcza wystarczających informacji, aby określić, w jaki sposób DNA jest składane w danej komórce. Podobnie, chociaż rozłożony układ współrzędnych naczyniowych może opisywać trójwymiarową zależność przestrzenną pobliskich komórek w mikroskopie, tracone są kręte ścieżki, które przyjmują naczynia i względna odległość między komórkami w większych skalach. Informacje na temat struktur o większej skali można uzyskać poprzez zintegrowanie obrazowania klinicznego i wzorców histologicznych i molekularnych.
niektóre dodatkowe informacje pozycyjne są tracone przez zapadanie się dróg naczyniowych. Na przykład naczyniowy układ współrzędnych może początkowo traktować wszystkie kłębuszki włosowate w nerkach jako tę samą strukturę, potencjalnie maskując różnice w kłębuszkach na górnych i dolnych biegunach nerek. Jednak, gdy dowiadujemy się więcej o profilach biomolekularnych tych ścieżek, możemy iteracyjnie udoskonalić CCF naczyniowe w czasie, dzieląc ścieżki na dowolne odkryte podtypy.
pomimo tych ograniczeń, układ współrzędnych naczyniowych zachowuje wystarczającą ilość informacji pozycyjnych, aby odpowiedzieć na wiele rodzajów pytań badawczych, umożliwiając naukowcom precyzyjną lokalizację poszczególnych komórek w jednostkach funkcjonalnych, tkankach i narządach lub porównując wpływ kontekstu na różne typy komórek w całym ciele w skali makro – i mezo – skale.
kolejne kroki i przyszłe kierunki
na rysunku 1 Przedstawiamy bardzo uproszczoną i stylizowaną reprezentację CCF naczyniowego w celu wprowadzenia ogólnej koncepcji. Rzeczywiste ścieżki naczyniowe są znacznie bardziej złożone, z pełnym naczyniowym CCF ostatecznie składającym się z setek lub tysięcy struktur, a także rozgałęzień, które nie podążają za ścisłym układem piasty i szprychy. Na przykład żyły w wątrobowym układzie wrotnym, które przenoszą krew z wielu narządów do wątroby, i zespolenia krążenia, takie jak okrąg Willisa w mózgu, biegłyby prostopadle do „szprych” i przecinały je na rysunku 1.
naczyniowy CCF będzie również musiał zawierać normalne warianty anatomiczne naczyń, takie jak thyroidea ima i podwójne tętnice torbielowate, w taki sam sposób, w jaki polimorfizmy pojedynczego nukleotydu (SNPs) opisują normalne zmiany w genomie. Gdy rozszerzamy i uzupełniamy szczegóły naczyniowego CCF, może on przybrać bardziej płatkowy lub webowy wygląd, z prawdopodobieństwem przypisanym do różnych sekcji, aby wskazać prawdopodobieństwo ich znalezienia u danej osoby.
rzeczywisty CCF naczyniowy będzie wymagał bardziej wyrafinowanego schematu kodowania nazw naczyń niż pokazano na rysunku 1, aby dokładniej przedstawić jego złożoność i uczynić go” obliczeniowym ” przez algorytmy programowe. Jednym z podejść jest budowanie na istniejących ontologiach anatomicznych, takich jak UBERON, który zawiera już unikalne Uniform Resource Identifiers (URI) dla wielu statków i definiuje różne typy relacji, takie jak „branching_part_of”, aby opisać, w jaki sposób statki łączą się (25).
komórka może znajdować się w pobliżu więcej niż jednego statku, w takim przypadku możliwe jest przypisanie jej osobnego adresu względem każdego statku. Potrzebne są przyszłe badania, aby określić, jaka powinna być odpowiednia odległość „odcięcia”. Może być pożądane przechowywanie wielu adresów dla komórek, aby ułatwić triangulację ich pozycji w przestrzeni 3D.
chociaż naszą początkową motywacją dla CCF naczyniowego jest zdefiniowanie układu współrzędnych do określania lokalizacji komórek, nowatorski układ promieniowy ciała ludzkiego wokół naczynia krwionośnego, jak pokazano na fig. 1, może mieć inne zastosowania naukowe. Na przykład, informacje pozycyjne w tych ramach mają analogie do rozwoju embriologicznego i mogą dostarczyć wglądu w mechanizmy, które powodują choroby lub dysregulacje, które wynikają z grupy komórek. Na przykład w naczyniowym CCF, makroangiologiczne choroby związane z cukrzycą typu 2 (np. choroba niedokrwienna serca, choroba naczyń obwodowych i choroba naczyń mózgowych) są skupione w pobliżu centrum, podczas gdy mikronaczyniowe choroby (np. retinopatia, nefropatia i neuropatia) tworzą pierścień wokół zewnątrz (26).
podsumowanie
układ naczyniowy ma kilka właściwości, które odpowiadają cechom wcześniej uznawanym za pożądane dla CCF, aby umożliwić mapowanie wszystkich komórek w organizmie człowieka (7). (1) działa w kilku skalach. Poprzez ciągły śródbłonek dokonuje płynnego przejścia od dużych struktur anatomicznych do poziomu komórkowego. (2) ma zastosowanie do wszystkich tkanek ciała. Ponieważ organy rozwijają się wokół naczyń, unaczynienie ramuje architekturę organów we wszystkich skalach. Wzory naczyniowe są tak charakterystyczne, że obrazy samych naczyń, z usuniętymi wszystkimi innymi komórkami, można łatwo wykorzystać do identyfikacji narządu. (3) uwzględnia różnice między dawcami. Unaczynienie naturalnie dostosowuje się do indywidualnych zmian w tkance, wielkości i kształtu ciała. Zamiast mapować współrzędne 3D każdego kłębuszka u jednej osoby do tych u innej osoby, naczyniowy CCF umieszczałby każdą komórkę w reprezentatywnej kłębuszku kapilarnym od każdej osoby. (4) unaczynienie jest dobrze znane praktykom wielu różnych specjalności klinicznych, pomagając zarówno w diagnozowaniu choroby, jak i prowadzeniu operacji, i jest wykorzystywane jako punkty orientacyjne przez patologów, radiologów i innych klinicystów. Ułatwiłoby to pozycjonowanie próbek tkanek w organizmie i rejestrowanie lokalizacji poszczególnych komórek. Chociaż żaden pojedynczy CCF nie jest idealny do wszystkich zastosowań, naczyniowy CCF definiuje naturalny układ współrzędnych, który ułatwiłby łączenie danych biomolekularnych od wielu osób i zadawanie biologicznie istotnych pytań badawczych.
Oświadczenie o dostępności danych
w tym badaniu przeanalizowano publicznie dostępne zbiory danych. Dane te można znaleźć tutaj: https://www.proteinatlas.org.
wkład autora
GW opracowała to badanie w oparciu o raporty ze spotkania CCF 2017 i warsztatów CCF 2019. KB i YJ dostarczyły krytyczne informacje zwrotne. GW napisał wstępny szkic, z dodatkowym tekstem przepisanym z prezentacji slajdów CCFWS-01. Do edycji manuskryptu przyczynili się wszyscy autorzy.
finansowanie
to badanie zostało wsparte przez National Institutes of Health (NIH) award OT2OD026671. Praca ta nie reprezentuje opinii NIH ani Narodowego Instytutu Serca, Płuc i krwi (NHLBI).
konflikt interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
dziękujemy Dr Zorinie S. Galis z National Institutes of Health za pomoc w rozwijaniu idei układu współrzędnych naczyniowych na spotkaniu CCF 2017 i warsztatach CCF 2019, dostarczając nam Prezentacji z tych wydarzeń i uczestnicząc w licznych dyskusjach, które stanowiły podstawę tego rękopisu. Komentarze ekspertów recenzentów pomogły wyjaśnić i uszczegółowić proponowany wspólny układ współrzędnych oparty na naczyniach.
3. Uhlén m, Björling e, Agaton C, Szigyarto CA, Amini B, Andersen E, et al. Atlas białek ludzkich dla tkanek normalnych i nowotworowych oparty na proteomice przeciwciał. Proteomika Komórek Mol. (2005) 4:1920–32. 10.1074 / mcp.M500279-MCP200
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Vanlandewijck m, He L, Mäe MA, Andrae J, Ando K, Del Gaudio F, et al. A molecular atlas of cell types and zonation in the brain vasculature. Natura. (2018) 554:475–80. doi: 10.1038/nature25739
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Johnson C, Sung HJ, Lessner SM, Fini ME, Galis ZS. Matrix metalloproteinase-9 is required for adequate angiogenic revascularization of ischemic tissues: potential role in capillary branching. Circ Res. (2004) 94:262–8. doi: 10.1161/01.RES.0000111527.42357.62
PubMed Abstract | CrossRef Full Text | Google Scholar
15. De Santis V, Singer M. tissue oxygen tension monitoring of organ perfusion: rationale, methodologies, and literature review. Br J Anaesth. (2015) 115:357–65. doi: 10.1093/bja/aev162
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Koch CJ. Pomiar bezwzględnego poziomu tlenu w komórkach i tkankach za pomocą czujników tlenu i 2-nitroimidazolu EF5. Metody Enzymol. (2002) 352:3–31. doi: 10.1016/S0076-6879(02)52003-6
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Paruchuri V, Salhab KF, Kuzmik G, Gubernikoff G, Fang H, Rizzo JA, et al. Aortic size distribution in the general population: explaining the size paradox in aortic dissection. Cardiology. (2015) 131:265–72. doi: 10.1159/000381281
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Abadi e, Segars WP, Sturgeon GM, Roos JE, Ravin CE, Samei E. modelowanie architektury płuc w serii fantomów XCAT: fizjologicznie oparte drogi oddechowe, tętnice i żyły. IEEE Trans Med Imaging. (2018) 37:693–702. doi: 10.1109 / TMI.2017.2769640
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Majno P, Mentha G, Toso C, Morel P, Peitgen HO, Fasel JH. Anatomia wątroby: zarys z trzema poziomami złożoności-kolejny krok w kierunku dostosowanych terytorialnych resekcji wątroby. J Hepatol. (2014) 60:654–62. doi: 10.1016/j.jhep.2013.10.026
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Cade WT. Diabetes-related microvascular and macrovascular diseases in the physical therapy setting. Phys Ther. (2008) 88:1322–35. doi: 10.2522/ptj.20080008
PubMed Abstract | CrossRef Full Text | Google Scholar