Refissa
nazwa ogólna: tretinoina
postać dawkowania: krem
Drugs.com. Ostatnia aktualizacja: 1 kwietnia 2020 r.
- przegląd
- skutki uboczne
- dawkowanie
- profesjonalne
- interakcje
- Więcej
do stosowania miejscowego tylko na twarz.
- Refissa opis
- Refissa – Farmakologia kliniczna
- wskazania i zastosowanie dla Refissa
- dane z badań klinicznych
- przeciwwskazania
- Ostrzeżenia
- środki ostrożności
- ogólne
- informacje dla pacjentów
- interakcje z innymi lekami
- Karcynogeneza, mutageneza, upośledzenie płodności
- ciąża
- ciąża Kategoria C
- matki karmiące
- stosowanie u dzieci
- stosowanie w podeszłym wieku
- działania niepożądane
- przedawkowanie
- Refissa Dawkowanie i sposób podawania
- jak jest dostarczany Refissa
- Przechowywanie
- główny panel wyświetlacza-karton tubowy 40 g
- więcej o Refissa (tretinoina miejscowa)
- zasoby konsumenckie
- zasoby profesjonalne
- powiązane poradniki leczenia
Refissa opis
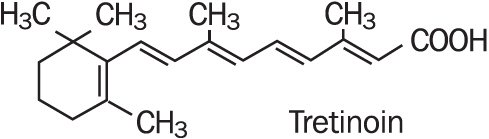
Refissa , zawiera substancję czynną tretinoinę (retinoid) w zmiękczającej bazie kremu. Tretinoina jest żółtym do pomarańczowego krystalicznym proszkiem o charakterystycznym kwiatowym zapachu. Tretinoina jest rozpuszczalna w dimetylosulfotlenku, słabo rozpuszczalna w glikolu polietylenowym 400, oktanolu i 100% etanolu. Jest praktycznie nierozpuszczalny w wodzie i oleju mineralnym, a także jest nierozpuszczalny w glicerynie. Nazwa chemiczna tretynoiny to kwas(all-e)-3,7-dimetylo-9-(2,6,6-trimetylo-1-cykloneksen-1-ylo)-2,4,6,8-nonatetraenowy. Tretinoina jest również określana jako kwas all-trans-retinowy i ma masę cząsteczkową 300,44. Wzór strukturalny przedstawiono poniżej.
Refissa zawiera tretinoinę w stężeniu 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.
Refissa – Farmakologia kliniczna
dokładny mechanizm działania tretinoiny nie jest znany, chociaż uważa się, że retinoidy wywierają wpływ na wzrost i różnicowanie różnych komórek nabłonka. Po zastosowaniu miejscowym nie stwierdzono jednak wzrostu stężenia desmozyny, hydroksyproliny ani mRNA elastyny w ludzkiej skórze. Ponadto rola drażniącego charakteru tego produktu w wywoływaniu pozytywnych skutków przypisywanych temu produktowi w celu jego wskazania nie została jeszcze w pełni określona.
wchłanianie przezskórne tretynoiny z różnych preparatów do stosowania miejscowego wynosiło od 1% do 31% zastosowanej dawki, w zależności od tego, czy była stosowana na zdrową skórę, czy na skórę skórną. W przypadku oceny przezskórnego wchłaniania kremu tretinoiny, USP (zmiękczającego) 0,05% u zdrowych mężczyzn (N=14) po pojedynczym podaniu, jak również po wielokrotnym codziennym stosowaniu przez 28 dni, wchłanianie tretinoiny było mniejsze niż 2%, a endogenne stężenia tretinoiny i jej głównych metabolitów były niezmienione.
wskazania i zastosowanie dla Refissa
(aby w pełni zrozumieć wskazania dla tego produktu, przeczytaj całą sekcję wskazania i zastosowanie na etykiecie.)
Refissa jest wskazany jako środek wspomagający (patrz drugi punkt poniżej) do stosowania w łagodzeniu (łagodzeniu) drobnych zmarszczek, przebarwień plamistych i szorstkości dotykowej skóry twarzy u pacjentów, którzy nie osiągają takiego łagodzenia przy użyciu kompleksowych programów pielęgnacji skóry i unikania słońca (patrz punkt 3 dla populacji, w których skuteczność nie została ustalona). Refissa nie usuwa zmarszczek, nie naprawia uszkodzonej przez słońce skóry, nie odwraca fotostarzenia ani nie przywraca młodzieńczego lub młodszego wzorca histologicznego skóry. Wielu pacjentów osiąga pożądany efekt paliatywny na drobne zmarszczki, plamiste przebarwienia i szorstkość dotykową skóry twarzy za pomocą kompleksowych programów pielęgnacji skóry i unikania Słońca, w tym filtrów przeciwsłonecznych, odzieży ochronnej i kremów zmiękczających niezawierających tretinoiny.
- krem Tretinoinowy, USP (zmiękczający) 0.05% nie wykazało łagodzącego wpływu na znaczące oznaki przewlekłej ekspozycji na słońce, takie jak grube lub głębokie zmarszczki, zażółcenie skóry, soczewica, teleangiektazja, wiotkość skóry, atypia keratynocytowa, atypia melanocytowa lub elastoza skórna.
- Refissa powinna być stosowana pod nadzorem lekarza jako uzupełnienie kompleksowego programu pielęgnacji skóry i unikania słońca, który obejmuje stosowanie skutecznych filtrów przeciwsłonecznych (minimun SPF 15) i odzieży ochronnej, gdy pożądane rezultaty na drobne zmarszczki, plamiste przebarwienia i szorstkość skóry twarzy nie zostały osiągnięte dzięki kompleksowemu programowi pielęgnacji skóry i unikania słońca.
- skuteczność Refissa w łagodzeniu drobnych zmarszczek, cętkowanej przebarwień i dotykowej szorstkości skóry twarzy nie została ustalona u osób w wieku powyżej 50 lat lub u osób z umiarkowanie lub mocno pigmentowaną skórą. Ponadto pacjenci z widocznym rogowaceniem słonecznym i pacjenci z rakiem skóry w wywiadzie zostali wykluczeni z badań klinicznych kremu Tretinoin USP (zmiękczającego) 0,05%. Z tego względu skuteczność i bezpieczeństwo stosowania produktu leczniczego Refissa w tych populacjach nie są obecnie znane.
- nie ustalono bezpieczeństwa ani skuteczności produktu leczniczego Refissa w zapobieganiu lub leczeniu rogowacenia słonecznego lub nowotworów skóry.
- nie określono ani bezpieczeństwa stosowania, ani skuteczności stosowania produktu leczniczego Refissa codziennie przez okres dłuższy niż 48 tygodni, a codzienne stosowanie produktu leczniczego dłużej niż 48 tygodni nie było systematycznie i histologicznie badane w odpowiednich i dobrze kontrolowanych badaniach. (Patrz sekcja Ostrzeżenia.)
dane z badań klinicznych
przeprowadzono dwa odpowiednie i dobrze kontrolowane badania z udziałem łącznie 161 ocenianych pacjentów (w wieku poniżej 50 lat) leczonych kremem Tretinoin, USP (emolient) 0,05% i 154 ocenianych pacjentów leczonych kremem zmiękczającym podłoże Na twarz przez 24 tygodnie jako uzupełnienie kompleksowego programu pielęgnacji skóry i unikania Słońca, w celu oceny wpływu na drobne zmarszczki, plamiste przebarwienia i dotykowa szorstkość skóry. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | redukcja o 2 jednostki lub więcej |
w tych badaniach uważano, że drobne zmarszczki, cętkowane przebarwienia i chropowatość dotykowa skóry twarzy były spowodowane przez wiele czynników, które obejmowały wewnętrzne starzenie się lub czynniki środowiskowe, takie jak przewlekła ekspozycja na słońce.
wyniki tych ocen są następujące:
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| pojazd + CSP | 67% | 23% | 10% |
większość poprawy tych objawów odnotowano w ciągu pierwszych 24 tygodni leczenia. Następnie leczenie utrzymywało przede wszystkim poprawę osiągniętą w ciągu pierwszych 24 tygodni.
większość pacjentów straci najbardziej łagodzące skutki Refissa na drobne zmarszczki, plamistą przebarwienia i dotykową szorstkość skóry twarzy z przerwaniem kompleksowego programu pielęgnacji skóry i unikania Słońca, w tym Refissa; jednak Bezpieczeństwo i skuteczność stosowania Refissa codziennie przez ponad 48 tygodni nie zostały ustalone.
przeciwwskazania
ten lek jest przeciwwskazany u osób z reakcjami wrażliwymi w wywiadzie na którykolwiek z jego składników. W przypadku stwierdzenia nadwrażliwości na którykolwiek ze składników preparatu należy przerwać jego stosowanie.
Ostrzeżenia
- Refissa Działa drażniąco na skórę, a wyniki ciągłego podrażnienia skóry przez ponad 48 tygodni w przewlekłym długotrwałym stosowaniu nie są znane. Istnieją dowody na nietypowe zmiany w melanocytach i keratynocytach oraz zwiększoną elastozę skóry u niektórych pacjentów leczonych kremem Tretinoin, USP (zmiękczający) 0,05% Przez okres dłuższy niż 48 tygodni. Znaczenie tych odkryć nie jest znane.
- Bezpieczeństwo i skuteczność produktu Refissa u osób z umiarkowanie lub mocno zabarwioną skórą nie zostały ustalone.
- leku Refissa nie należy podawać, jeśli pacjent przyjmuje również leki, o których wiadomo, że działają fotouczulająco (np. tiazydowe leki moczopędne, tetracykliny, fluorochinolony, fenotiazyny, sulfonamidy) ze względu na możliwość nasilonej fototoksyczności.
ze względu na zwiększoną podatność na pieczenie, podczas stosowania produktu Refissa należy unikać lub minimalizować ekspozycję na światło słoneczne (w tym lampy słoneczne). Pacjentów należy ostrzec, aby używali filtrów przeciwsłonecznych (minimum SPF 15) i odzieży ochronnej podczas stosowania leku Refissa. Pacjentom z oparzeniami słonecznymi należy zalecić, aby nie stosowali produktu Refissa do czasu całkowitego wyzdrowienia. Pacjenci, którzy mogą mieć znaczną ekspozycję na słońce, np. ze względu na zawód oraz pacjenci z wrodzoną wrażliwością na światło słoneczne, powinni zachować szczególną ostrożność podczas stosowania produktu Refissa i zapewnić przestrzeganie środków ostrożności opisanych w ulotce dla pacjenta.
krem Tretinoin, USP (zmiękczający) 0,05% należy trzymać z dala od oczu, ust, kątów nosa i błon śluzowych. Stosowanie miejscowe może powodować silny miejscowy rumień, świąd, pieczenie, pieczenie i łuszczenie w miejscu podania. Jeśli uzasadnia to stopień miejscowego podrażnienia, pacjenci powinni być skierowani do stosowania mniejszej ilości leków, zmniejszenia częstości stosowania, tymczasowego zaprzestania stosowania lub całkowitego zaprzestania stosowania.
donoszono, że tretinoina powoduje silne podrażnienie skóry wyprysku i należy ją stosować tylko ostrożnie u pacjentów z tą chorobą.
zastosowanie większych ilości leków niż zalecane nie doprowadzi do szybszych lub lepszych wyników, może wystąpić wyraźne zaczerwienienie, łuszczenie się lub dyskomfort.
środki ostrożności
ogólne
Refissa należy stosować wyłącznie jako uzupełnienie kompleksowego programu pielęgnacji skóry i unikania słońca. (Patrz wskazówki i sposób użycia.)
Jeśli wystąpi wrażliwość na lek, podrażnienie chemiczne lub ogólnoustrojowe działanie niepożądane, należy przerwać stosowanie produktu Refissa.
ekstremalne warunki pogodowe, takie jak wiatr lub zimno, mogą być bardziej irytujące dla pacjentów stosujących lek Refissa.
informacje dla pacjentów
patrz ulotka dla pacjenta.
interakcje z innymi lekami
jednoczesne leki miejscowe, mydła lecznicze lub ścierne, szampony, środki czyszczące, kosmetyki o silnym działaniu suszącym, produkty o wysokim stężeniu alkoholu, środki ściągające, przyprawy lub wapno, roztwory trwałej fali, elektroliza, Depilatory do włosów lub woski oraz produkty, które mogą podrażniać skórę, powinny być stosowane z ostrożnością u pacjentów leczonych produktem Refissa, ponieważ mogą one zwiększać podrażnienie produktem Refissa.
Refissa nie powinna być podawana, jeśli pacjent przyjmuje również leki, o których wiadomo, że są fotouczulaczami (np., tiazydy, tetracykliny, fluorochinolony, fenotiazyny, sulfonamidy) ze względu na możliwość nasilonej fototoksyczności.
Karcynogeneza, mutageneza, upośledzenie płodności
w trwającym całe życie badaniu skórnym na myszach CD-1 przy 100 i 200-krotności średniej zalecanej dawki stosowanej miejscowo u ludzi, zaobserwowano kilka guzów skóry u samic myszy i guzów wątroby u samców myszy. Biologiczne znaczenie tych odkryć nie jest jasne, ponieważ występowały one w dawkach przekraczających dermalną maksymalną tolerowaną dawkę (MTD) tretinoiny i ponieważ znajdowały się w naturalnym tempie występowania tych guzów w tym szczepie myszy. Nie było dowodów na działanie rakotwórcze, gdy tretynoina była podawana miejscowo w dawce 5 razy większej od średniej zalecanej dawki stosowanej u ludzi. W celu porównania ekspozycji zwierząt na ekspozycję u ludzi, „zalecana miejscowa dawka kliniczna u ludzi” jest zdefiniowana jako 500 mg produktu leczniczego Refissa stosowana codziennie u osoby o masie ciała 50 kg.
w przewlekłym, dwuletnim badaniu biologicznym kwasu witaminy A u myszy przeprowadzonym przez Tsuburę i Yamamoto, stwierdzono uogólnione odkładanie się amyloidu we wszystkich grupach w warstwie podstawowej skóry leczonej witaminą A. U myszy CD-1 podobne badanie wykazało hialinizację leczonych miejsc skóry, a częstość występowania tego zjawiska wynosiła 0/50, 3/50 i 2/50 u samców myszy i 1/50, 0/50, 4/50 i 2/50 u samic myszy z grupy kontrolnej nośnika, odpowiednio 0,25 mg/kg, 0,5 mg/kg i 1 mg/kg.
badania na bezwłosych myszach albinosów sugerują, że tretinoina może zwiększać potencjał nowotworowy rakotwórczych dawek światła UVB i UVA z symulatora słonecznego. W innych badaniach, gdy lekko pigmentowane bezwłose myszy leczone tretinoiną były narażone na działanie rakotwórczych dawek światła UVB, częstość występowania i szybkość rozwoju nowotworów skóry były zmniejszone lub nie obserwowano żadnego efektu. Ze względu na znacząco różne warunki eksperymentalne, nie jest możliwe ścisłe porównanie tych rozbieżnych danych w tej chwili. Chociaż znaczenie tych badań u ludzi nie jest jasne, pacjenci powinni zminimalizować ekspozycję na słońce.
potencjał mutagenny tretynoiny oceniano w teście Amesa i In vivo W teście mikrojąderkowym u myszy, z których oba były negatywne.
badania odcinka skóry i I III z kremem Tretinoin, USP (zmiękczającym) 0,05% nie zostały przeprowadzone u żadnego gatunku. W badaniach z zastosowaniem tretinoiny w segmencie doustnym i I III u szczurów obserwowano zmniejszenie przeżywalności noworodków i opóźnienie wzrostu po dawkach przekraczających 2 mg / kg mc. / dobę (>400 razy większych niż średnia dawka stosowana u ludzi stosowana miejscowo).
ciąża
działanie teratogenne
ciąża Kategoria C
doustna tretinoina wykazuje działanie teratogenne u szczurów, myszy, królików, chomików i podludzi naczelnych. Preparat wykazywał działanie teratogenne i fetotoksyczne u szczurów, gdy podawano go doustnie lub miejscowo w dawkach 1000 razy większych od średniej zalecanej dawki stosowanej miejscowo u ludzi. Jednakże zgłaszano różnice w dawkach teratogennych u różnych szczepów szczurów. U małpy cynomolgus, która pod względem metabolicznym jest bliższa człowiekowi pod względem tretynoiny niż u innych badanych gatunków, wady rozwojowe płodu zgłaszano po dawkach 10 mg/kg mc./dobę lub większych, ale nie obserwowano ich po dawce 5 mg/kg mc. / dobę(1000 razy większej od średniej zalecanej dawki stosowanej u ludzi do stosowania miejscowego), chociaż we wszystkich dawkach obserwowano zwiększoną zmienność szkieletu. Obserwowano zależne od dawki zwiększenie śmiertelności zarodków i poronienia. Podobne wyniki odnotowano również u makaków warkoczowatych.
miejscowa tretinoina w badaniach teratogenności zwierząt przyniosła niejednoznaczne wyniki. Istnieją dowody na teratogenność (skrócony lub załamany ogon) tretinoiny podawanej miejscowo szczurom Wistar w dawkach większych niż 1 mg / kg mc. / dobę (200-krotność zalecanej dawki stosowanej miejscowo u ludzi). Anomalie (kość ramienna: krótka 13%, zgięta 6%, OS ciemieniowa niekompletnie skostniała 14%) zgłaszano również, gdy podawano skórę w dawce 10 mg/kg mc./dobę.
istnieją inne doniesienia dotyczące białych królików nowozelandzkich, którym podawano dawki około 80 razy większe od zalecanej dawki klinicznej stosowanej u ludzi o zwiększonej częstości występowania kopułkowatej głowy i wodogłowia, typowych dla wad rozwojowych płodu indukowanych retinoidami u tego gatunku.
w przeciwieństwie do tego, kilka dobrze kontrolowanych badań na zwierzętach wykazało, że tretinoina podawana przez skórę w dawkach 100 i 200 razy większych od zalecanej dawki stosowanej miejscowo u ludzi, u szczurów i królików, nie miała działania teratogennego.
przy powszechnym stosowaniu jakiegokolwiek leku, niewielka liczba zgłoszeń o wadach wrodzonych związanych tymczasowo z podaniem leku byłaby oczekiwana przez przypadek. W ciągu dwóch dekad klinicznego stosowania innego preparatu miejscowo stosowanego tretinoiny (Retin-A) zgłoszono trzydzieści przypadków wrodzonych wad rozwojowych związanych czasowo. Chociaż nie ustalono określonego schematu działania teratogennego i nie stwierdzono przypadkowego związku z tymi przypadkami, 5 raportów opisuje rzadką kategorię wad wrodzonych holoprosencephaly (wady związane z niekompletnym rozwojem linii środkowej przedmózgowia). Znaczenie tych spontanicznych zgłoszeń dla ryzyka dla płodu nie jest znane.
działanie nie teratogenne
wykazano, że Dermalna tretinoina jest fetotoksyczna u królików, gdy jest podawana w dawkach 100 razy większych od zalecanej dawki stosowanej miejscowo u ludzi. Wykazano, że doustna tretinoina jest fetotoksyczna u szczurów, gdy jest podawana w dawkach 500 razy większych od zalecanej dawki stosowanej miejscowo u ludzi.
nie przeprowadzono jednak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Leku Refissa nie należy stosować w okresie ciąży.
matki karmiące
nie wiadomo, czy lek ten przenika do mleka kobiecego. Ponieważ wiele leków przenika do mleka kobiecego, należy zachować ostrożność podczas podawania leku Refissa kobietom karmiącym piersią.
stosowanie u dzieci
nie określono bezpieczeństwa stosowania i skuteczności u pacjentów w wieku poniżej 18 lat.
stosowanie w podeszłym wieku
Bezpieczeństwo i skuteczność stosowania u osób w wieku powyżej 50 lat nie zostały ustalone.
działania niepożądane
(patrz punkty ostrzeżenia i środki ostrożności.)
w badaniach prowadzonych metodą podwójnie ślepej próby z udziałem 179 pacjentów, którzy zastosowali krem TRETINOINOWY USP (zmiękczający) 0,05% Na twarz, działania niepożądane związane ze stosowaniem kremu Tretinoin USP (zmiękczający) 0,05% były ograniczone głównie do skóry. Podczas tych badań 4% pacjentów musiało przerwać stosowanie kremu Tretinoin, USP (zmiękczającego) 0,05% z powodu działań niepożądanych. Przerwanie leczenia było spowodowane podrażnieniem skóry lub powiązanymi skórnymi działaniami niepożądanymi.
reakcje miejscowe, takie jak łuszczenie się, suchość skóry, pieczenie, pieczenie, rumień i świąd były zgłaszane przez prawie wszystkich pacjentów podczas leczenia kremem Tretinoin, USP (zmiękczający) 0,05%. Te objawy podmiotowe i przedmiotowe miały zwykle łagodne lub umiarkowane nasilenie i występowały na ogół we wczesnym etapie leczenia. U większości pacjentów suchość, łuszczenie i zaczerwienienie powracały po początkowym (24 tygodniu) spadku.
przedawkowanie
nie wykazano, aby stosowanie większych ilości leków niż zalecane prowadziło do szybszych lub lepszych rezultatów, może wystąpić wyraźne zaczerwienienie, łuszczenie się lub dyskomfort. Doustne spożycie leku może prowadzić do takich samych działań niepożądanych, jak te związane z nadmiernym doustnym przyjmowaniem witaminy A.
Refissa Dawkowanie i sposób podawania
- nie należy stosować leku Refissa, jeśli pacjentka jest w ciąży lub zamierza zajść w ciążę lub jest w grupie wysokiego ryzyka ciąży
- nie należy stosować leku Refissa, jeśli pacjent jest opalony lub jeśli pacjent ma wyprysk lub inne przewlekłe schorzenia skóry
- nie należy stosować leku Refissa, jeśli pacjent jest z natury wrażliwy na światło słoneczne
- nie należy stosować leku Refissa, jeśli pacjent przyjmuje również leki znane jako leki fotouczulające(np. tiazydy, tetracykliny, fluorochinolony, fenotiazyny, sulfonamidy) ze względu na możliwość zwiększenia fototoksyczności.
pacjenci wymagają szczegółowych instrukcji, aby uzyskać maksymalne korzyści i zrozumieć wszystkie środki ostrożności niezbędne do stosowania tego produktu z największym bezpieczeństwem. Lekarz powinien zapoznać się z ulotką dla pacjenta.
Refissa należy nakładać na twarz raz dziennie przed odejściem na emeryturę, używając tylko tyle, aby lekko pokryć cały dotknięty obszar. Pacjenci powinni delikatnie umyć twarz łagodnym mydłem, osuszyć skórę i odczekać 20 do 30 minut przed zastosowaniem leku Refissa. Pacjent powinien nałożyć niewielką ilość kremu wielkości grochu, aby lekko pokryć całą twarz. Należy zachować szczególną ostrożność podczas stosowania kremu, aby uniknąć oczu, uszu, nozdrzy i ust.
stosowanie leku Refissa może powodować przejściowe uczucie ciepła lub lekkie pieczenie.
Łagodzenie (łagodzenie) drobnych zmarszczek twarzy, przebarwień plamistych i chropowatości dotykowej może wystąpić stopniowo w trakcie terapii. Do sześciu miesięcy terapii może być wymagane, zanim efekty są widoczne. Większość poprawy odnotowanej po zastosowaniu produktu Refissa jest obserwowana podczas pierwszych 24 tygodni leczenia. Następnie terapia utrzymuje przede wszystkim poprawę osiągniętą w ciągu pierwszych 24 tygodni.
po przerwaniu leczenia Refissa większość pacjentów straci najbardziej łagodzące działanie Refissa na drobne zmarszczki, plamistą przebarwienia i dotykową szorstkość skóry twarzy; jednak Bezpieczeństwo i skuteczność stosowania Refissa codziennie przez ponad 48 tygodni nie zostały ustalone.
stosowanie większych ilości leków niż zalecane może nie prowadzić do szybszych lub lepszych wyników, może wystąpić wyraźne zaczerwienienie, łuszczenie się lub dyskomfort.
pacjenci leczeni produktem Refissa mogą stosować kosmetyki, ale obszary, które mają być leczone, powinny być dokładnie oczyszczone przed zastosowaniem leku. (Patrz punkt środki ostrożności.
jak jest dostarczany Refissa
Refissa jest dostępny w:
20 g tubes NDC 42851-012-20
40 g tubes NDC 42851-012-40
Przechowywanie
Przechowywać w temperaturze 20-25°c (68-77°F) . NIE ZAMRAŻAĆ.
tylko Rx.
Printed in USA
140904-0118
wyprodukowany przez DPT Laboratories, San Antonio, TX 78215
dystrybuowany przez ZO Skin Health, Inc., Irvine, CA 92618
Refissa®
do stosowania miejscowego tylko na twarz
Jakie są najważniejsze informacje o Refissa ?
Refissa jest poważnym lekiem. Nie likwiduje zmarszczek ani nie naprawia skóry zniszczonej słońcem. Może pomóc w leczeniu drobnych zmarszczek, plamistych przebarwień i szorstkiej skóry, ale nie „leczy” tych warunków. Refissa należy stosować wyłącznie pod nadzorem lekarza w ramach szerokiego programu pielęgnacji skóry. Program ten powinien obejmować unikanie bezpośredniego światła słonecznego (za pomocą odzieży ochronnej i filtrów przeciwsłonecznych z minimum SPF 15) i stosowanie innych kremów nawilżających do twarzy, które nie zawierają tretinoiny.
Lek Refissa należy stosować tylko przed snem. Nie używaj produktów do pielęgnacji skóry suszącej. Użyj najmniejszej ilości leku Refissa i unikaj dostania się go do oczu, uszu, nosa lub ust.
ostrzeżenie: nie stosować leku Refissa, jeśli pacjentka jest w ciąży lub planuje zajść w ciążę. Unikać światła słonecznego i innych leków, które mogą zwiększać wrażliwość na światło słoneczne(patrz poniżej).
nie badano stosowania produktu Refissa u osób w wieku powyżej 50 lat ani u osób z umiarkowaną lub ciemną pigmentowaną skórą.
Co To jest Refissa?
(czego mogę się spodziewać po Refissie?)
Refissa jest poważnym lekiem, który może pomóc w leczeniu, ale nie „wyleczy” drobnych zmarszczek, plamistych przebarwień skóry i szorstkiej skóry.
badania pokazują, że po 24 tygodniach około 30% osób, które stosowały krem Tretinoin, USP (zmiękczający) 0,05% w przypadku drobnych zmarszczek lub wyprysków miało umiarkowaną poprawę, kolejne 35% miało minimalną poprawę, a 35% nie miało poprawy. Około 16% osób, które stosowały krem Tretinoin, USP (emolient) 0,05% dla szorstkiej skóry, miało umiarkowaną poprawę, 35% miało minimalną poprawę, a 49% nie miało poprawy. Nie ma dowodów na to, że Refissa leczy szorstką skórę, głębokie zmarszczki, zażółconą skórę lub inne problemy z pielęgnacją skóry.
Refissa powinna być stosowana jako część szerokiego programu pielęgnacji skóry. Program ten powinien obejmować unikanie bezpośredniego światła słonecznego (za pomocą odzieży ochronnej i filtrów przeciwsłonecznych z minimum SPF 15) i stosowanie innych kremów nawilżających do twarzy, które nie zawierają tretinoiny. Wiele osób może osiągnąć pożądane efekty za pomocą tego programu bez użycia Refissa. Nie należy stosować leku Refissa, dopóki nie wypróbujesz szerokiego programu leczenia skóry bez leku Refissa.
podczas stosowania leku Refissa poprawa drobnych zmarszczek, wyprysków i szorstkiej skóry nie jest natychmiastowa i występuje stopniowo w miarę upływu czasu. Ogólnie rzecz biorąc, niektóre działania mogą wystąpić w ciągu 3 do 4 miesięcy. Efekty są zwykle najbardziej zauważalne po około 6 miesiącach z niewielką dodatkową poprawą po tym czasie. W przypadku przerwania leczenia produktem leczniczym Refissa poprawa stopniowo się zmniejsza.
bezpieczeństwo stosowania produktu Refissa codziennie przez ponad 48 tygodni nie zostało ustalone.
kto nie powinien stosować Refissy?
nie należy stosować leku Refissa, jeśli jesteś opalony lub bardzo wrażliwy na słońce, jeśli masz egzemę lub jeśli Twoja skóra jest podrażniona. Refissa może powodować zwiększone podrażnienie skóry i zwiększoną podatność na oparzenia słoneczne.
ponieważ lek Refissa może zwiększać wrażliwość skóry na światło słoneczne, należy poinformować pracownika służby zdrowia o stosowaniu innych leków zwiększających wrażliwość na światło słoneczne, ponieważ nie należy stosować leku Refissa z tymi lekami. Należą do nich między innymi: tiazydowe leki moczopędne (stosowane w leczeniu wysokiego ciśnienia krwi), tetracykliny, fluorochinolny lub sulfonamidy (stosowane w leczeniu zakażeń) i fenotiazyny (stosowane w leczeniu poważnych zaburzeń emocjonalnych). Jeśli przyjmujesz leki na receptę, leki bez recepty lub używasz kremów do twarzy, skontaktuj się z pracownikiem służby zdrowia, aby upewnić się, że nie wchodzą w interakcje z Refissa.
ostrzeżenie o ciąży: nie wykazano bezpieczeństwa stosowania w czasie ciąży. Istnieją doniesienia o wadach wrodzonych u zwierząt laboratoryjnych i ludzi, którym podawano tretinoinę doustnie. Nie należy stosować leku Refissa, jeśli pacjentka jest w ciąży lub próbuje zajść w ciążę.
nie wiadomo, czy lek Refissa jest przekazywany niemowlętom przez mleko matki. Nie wykazano bezpieczeństwa stosowania u dzieci.
Bezpieczeństwo i skuteczność leku Refissa u osób powyżej 50 roku życia lub z ciemniejszym zabarwieniem skóry nie zostały udowodnione.
Jak stosować Refissa?
powinieneś nakładać Refissa Na twarz raz dziennie przed odejściem na emeryturę, używając tylko tyle, aby lekko pokryć cały dotknięty obszar. Delikatnie umyj twarz łagodnym mydłem, osusz skórę i odczekaj 20 do 30 minut przed zastosowaniem Refissa. Nałóż ilość kremu wielkości grochu, aby pokryć całą twarz. Po pierwszym zastosowaniu leku Refissa może wystąpić uczucie ciepła lub lekkiego kłucia.
należy zachować szczególną ostrożność podczas stosowania kremu, aby uniknąć oczu, uszu, nozdrzy lub ust. Refissa może powodować silne zaczerwienienie, swędzenie, pieczenie, pieczenie i łuszczenie, jeśli jest stosowana na te obszary.
stosowanie większych niż niezbędne ilości leku Refissa nie przyspieszy wyników i może spowodować przedawkowanie. Przedawkowanie może spowodować zaczerwienienie i łuszczenie się skóry, a także ból lub dyskomfort.
możesz używać kosmetyków po zastosowaniu Refissa. Przed ponownym zastosowaniem leku Refissa należy dokładnie umyć twarz.
czego należy unikać podczas używania Refissa?
Refissa zwiększa wrażliwość na światło słoneczne. Unikać światła słonecznego jak najwięcej. Używaj odzieży ochronnej i kremu przeciwsłonecznego z minimum SPF 15. Nie opalaj się ani nie używaj lamp słonecznych. Jeśli jesteś wrażliwy na światło słoneczne lub masz pracę, która wymaga, aby być na słońcu przez długi czas, należy zachować szczególną ostrożność.
podczas stosowania leku Refissa należy unikać produktów, które mogą wysuszać lub podrażniać skórę. Na przykład unikaj produktów nakładanych na skórę, które zawierają alkohol, przyprawy lub limonkę. Należy również unikać środków czyszczących, usuwania włosów lub innych produktów, które mogą podrażniać skórę.
Jakie są możliwe skutki uboczne Refissa?
najczęstszymi działaniami niepożądanymi są reakcje skórne. Zgłaszano świąd, zaczerwienienie i suchość skóry. Tak jak pieczenie, pieczenie i łuszczenie skóry. Są one najczęściej łagodne i występują najczęściej po rozpoczęciu leczenia.
Jak mogę uzyskać dodatkowe informacje?
w ulotce zawarto najważniejsze informacje dotyczące preparatu Refissa. Jeśli chcesz uzyskać więcej informacji, porozmawiaj z lekarzem lub innym pracownikiem służby zdrowia. Istnieje również ulotka napisana dla pracowników służby zdrowia, którą może dostarczyć farmaceuta.
skontaktuj się z lekarzem w celu uzyskania porady lekarskiej na temat działań niepożądanych. MOŻESZ ZGŁOSIĆ DZIAŁANIA NIEPOŻĄDANE DO FDA NA 1-800-FDA-1088.
główny panel wyświetlacza-karton tubowy 40 g
NDC 42851-012-40
117471-0118
Refissa ®
krem Tretinoinowy,
USP (zmiękczający) 0.05%
Rx Only
NET WT 40 g
FDA APPROVED

| Refissa TRETINOIN (EMOLLIENT) tretinoin cream |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Labeler – ZO Skin Health, Inc. (826468527)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| DPT Laboratories, Ltd. | 832224526 | manufacture(42851-012) | |
więcej o Refissa (tretinoina miejscowa)
- skutki uboczne
- podczas ciąży lub karmienia piersią
- Informacje o dawkowaniu
- interakcje z lekami
- Cennik & kupony
- En Español
- Klasa leku: miejscowe środki trądzikowe
zasoby konsumenckie
- informacje o pacjencie
- refissa topical (Advanced reading)
zasoby profesjonalne
- informacje o przepisywaniu
- Tretinoin Gel microsphere (FDA)
inne marki retin-a, Renova, atralin, Altreno, … +2 Więcej
powiązane poradniki leczenia
- fotostarzenie skóry
oświadczenie lekarskie