Specjalny cukier: jak kwas sialowy wpływa na metabolizm, zdrowie i choroby
roi się od drobnoustrojów, które żyją na powierzchniach zewnętrznych i wewnątrz naszego ciała. Nasze zrozumienie mikrobiomu jelitowego w szczególności szybko się poprawia, gdy zaczynamy odkrywać, jak złożone społeczności mikrobiologiczne oddziałują z naszą dietą, z innymi drobnoustrojami i z naszymi powierzchniami komórkowymi. Podczas gdy wiele substancji chemicznych jest ważnych w tym środowisku, tutaj skupiamy się na kwasach sialowych jako krytycznym zestawie cząsteczek, które stanowią podstawę wielu z tych interakcji i wpływają na metabolizm, zdrowie i choroby.
najczęstszy kwas sialowy, kwas N-acetylo-neuraminowy (Neu5Ac) (rys. 1) jest stosunkowo prostym kwasem cukrowym, który oprócz swojego ładunku nie ma w sobie nic niezwykłego. Jednak, gdy komórki kontaktują się z innymi komórkami, często używają cząsteczek wyświetlanych na powierzchni, i to właśnie tam kwasy sialowe stają się tak ważne, ponieważ są one zwykle końcowymi cukrami na glikanach gospodarza, które pieprzą białka i lipidy siedzące na powierzchniach komórek. Glikoproteiny na powierzchni komórki lub wydzielane mucyny są dobrymi przykładami struktur pokrytych kwasem sialowym, które drobnoustroje mogą napotkać na powierzchniach błon śluzowych, takich jak drogi oddechowe lub żołądkowo-jelitowe (gi). Ta wyjątkowa pozycja jako cząsteczki „meet and greet”dla innych ludzkich komórek, komórek bakteryjnych i wirusów stawia kwasy sialowe w centrum wielu ważnych procesów.
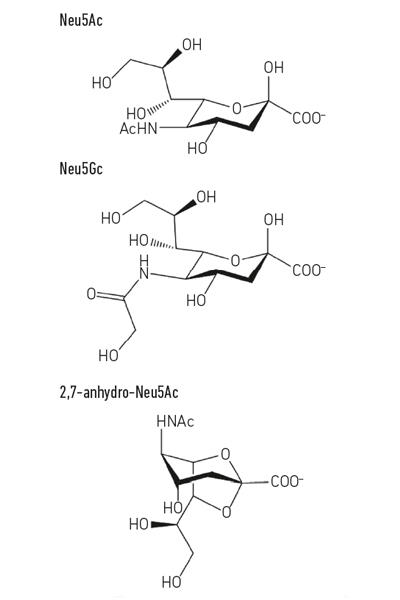
- rys. 1. Przykład pochodnych kwasu sialowego. Należy zauważyć, że kwas N-glikolilo-neurnaminowy (Neu5Gc) nie może być wytwarzany przez ludzi, biochemiczną różnicę, która odróżnia nas od innych małp człekokształtnych, ale może być włączony do powierzchni naszych komórek, gdy zostanie nabyty z diety.
- patogeny pokryte cukrem
- karmienie krzyżowe-dzielenie się słodyczami wokół
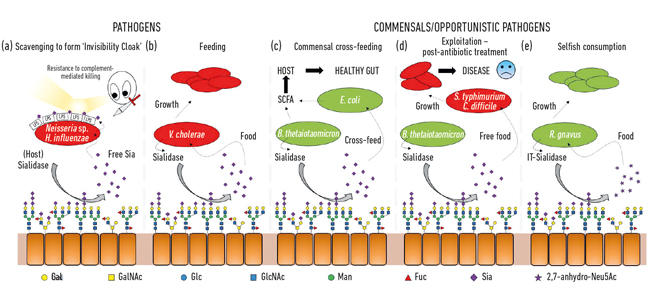
- rys. 2. Kreskówkowa ilustracja różnych interakcji między bakteriami a kwasami sialowymi obecnymi jako końcowe cukry na szeregu glikanów gospodarza. Są one rozszczepiane przez sialidazy i zwykle przekształcane do wolnego Neu5Ac, z wyjątkiem it-sialidazy, która uwalnia 2,7-anhydro-Neu5Ac. Wolny kwas sialowy uwalniany przez żywiciela lub sialidazy chorobotwórcze może być następnie używany przez patogeny jako płaszcz niewidzialny (a) lub do karmienia (b). Karmienie krzyżowe może wystąpić między członkami mikrobioty jelitowej lub między komensalnymi a patogennymi bakteriami dzielącymi tę samą niszę (c, d), podczas gdy inne bakterie rozwinęły egoistyczne mechanizmy rezerwowania kwasu sialowego do własnego spożycia (e).
- utrzymywanie własnych słodyczy
- wirusy dostają się do aktu
- Czytaj dalej
- Andrew Bell
- Emmanuele Severi
- Nathalie Juge
- Gavin H. Thomas
- dlaczego Mikrobiologia ma znaczenie?
- Jaką radę dałbyś komuś zaczynającemu w tej dziedzinie?
rys. 1. Przykład pochodnych kwasu sialowego. Należy zauważyć, że kwas N-glikolilo-neurnaminowy (Neu5Gc) nie może być wytwarzany przez ludzi, biochemiczną różnicę, która odróżnia nas od innych małp człekokształtnych, ale może być włączony do powierzchni naszych komórek, gdy zostanie nabyty z diety.
patogeny pokryte cukrem
jedną z pierwszych funkcji mikrobiologicznych kwasów sialowych była zdolność niektórych patogenów do kolonizacji, a następnie wywoływania chorób u ludzi. Rzeczywiście, były prezes Towarzystwa mikrobiologicznego, profesor Harry Smith FRS, pracujący na Uniwersytecie w Birmingham, był pionierem tej pracy z Neisseria gonorrhoea. Kiedy naukowcy z jego grupy wyizolowali robaka bezpośrednio z ciała, był on odporny na zabijanie przez ludzką surowicę (zabijanie za pośrednictwem dopełniacza), ale jeśli robaki były hodowane w laboratorium przez kilka pokoleń, ochrona ta została utracona, a komórki zostały zabite przez serum. Jego grupa odkryła, że te patogeny kradną kwas sialowy od gospodarza i używają go do pokrywania własnej powierzchni komórek w celu ich humanizacji. Jednakże, ponieważ mogą one usuwać tylko ten kwas sialowy, jego brak w pożywce wzrostowej oznacza, że nie dodaje się dalej kwasu sialowego, więc szybko tracą tę „ochronę w surowicy” i są zabijane. Okazuje się, że szereg innych podstępnych robaków wykorzystuje podobne strategie do generowania własnej niewidzialności przy użyciu kwasu sialowego, takich jak Neisseria meningitidis, Campylobacter jejuni lub Haemophilus influenzae (Fig. 2A)
karmienie krzyżowe-dzielenie się słodyczami wokół
oprócz tego, że są używane przez patogeny jako płaszcz niewidzialny, kwasy sialowe są całkiem dobrym pokarmem dla bakterii, ponieważ dostarczają zarówno węgla, jak i azotu i mogą być używane jako źródło energii. Wcześniejsze prace pokazały, że patogeny, takie jak Vibrio cholerae, chętnie spożywały kwasy sialowe i to samo w sobie było ważne dla udanej kolonizacji gospodarza (Fig. 2b).
w jelitach głównym źródłem kwasów sialowych są mucyny, które są głównymi składnikami strukturalnymi warstwy śluzu pokrywającej powierzchnię nabłonka. Najbardziej odsłoniętą warstwą śluzu jest siedlisko różnych bakterii komensalnych, które nauczyły się odżywiać białkami mucyny, w których cukry wytwarzają 80% swojej masy. Z prostego punktu widzenia topologicznego, kwasy sialowe, jako końcowe cukry, są zbierane jako pierwsze, odsłaniając leżące u ich podstaw cukry, które mogą być następnie uwalniane i spożywane. Wraz z pojawieniem się sekwencjonowania nowej generacji zdobyliśmy wiedzę na temat drobnoustrojów żyjących w tej niszy, a wiele z nich ma geny wychwytu kwasu sialowego i późniejszego katabolizmu. Ekscytujące było odkrycie, że niektóre komensalne beztlenowce, takie jak Bacteroides thetaiotaomicron, wydzielają sialidazy w celu uwolnienia kwasu sialowego, ale brakuje transporterów i genów katabolicznych, aby faktycznie je wykorzystać. Ten pozornie altruistyczny gest jest wymagany, aby bakterie miały dostęp do podstawowych cukrów i wspierały proces metabolicznego krzyżowania się z innymi owadami żyjącymi w niszy śluzowej, takimi jak komensalne szczepy Escherichia coli, które nie mają sialidazy, ale są dobre w jedzeniu wolnego kwasu sialowego (Fig. 2c). Koncepcja ta jest obecnie uznawana za ważny aspekt kolonizacji i adaptacji niszowej. Genialny przykład tego został opisany przez grupę Justina Sonnenburga z Uniwersytetu Stanforda, przy użyciu modelu myszy z prostą zdefiniowaną mikrobiotą jelitową. Po leczeniu antybiotykami wiele bakterii zjadających kwas sialiowy zostało wytępionych, co spowodowało nagromadzenie wolnego kwasu sialiowego w jelitach. Gdy następnie zakwestionowane z patogenami, takimi jak Salmonella typhimurium lub Clostridium difficile, patogeny te skorzystałyby z wolnego kwasu sialowego jako składnika odżywczego (Fig. 2d). Zmutowane szczepy patogenów pozbawione transporterów lub genów katabolicznych nie miały przewagi, tworząc bezpośredni związek z przerostem patogenu, gdy społeczność mikrobiologiczna jelit jest zakłócona. W związku z tym zaproponowano mechanizmy zmniejszające pulę wolnego kwasu sialowego w jelitach jako część nowej strategii przeciwzakaźnej.
rys. 2. Kreskówkowa ilustracja różnych interakcji między bakteriami a kwasami sialowymi obecnymi jako końcowe cukry na szeregu glikanów gospodarza. Są one rozszczepiane przez sialidazy i zwykle przekształcane do wolnego Neu5Ac, z wyjątkiem it-sialidazy, która uwalnia 2,7-anhydro-Neu5Ac. Wolny kwas sialowy uwalniany przez żywiciela lub sialidazy chorobotwórcze może być następnie używany przez patogeny jako płaszcz niewidzialny (a) lub do karmienia (b). Karmienie krzyżowe może wystąpić między członkami mikrobioty jelitowej lub między komensalnymi a patogennymi bakteriami dzielącymi tę samą niszę (c, d), podczas gdy inne bakterie rozwinęły egoistyczne mechanizmy rezerwowania kwasu sialowego do własnego spożycia (e).
utrzymywanie własnych słodyczy
podczas gdy dużo wczesna sialomicrobiologia skupiała się na patogenach, nowsze prace skupiały się na bakteriach komensalnych zamieszkujących tę samą niszę. Dzisiejsze badania w dziedzinie mikroflory jelitowej ujawniają, jak ostra konkurencja dla Neu5Ac jest w naszych jelitach i jak może przechylić równowagę między patogenami a komensalami. Co, jeśli konkretna bakteria mogłaby uwolnić kwas sialowy w formie, do której tylko ona mogłaby uzyskać dostęp? Prace w grupie Juge w Norwich wykazały, że symbiont jelitowy Ruminococcus gnavus ewoluował do tego, używając specjalnego typu sialidazy zwanej wewnątrzcząsteczkową trans-sialidazą (it-sialidaza), która uwalnia 2,7-anhydro-Neu5Ac (patrz Fig. 1) zamiast Neu5Ac. Opracowując metodę syntezy czystego 2,7-anhydro-Neu5Ac, wykazali, że szczepy R. gnavus były w stanie rosnąć na 2,7-anhydro-Neu5Ac jako jedyne źródło węgla. Oprócz domeny katalizującej reakcję enzymatyczną, it-sialidazy zawierają domenę wiążącą węglowodany, która pomaga pośredniczyć w wiązaniu IT-sialidazy z mucynami bogatymi w kwas sialiowy. In vivo może to sprzyjać mechanizmowi, który pomaga ukierunkować bakterie w kierunku regionów przewodu pokarmowego bogatych w kwas sialowy, promując w ten sposób kolonizację bakterii w warstwie śluzu. Po zlokalizowaniu we właściwym miejscu it-sialidaza odrywa kwas sialowy z końcowych łańcuchów mucyny i uwalnia go w postaci 2,7-anhydro-Neu5Ac, którą R. gnavus może używać jako własnego źródła pożywienia, zamiast dzielić Neu5Ac z innymi bakteriami zamieszkującymi niszę śluzową, w tym patogenami (Fig. 2e). Mechanizm ten zapewnia przewagę konkurencyjną nad innymi bakteriami sialiczno-kwaśnymi zamieszkującymi niszę śluzową, zapewniając źródło składników odżywczych, do których może preferencyjnie uzyskać dostęp. Ponadto R. gnavus może również pomóc w zmniejszeniu przerostu patogenów jelitowych poprzez zmniejszenie poziomu Neu5Ac w środowisku śluzówkowym, otwierając drogi do nowej strategii terapeutycznej w epoce zwiększającej się oporności na antybiotyki.
wirusy dostają się do aktu
wirusy wykorzystują również kwasy sialowe jako kluczowe cząsteczki podczas cyklu infekcji, najbardziej znany wirus grypy. Początkowe przywiązanie jest pierwszym kluczowym krokiem, ponieważ kwasy sialowe działają jako receptory dla wirusa na komórkach nabłonka dróg oddechowych. Rodzaj powiązania kwasu sialowego z cukrami leżącymi u podstaw glikanów często kontroluje szereg wirusów grypy, a szczepy pandemiczne często mają białko adhezyjne (hemaglutynina), które rozpoznaje podobne do człowieka formy przyłączania kwasu sialowego i dlatego są szczególnie wirulentne. Kwas sialowy jest ważny na ostatnim etapie cyklu życia wirusa, ponieważ uwolnienie z zakażonej komórki wymaga odszczepienia kwasów sialowych z powierzchni komórki gospodarza. Jest ona katalizowana przez enzym wirusowy zwany sialidazą (lub neuraminidazą). Hamowanie tego enzymu przez strukturalne analogi kwasu sialowego, sformułowane w Tamiflu® (fosforan oseltamiwiru) i zanamiwir, to nasze leczenie grypy z pierwszej linii i triumf projektowania leków inspirowanych strukturą/funkcją.
podsumowując, oczywiste jest, że kwasy sialowe są kluczowymi cząsteczkami w wielu procesach, w których komórki mikrobiologiczne i wirusy oddziałują z powierzchniami komórek ssaków. W tym krótkim artykule poruszyliśmy niektóre z nich, aby dać wyobrażenie o centralnych funkcjach tych cukrów w komunikacji, ukryciu, kolonizacji i metabolizmie w różnych aspektach zdrowia i chorób. Kwasy sialowe zostały opisane jako najważniejsze substancje chemiczne na świecie i bez wątpienia nadal ujawniają więcej na temat ewolucji ludzi i ich interakcji z ich drobnoustrojami.
Czytaj dalej
Tomasz, GH. Akwizycja kwasu sialowego u bakterii – jeden substrat, wiele transporterów. Biochem Soc Trans 2016; 44: 760-765.
Ng KM, Ferreyra JA, Higginbottom SK, Lynch JB, Kashyap PC et al. Uwalniane przez mikrobiotę cukry gospodarza ułatwiają po antybiotykowej ekspansji patogenów jelitowych. Nature 2013; 502: 96-99.
Owen CD, Tailford LE, Monaco S, Šuligoj T, Vaux L et al. Odkrycie specyficzności i mechanizmu rozpoznawania kwasu sialowego przez symbiont jelitowy Ruminococcus gnavus. Nat Commun 2017; 8:2196.
Tailford LE, Owen CD, Walshaw J, Crost EH, Hardy-Goddard J, Le Gall G, de Vos WM, Taylor GL, Juge N. odkrycie wewnątrzcząsteczkowych trans-sialidaz w ludzkiej mikrobiocie jelitowej sugeruje nowe mechanizmy adaptacji śluzówki. Nat Commun 2015; 6: 7624.
Juge N, Tailford L, Owen CD. Sialidazy z bakterii jelitowych: mini-przegląd. Biochem Soc Trans 2016; 44: 166-175.

Andrew Bell
Quadram Institute Bioscience, Norwich Research Park, nr4 7UQ, Wielka Brytania
Andrew Bell jest studentem podyplomowym w dziale drobnoustrojów jelitowych i zdrowia w Quadram Institute badającym wpływ nowego mechanizmu metabolizmu kwasu sialowego na homeostazę jelit. Uzyskał licencjat z Biochemii na Uniwersytecie Wschodniej Anglii i spędził 2 lata pracując w John Innes Centre on chlorophyll metabolism in pea (Pisum sativum), a następnie dołączył do grupy Nathalie Juge w Quadram Institute w 2015 roku w celu uzyskania pracy doktorskiej.

Emmanuele Severi
Department of Biology, University of York, Wentworth Way, York YO10 5DD, UK
@emm_severi
Emmanuele Severi jest pracownikiem naukowym na Wydziale Biologii Uniwersytetu York, pracującym w laboratorium prof. Gavina Thomasa. W różnych okresach swojej kariery zajmował się transportem i metabolizmem kwasu sialowego, a od 2002 roku jest członkiem Towarzystwa.

Nathalie Juge
Quadram Institute Bioscience, Norwich Research Park, nr4 7UQ, Wielka Brytania
Nathalie Juge jest liderem badań w Quadram Institute Bioscience (QIB) w Norwich, zastępcą lidera programu strategicznego Instytutu, mikrobów jelitowych i zdrowia (GMH) oraz honorowym profesorem w School of Biological Sciences, University of East Anglia. Prowadzi grupę badawczą nad glikobiologią interakcji gospodarz-mikrob w jelitach, koncentrując się na metabolizmie kwasu sialowego pochodzącego z mucyny przez mikrobiotę jelitową (https://quadram.ac.uk/nathalie-juge).

Gavin H. Thomas
Department of Biology, University of York, Wentworth Way, York YO10 5DD, UK
@ GavinHThomas
Gavin H. Thomas jest profesorem mikrobiologii na Wydziale Biologii Uniwersytetu w Yorku i od ponad dekady pracuje nad transportem i katabolizmem bakteryjnego kwasu sialowego. Jest członkiem Towarzystwa od 1995 roku, był redaktorem „Microbiology Today” (2003-2006), w tym samym okresie zasiadał w Radzie, zasiadał w Komisji ds. komunikacji (2012-2015) i Komisji ds. równości & Komisji ds. różnorodności (2013-2015). Był redaktorem, starszym redaktorem, a obecnie zastępcą redaktora naczelnego wiodącego czasopisma”Mikrobiologia”(http://thomaslabyork.weebly.com).
dlaczego Mikrobiologia ma znaczenie?
Gawin: Ma to znaczenie dla naszego zdrowia-dopiero teraz zaczynamy rozumieć skład molekularny i funkcję naszego mikrobiomu, który prawdopodobnie wpływa na nasz organizm w wieloraki sposób.
Jaką radę dałbyś komuś zaczynającemu w tej dziedzinie?
Gavin: Czytaj szeroko i nie tylko „twój błąd” – mikroby mogą zrobić prawie wszystko i zwykle wymyśliły wiele różnych sposobów, aby to zrobić!
Zdjęcia: cząsteczki wirusa grypy H3N2. CDC / Science Photo Library.
rys. 1. Andrew Bell.
rys. 2. Emmanuele Severi.