Trifenylofosfina
PPh3 jest szeroko stosowany w syntezie organicznej. Właściwościami, które kierują jego użyciem, są jego nukleofilowość i jego redukcyjny charakter. Nukleofilowość PPh3 jest wskazywana przez jego reaktywność w kierunku alkenów elektrofilowych, takich jak akceptory Michaela i halogenki alkilowe. Jest również stosowany w syntezie związków biarylowych, takich jak reakcja Suzukiego.
Czwartorzędu
PPh3 łączy się z halogenkami alkilowymi, dając sole fosfoniowe. Mechanizm reakcji czwartorzędu przebiega zgodnie ze zwykłym schematem, w którym halogenki benzylowe i allilowe są szczególnie wydajnymi reagentami:
pph3 +CH3I → + I−
te sole, które często mogą być izolowane jako krystaliczne ciała stałe, reagują z silnymi zasadami, tworząc ylidy:
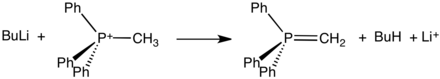
takie ylidy są kluczowymi odczynnikami w reakcjach Wittiga, używanymi do przekształcania aldehydów i ketonów w alkeny.
halogenki Arylowe czwartorzędu pph3 dają sole Tetrafenylofosfoniowe:
PPh3 + PhBr → Br
reakcja wymaga jednak podwyższonej temperatury i katalizatorów metalowych.
reakcja Mitsunobuedit
w reakcji Mitsunobu mieszanina trifenylofosfiny i azodikarboksylanu diizopropylu („diad” lub jego dietylowy Analog, martwy) przekształca alkohol i kwas karboksylowy w ester. DIAD jest redukowany, ponieważ służy jako akceptor wodoru, a PPh3 jest utleniany do OPPh3.
reakcja Appelaedytuj
w reakcji appela do konwersji alkoholi do halogenków alkilowych stosuje się mieszaninę PPh3 i CX4 (X = CL, Br). Tlenek trifenylofosfiny (OPPh3) jest produktem ubocznym.
PPh3 + CBr4 + Rch2oh → OPPh3 + Rch2br + HCBr3
ta reakcja rozpoczyna się nukleofilowym atakiem PPh3 na CBr4, przedłużeniem wymienionej powyżej reakcji czwartorzędu.
Deoksygenacjaedit
łatwe utlenianie PPh3 jest wykorzystywane do deoksygenacji nadtlenków organicznych, co zwykle występuje przy zachowaniu konfiguracji:
PPh3 + RO2H → OPPh3 + ROH (r = alkil)
stosuje się go również do rozkładu ozonidów organicznych do ketonów i aldehydów, chociaż siarczek dimetylu jest bardziej popularny w reakcji jako produkt uboczny, sulfotlenek dimetylu jest łatwiej oddzielany od mieszaniny reakcyjnej niż tlenek trifenylofosfiny. Aromatyczne N-tlenki są redukowane do odpowiedniej aminy z wysoką wydajnością w temperaturze pokojowej z napromieniowaniem:

Sulfonowanieedit
sulfonowanie PPh3 daje tris(3-sulfofenylo)fosfinę, P(C6H4-3-SO3−)3 (TPPTS), zwykle izolowane jako sól trisodowa. W przeciwieństwie do PPh3, TPPTS jest rozpuszczalny w wodzie, podobnie jak jego pochodne metaliczne. Kompleksy rodowe tppt są stosowane w niektórych przemysłowych reakcjach hydroformylacji.

redukcja do difenylofosforanu
litu w THF oraz na lub K reagują z PPh3 dając Ph2PM (M = Li, Na, K). Sole te są wszechstronnymi prekursorami fosforytów trzeciorzędowych. Na przykład 1,2-dibromoetan i Ph2PM reagują, dając Ph2PCH2CH2PPh2. Słabe kwasy, takie jak chlorek amonu, przekształcają Ph2PM (M = Li, Na, K) w difenylofosfinę:
(C6H5)2PM + H2o → (C6H5)2PH + MOH
kompleksy metali Przejściowychedytuj
Trifenylofosfina dobrze wiąże się z większością metali przejściowych, zwłaszcza z metalami środkowego i późnego przejścia z grup 7-10. Pod względem masy sterycznej PPh3 ma kąt stożka Tolmana 145°, który jest pośredni między P(C6H11)3 (170°) I P(CH3)3 (115°). We wczesnym zastosowaniu w katalizie homogenicznej, NiBr2(PPh3)2 był używany przez Waltera Reppe do syntezy estrów akrylanowych z alkinów, tlenku węgla i alkoholi. Zastosowanie PPh3 zostało spopularyzowane poprzez jego zastosowanie w katalizatorze hydroformylacyjnym RhH (PPh3) 3 (CO).