Refissa
nome genérico: tretinoin
dosagem: cream
medicamente revisto por: Drugs.com. atualizado pela última vez em 1 de abril de 2020.
- visão geral
efeitos secundáriosdose profissional interacçõesMais
apenas para uso tópico na FACE.
- descrição de Refissa
- indicações e utilização de Refissa
- ENSAIOS CLÍNICOS de DADOS
- contra-indicações
- advertências
- precauções
- geral
- informação para os doentes
- Interações Medicamentosas
- sobredosagem
- Refissa Dosagem e Administração
- como é fornecida Refissa
- Armazenamento
- painel de visualização PRINCIPAL-Caixa De Tubos de 40 g
- Mais sobre Refissa (tretinoína tópica)
- recursos para o Consumidor
- recursos
descrição de Refissa
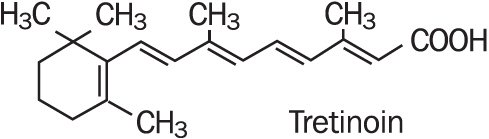
Refissa , contém a substância activa tretinoína (um retinóide) numa base creme emoliente. A tretinoína é um pó cristalino de cor amarela a laranja, com um odor floral característico. A tretinoína é solúvel em dimetilsulfóxido, ligeiramente solúvel em polietilenoglicol 400, octanol e etanol a 100%. É praticamente insolúvel em água e óleo mineral e insolúvel em glicerina. O nome químico da tretinoína é ácido (all-e)-3,7-dimetil-9-(2,6,6-trimetil-1-ciclonexen-1-il) – 2,4,6,8-nonatetraenóico. A tretinoína é também referida como ácido all – trans-retinóico e tem um peso molecular de 300,44. A fórmula estrutural é representada abaixo.
Refissa contém tretinoína numa concentração de 0.05% w/w in a water-in-oil emulsion formulation consisting of light mineral oil, sorbitol solution, hydroxyoctacosanyl hydroxystearate; methoxy PEG-22/dodecyl glycol copolymer, PEG-45/dodecyl glycol copolymer, stearoxytrimethylsilane and stearyl alcohol, dimethicone 50 cs, methylparaben, edetate disodium, propylparaben, butylated hydroxytoluene, citric acid monohydrate, and purified water.desconhece-se o mecanismo exacto de acção da tretinoína, embora se acredite que os retinóides exercem um efeito no crescimento e diferenciação de várias células epiteliais. Quando aplicado topicamente, no entanto, não se observou aumento na desmosina, hidroxiprolina ou ARNm elastina na pele humana. Além disso, o papel da natureza irritante deste produto na eficácia dos efeitos positivos atribuídos a este produto para a sua indicação ainda não foi totalmente determinado.a absorção transdérmica da tretinoína a partir de várias formulações tópicas variou entre 1% e 31% da dose aplicada, dependendo se foi aplicada na pele saudável ou na pele dermatítica. Quando absorção percutânea de Tretinoína Creme, USP (Emoliente) de 0,05% foi avaliada em homens saudáveis (n=14) após uma única aplicação, bem como, depois de repetidas aplicações diárias durante 28 dias, a absorção de tretinoína foi inferior a 2% e endógena concentrações de tretinoína e seus principais metabólitos foram inalterado.
indicações e utilização de Refissa
(para compreender completamente a indicação deste produto, leia por favor toda a secção de indicações e utilização da rotulagem.)
Refissa é indicado como um adjuvante do agente (ver o segundo ponto de marcador abaixo) para uso na mitigação (manejo paliativo) de rugas finas, manchas hiperpigmentação, e táteis rugosidade da pele facial em pacientes que não alcançar tal manejo paliativo usando abrangentes de cuidados com a pele e evitar o sol programas (ver item 3, para que as populações em que a eficácia não foi estabelecida). Refissa não elimina rugas, reparar a pele danificada pelo sol, fazer FOTOAGING reverso, ou restaurar um padrão histológico dérmico mais jovem ou jovem. Muitos pacientes atingem os efeitos paliativos desejados sobre rugas finas, hiperpigmentação manchada, e rugosidade táctil da pele facial com o uso de cuidados abrangentes da pele e programas para evitar o sol, incluindo Protector solar, roupas protectoras e cremes emolientes que não contêm tretinoína.creme de tretinoína, USP (emoliente) 0.05% não demonstrou qualquer efeito atenuante em sinais significativos de exposição crónica ao sol, tais como rugas grosseiras ou profundas, amarelecimento da pele, lentiginas, telangiectasia, laxidade cutânea, atipia queratinocítica, atipia melanocítica ou elastose dérmica.
ENSAIOS CLÍNICOS de DADOS
Dois adequados e bem-controlados foram realizados envolvendo um total de 161 pacientes avaliáveis (abaixo de 50 anos de idade) tratadas com Tretinoína Creme, USP (Emoliente) de 0,05% e 154 avaliáveis pacientes tratados com o veículo emoliente creme no rosto para 24 semanas como um suplemento para um abrangentes de cuidados com a pele e evitar o sol do programa, para avaliar os efeitos sobre finas rugas, manchado hiperpigmentação, e táteis da pele rugosidade. Patients were evaluated at baseline on a 10-point scale, and changes from that baseline rating were categorized as follows:
| No Improvement: | No change or an increase of 1 unit or more | |
| Minimal Improvement: | Reduction of 1 unit | |
| Moderate Improvement: | Redução de 2 unidades ou mais |
nestes ensaios, as rugas finas, manchas hiperpigmentação, e táteis rugosidade da pele facial foi pensado para ser causado por vários fatores, que incluiu intrínseca do envelhecimento, ou fatores ambientais, tais como a exposição ao sol.os resultados destas avaliações são os seguintes::
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 36% | 40% | 24% |
| Vehicle + CSP | 62% | 30% | 8% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 35% | 27% | 38% |
| Vehicle + CSP | 53% | 21% | 27% |
| NO IMPROVEMENT | MINIMAL IMPROVEMENT | MODERATE IMPROVEMENT | |
|---|---|---|---|
| * CSP= Comprehensive skin protection and sun avoidance programs included use of sunscreens, protective clothing, and emollient cream. | |||
| Tretinoin Cream, USP (Emollient) 0.05% + CSP * | 49% | 35% | 16% |
| Veículo + CSP | 67% | 23% | 10% |
a Maioria dos melhora desses sinais foi observado durante as primeiras 24 semanas de terapia. Posteriormente, a terapêutica manteve principalmente a melhoria observada durante as primeiras 24 semanas.
A maioria dos pacientes vai perder a maioria dos efeitos de redução de Refissa em rugas, manchado hiperpigmentação, e táteis rugosidade da pele facial com a interrupção de um programa abrangente de cuidados com a pele e evitar o sol do programa, incluindo Refissa; no entanto, a segurança e a eficácia do uso de Refissa diariamente por mais de 48 semanas não foram estabelecidas.
contra-indicações
este medicamento está contra-indicado em indivíduos com antecedentes de reacções de sensibilidade a qualquer um dos seus componentes. Deve ser descontinuado se for observada hipersensibilidade a qualquer um dos seus componentes.
advertências
- Refissa é um irritante dérmico, e os resultados da irritação contínua da pele durante mais de 48 semanas na utilização crónica a longo prazo não são conhecidos. Há evidência de alterações atípicas nos melanócitos e queratinócitos e de aumento da elastose dérmica em alguns doentes tratados com creme de tretinoína, USP (emoliente) 0, 05% durante mais de 48 semanas. Desconhece-se o significado destes resultados.a segurança e eficácia de Refissa em indivíduos com pele moderada ou fortemente pigmentada não foram estabelecidas.Refissa não deve ser administrado se o doente também estiver a tomar medicamentos conhecidos por serem fotossensíveis (p.ex., tiazidas, tetraciclinas, fluoroquinolonas, fenotiazinas, sulfonamidas) devido à possibilidade de fototoxicidade aumentada.devido à elevada susceptibilidade à queima, a exposição à luz solar (incluindo tetos solares) deve ser evitada ou minimizada durante a utilização de Refissa. Os doentes devem ser avisados para utilizarem protectores solares (SPF mínimo de 15) e vestuário de protecção durante a utilização de Refissa. Os doentes com queimadura solar devem ser aconselhados a não utilizar Refissa até estarem totalmente recuperados. Os doentes que possam ter uma exposição solar considerável, por exemplo, devido à sua ocupação e os doentes com sensibilidade inerente à luz solar, devem ter especial cuidado ao utilizar Refissa e assegurar que são observadas as precauções descritas no Folheto Informativo do doente.creme de tretinoína, USP (emoliente) 0, 05% devem ser mantidos fora dos olhos, boca, ângulos do nariz e membranas mucosas. A utilização tópica pode causar eritema local Grave, prurido, ardor, picadas e descamação no local de Aplicação. Se o grau de irritação local o justificar, os doentes devem ser instruídos a utilizar menos medicação, diminuir a frequência de Aplicação, interromper temporariamente o uso ou interromper completamente o uso.a tretinoína foi notificada como causadora de irritação grave na pele eczematosa e só deve ser utilizada com precaução em doentes com esta situação.a aplicação de quantidades maiores de medicação do que as recomendadas não levará a resultados mais rápidos ou melhores, e pode ocorrer vermelhidão, descamação ou desconforto marcado.
precauções
geral
Refissa só deve ser usada como adjuvante de um programa abrangente de cuidado da pele e prevenção do sol. (Ver a secção indicações e utilização.se se desenvolver sensibilidade ao fármaco, irritação química ou reacção adversa sistémica, a utilização de Refissa deve ser interrompida.os extremos climáticos, tais como o vento ou o frio, podem ser mais irritantes para os pacientes que usam Refissa.
informação para os doentes
ver Folheto Informativo do doente.
Interações Medicamentosas
Concomitante de medicamentos de uso tópico, medicado ou abrasivos, sabonetes, shampoos, produtos de limpeza, cosméticos, com um forte efeito de secagem, produtos com alta concentração de álcool, adstringentes, especiarias ou cal, onda permanente de soluções, eletrólise, cabelo depilatórios ou ceras e produtos que podem irritar a pele, devem ser usados com cautela em pacientes sendo tratados com Refissa porque eles podem aumentar a irritação com Refissa.Refissa não deve ser administrada se o doente também estiver a tomar medicamentos conhecidos por serem fotossensibilizantes (ex. devido à possibilidade de fototoxicidade aumentada, tiazidas, tetraciclinas, fluoroquinolonas, fenotiazinas, sulfonamidas).carcinogénese, mutagénese, diminuição da fertilidade num estudo dérmico ao longo da vida em ratinhos CD-1 a 100 e 200 vezes a dose clínica tópica humana média recomendada, foram observados alguns tumores cutâneos em ratinhos fêmea e tumores hepáticos em ratinhos machos. O significado biológico destes resultados não é claro porque ocorreram com doses que excederam a dose dérmica máxima tolerada (DMT) da tretinoína e porque estavam dentro da taxa de ocorrência natural de fundo para estes tumores nesta estirpe de ratinhos. Não houve evidência de potencial carcinogénico quando a tretinoína foi administrada topicamente numa dose 5 vezes superior à dose clínica tópica humana média recomendada. Para efeitos de comparação da exposição animal à exposição humana, a “dose clínica tópica recomendada no ser humano” é definida como 500 mg de Refissa aplicada diariamente a uma pessoa de 50 kg.num bioensaio crónico de dois anos de ácido de vitamina A em ratinhos realizado por Tsubura e Yamamoto, a deposição generalizada de amilóides foi notificada em todos os grupos na camada basal da pele tratada com vitamina A. No CD-1 de ratos, um estudo semelhante relatado hyalinization da pele tratada sites e a incidência de esta constatação foi 0/50, 3/50, e 2/50 em ratos machos e 1/50, 0/50, 4/50 e 2/50 em ratos do sexo feminino a partir do controle do veículo, 0,25 mg/kg, 0,5 mg/kg e 1 mg/kg de grupos, respectivamente.estudos em ratinhos albinos sem pêlo sugerem que a tretinoína pode aumentar o potencial tumorigénico de doses carcinogénicas de luz UVB e UVA a partir de um simulador solar. Noutros estudos, quando ratinhos sem pêlos ligeiramente pigmentados tratados com tretinoína foram expostos a doses carcinogénicas de luz UVB, a incidência e a taxa de desenvolvimento de tumores cutâneos foram reduzidas ou não foram observados efeitos. Devido a condições experimentais significativamente diferentes, nenhuma comparação rigorosa destes dados díspares é possível neste momento. Embora o significado destes estudos no ser humano não seja claro, os doentes devem minimizar a exposição ao sol.o potencial mutagénico da tretinoína foi avaliado no ensaio de Ames e no ensaio in vivo de micronúcleos em ratinhos, ambos negativos.estudos do segmento Dérmico I e III com creme de tretinoína, USP (emoliente) 0, 05% não foram realizados em nenhuma espécie. Nos estudos do segmento oral I e do segmento III em ratos com tretinoína, observou-se diminuição da sobrevivência de recém-nascidos e atraso no crescimento com doses superiores a 2 mg/kg/dia (400 vezes a dose clínica tópica humana média).a tretinoína ORAL demonstrou ser teratogénica em ratos, ratinhos, coelhos, hamsters e primatas sub-humanos. Foi teratogénico e fetotóxico em ratos quando administrado por via oral ou Topica em doses 1000 vezes superiores à dose clínica tópica humana recomendada. No entanto, foram notificadas variações nas doses teratogénicas entre várias estirpes de ratos. O macaco cynomolgus, que, metabolicamente, está mais perto de seres humanos para o tretinoin que as outras espécies analisadas, malformações fetais foram relatados com doses de 10 mg/kg/dia ou mais, mas nenhum foi observado em 5 mg/kg/dia (1.000 vezes a média recomendada humanos tópica clínicos de dose), embora o aumento esquelético variações foram observadas em todas as doses. Foi notificado um aumento da embrioletalidade e do aborto relacionado com a dose. Também foram relatados resultados semelhantes em macacos-cauda-de-porco.a tretinoína tópica em ensaios de teratogenicidade animal gerou resultados equívocos. Existe evidência de teratogenicidade (cauda encurtada ou bifurcada) da tretinoína tópica em ratos Wistar com doses superiores a 1 mg/kg/dia (200 vezes a dose clínica tópica recomendada no ser humano). Foram também notificadas anomalias (úmero: curto 13%, bent 6%, os parietal incompletamente ossificado 14%) quando foram aplicadas por via cutânea 10 mg/kg/dia.existem outros relatos em coelhos brancos da Nova Zelândia, administrados com doses de aproximadamente 80 vezes a dose clínica tópica recomendada no ser humano, de um aumento da incidência de cabeça domada e hidrocefalia, típico de malformações fetais induzidas pelo retinóide nesta espécie.pelo contrário, vários estudos em animais bem controlados demonstraram que a tretinoína aplicada por via cutânea não foi teratogénica, em doses 100 e 200 vezes superiores à dose clínica tópica recomendada no ser humano, em ratos e coelhos, respectivamente.com o uso generalizado de qualquer droga, um pequeno número de relatos de defeitos de nascença associados temporariamente à administração da droga seria esperado apenas por acaso. Foram notificados trinta casos de malformações congénitas temporariamente associadas durante duas décadas de utilização clínica de outra formulação de tretinoína tópica (Retin-A). Embora não tenha sido estabelecido nenhum padrão definitivo de teratogenicidade e nenhuma associação casual a partir destes casos, 5 dos relatórios descrevem a holoprosencefalia de categoria de defeitos congénitos raros (defeitos associados ao desenvolvimento incompleto da linha média do cérebro dianteiro). Desconhece-se o significado destas notificações espontâneas em termos de risco para o feto.a tretinoína dérmica demonstrou ser fetotóxica em coelhos quando administrada em doses 100 vezes superiores à dose clínica tópica recomendada em humanos. A tretinoína Oral demonstrou ser fetotóxica em ratos quando administrada em doses 500 vezes superiores à dose clínica tópica recomendada em humanos.não existem, no entanto, estudos adequados e bem controlados em mulheres grávidas. Refissa não deve ser utilizada durante a gravidez.não se sabe se este fármaco é excretado no leite humano. Uma vez que muitos medicamentos são excretados no leite humano, deve ter-se cuidado quando Refissa é administrada a uma mulher que está a amamentar.a segurança e eficácia em doentes com menos de 18 anos de idade não foram estabelecidas.a segurança e eficácia em indivíduos com mais de 50 anos de idade não foram estabelecidas.reacções adversas
(ver secções de Advertências e precauções.)
em estudos em dupla ocultação, controlados com veículos, envolvendo 179 doentes que aplicaram creme de tretinoína, USP (emoliente) 0, 05% às suas faces, as reacções adversas associadas à utilização de Creme de tretinoína, USP (emoliente) 0, 05% limitaram-se principalmente à pele. Durante estes ensaios, 4% dos doentes tiveram de interromper o uso de tretinoína creme, USP (emoliente) 0, 05% devido a reacções adversas. Estas interrupções foram devidas a irritação cutânea ou a reacções adversas cutâneas relacionadas.reacções locais tais como descamação, pele seca, ardor, picadas, eritema e prurido foram notificadas por quase todos os indivíduos durante a terapêutica com creme de tretinoína, USP (emoliente) 0, 05%. Estes sinais e sintomas foram geralmente de gravidade ligeira a moderada e ocorreram geralmente no início da terapêutica. Na maioria dos pacientes a secura, descamação e vermelhidão repetiram-se após uma diminuição inicial (24 semanas).
sobredosagem
a aplicação de quantidades maiores de medicação do que as recomendadas não demonstrou conduzir a resultados mais rápidos ou melhores, e pode ocorrer vermelhidão, descamação ou desconforto marcado. A ingestão Oral do medicamento pode conduzir aos mesmos efeitos secundários associados à ingestão oral excessiva de vitamina A.
Refissa Dosagem e Administração
- NÃO use Refissa se a paciente está grávida ou está a tentar engravidar ou se está em elevado risco de gravidez
- NÃO use Refissa se o paciente está queimado ou se o paciente tem eczema ou outras condição crônica da pele(s)
- NÃO use Refissa se o paciente é inerentemente sensível à luz solar
- NÃO use Refissa se o paciente também estiver a tomar medicamentos conhecidos para ser fotossensibilizadores (por exemplo, as tiazidas, tetraciclinas, fluoroquinolonas, fenotiazinas, sulfonamidas), devido à possibilidade de aumentada phototoxicity.os doentes necessitam de instruções detalhadas para obter os benefícios máximos e para compreender todas as precauções necessárias para utilizar este medicamento com a maior segurança. O médico deve rever o Folheto Informativo do doente.a Clarissa deve ser aplicada na face uma vez por dia antes da reforma, utilizando apenas o suficiente para cobrir levemente toda a área afectada. Os doentes devem lavar cuidadosamente as suas faces com um sabão suave, esfolar a pele seca e esperar 20 a 30 minutos antes de aplicar a Refissa. O doente deve aplicar uma quantidade de creme do tamanho de uma ervilha para cobrir ligeiramente toda a face. Deve ter-se especial cuidado ao aplicar o creme para evitar os olhos, ouvidos, narinas e boca.a aplicação de Refissa pode causar uma sensação transitória de calor ou um ligeiro ardor.a atenuação (paliação) da rugosidade facial, hiperpigmentação motorizada e rugosidade táctil podem ocorrer gradualmente ao longo do tratamento. Podem ser necessários até seis meses de tratamento antes de os efeitos serem observados. A maior parte da melhoria observada com Refissa é observada durante as primeiras 24 semanas de tratamento. A partir daí, a terapia mantém principalmente a melhoria realizada durante as primeiras 24 semanas.com a interrupção da terapêutica com Refissa, a maioria dos doentes perderá os efeitos mais atenuantes de Refissa nas rugas finas, hiperpigmentação manchada e rugosidade táctil da pele facial; no entanto, não foi estabelecida a segurança e a eficácia da utilização diária de Refissa durante mais de 48 semanas.a aplicação de quantidades maiores de medicação do que as recomendadas pode não levar a resultados mais rápidos ou melhores, e pode ocorrer vermelhidão marcada, descamação ou desconforto.os doentes tratados com Refissa podem utilizar cosméticos, mas as áreas a tratar devem ser cuidadosamente limpas antes da aplicação do medicamento. (Ver secção precauções.)
como é fornecida Refissa
Refissa está disponível em:
20 g tubos NDC 42851-012-20
40 g tubos NDC 42851-012-40Armazenamento
armazenamento a 20-25°C (68-77°F) . NÃO CONGELAR.apenas
Rx.
Printed in USA
140904-0118
Manufactured by DPT Laboratories, San Antonio, TX 78215
Distributed by ZO Skin Health, Inc., Irvine, CA 92618Refissa®
para uso tópico apenas na FACE
Qual é a informação mais importante sobre Refissa ?Refissa é um medicamento grave. Não elimina rugas ou repara pele danificada pelo sol. Pode ajudar a tratar rugas finas, descoloração manchada, e pele de sensação áspera, mas não “cura” estas condições. Refissa só deve ser usado sob a supervisão de seu prestador de cuidados de saúde como parte de um programa de cuidados de pele ampla. Este programa deve incluir a prevenção da luz solar directa (utilizando vestuário protector e protectores solares com um mínimo de SPF de 15) e a utilização de outros cremes faciais hidratantes que não contenham tretinoína.só deve utilizar Refissa ao deitar. Não utilize produtos para secar a pele. Use a menor quantidade de Refissa necessária e evite colocá-lo em seus olhos, ouvidos, nariz ou boca.advertência: não utilize Refissa se estiver grávida ou a tentar engravidar. Evite a luz solar e quaisquer outros medicamentos que possam aumentar a sua sensibilidade à luz solar (ver abaixo).Refissa não foi estudada em pessoas com mais de 50 anos de idade ou em pessoas com pele pigmentada moderada ou escura.o que é a Refissa?(o que posso esperar de Refissa?)
Refissa é um medicamento sério que pode ajudar a tratar, mas não vai “curar” rugas finas, descoloração da pele manchada, e pele de sensação áspera.estudos de
mostram que após 24 semanas, cerca de 30% das pessoas que usaram creme de tretinoína, USP (emoliente) 0, 05% para rugas finas ou descoloração manchada tiveram melhoria moderada, outros 35% tiveram melhoria mínima e 35% não tiveram melhoria. Cerca de 16% das pessoas que usaram creme de tretinoína, USP (emoliente) 0,05% para a pele rugosa tiveram melhoria moderada, 35% tiveram melhoria mínima, e 49% não tiveram melhoria. Não há evidência de que Refissa trata pele grossa, rugas profundas, pele amarelada, ou outros problemas de cuidado da pele.Refissa deve ser usada como parte de um programa de cuidados gerais da pele. Este programa deve incluir a prevenção da luz solar directa (utilizando vestuário protector e protectores solares com um mínimo de SPF de 15) e a utilização de outros cremes faciais hidratantes que não contenham tretinoína. Muitas pessoas podem alcançar os efeitos desejados usando este programa sem usar Refissa. Você não deve usar a Refissa até que você tenha tentado um amplo programa de tratamento da pele sem a Refissa.quando utilizar Refissa, a melhoria da coloração fina da pele enrugada, manchas na pele e pele rugosa não é imediata e ocorre gradualmente ao longo do tempo. Geralmente, você pode notar alguns efeitos em 3 a 4 meses. Os efeitos são geralmente mais perceptíveis em cerca de 6 meses, com pouca melhoria adicional após esse tempo. Se Refissa for parada, a melhora diminuirá gradualmente.não foi estabelecida a segurança da utilização diária de Refissa durante mais de 48 semanas.quem não deve utilizar Refissa?não deve utilizar Refissa se estiver bronzeado ou muito sensível ao sol, se tiver eczema ou se a sua pele estiver irritada. Refissa pode causar aumento da irritação cutânea e aumento da susceptibilidade à queimadura solar.
Desde Refissa pode tornar a sua pele mais sensível à luz solar, você deve informar o seu profissional de saúde se também estiver a utilizar outros medicamentos que aumentam a sensibilidade à luz solar, porque você não deve estar usando Refissa com estes medicamentos. Estas incluem, mas não se limitam a: tiazidas (usadas para tratar a pressão arterial elevada), tetraciclinas, fluoroquinolnes ou sulfonamidas (usadas para tratar infecções) e fenotiazinas (usadas para tratar problemas emocionais graves). Se estiver a tomar medicamentos sujeitos a receita médica, medicamentos não sujeitos a receita médica ou a utilizar cremes faciais, consulte um profissional de saúde para se certificar de que não interagem com Refissa.advertência sobre a gravidez: não foi demonstrada a segurança da utilização durante a gravidez. Existem relatos de defeitos congénitos com animais de laboratório e humanos aos quais foi administrada tretinoína por via oral. Não deve utilizar Refissa se estiver grávida ou a tentar engravidar.desconhece-se se Refissa é passada para lactentes através do leite materno. Não foi demonstrada a segurança da utilização em crianças.a segurança e eficácia de Refissa para pessoas com mais de 50 anos ou com coloração cutânea mais escura não foi provada.como devo utilizar Refissa?deve aplicar Refissa na sua cara uma vez por dia antes de se retirar, usando apenas o suficiente para cobrir toda a área afectada levemente. Lave cuidadosamente a face com um sabão suave, esfregue a pele até secar, e espere 20 a 30 minutos antes de aplicar Refissa. Aplique uma quantidade de creme do tamanho de uma ervilha para cobrir toda a sua face. Você pode sentir um calor ou leve picada quando Refissa é aplicado pela primeira vez.deve ter especial cuidado ao aplicar o creme para evitar os olhos, ouvidos, narinas ou boca. Refissa pode causar vermelhidão grave, comichão, ardor, picadas e descamação se aplicado a estas áreas.a utilização de quantidades maiores do que as necessárias de Refissa não irá acelerar os resultados e pode causar uma sobredosagem. Uma sobredosagem pode resultar em pele vermelha e descascada, bem como alguma dor ou desconforto.pode utilizar cosméticos após a aplicação de Refissa. Certifique-se de limpar completamente o rosto antes de aplicar Refissa novamente.o que devo evitar durante a utilização de Refissa?Refissa aumenta a sua sensibilidade à luz solar. Evite a luz solar tanto quanto possível. Use roupa protectora e protector solar com um SPF mínimo de 15. Não tomar sol ou utilizar lâmpadas de sol. Se você é sensível à luz solar ou tem um trabalho que requer que você esteja no sol por longos períodos, você deve usar extrema cautela.durante a utilização de Refissa, evitar quaisquer produtos que possam secar ou irritar a pele. Por exemplo, evite produtos aplicados na pele que contenham álcool, especiarias ou cal. Além disso, evite limpadores, depilação ou outros produtos que possam irritar a pele.quais são os possíveis efeitos secundários de Refissa?os efeitos secundários mais frequentes são reacções cutâneas. Foi notificada comichão, pele vermelha e seca. Assim como a pele a arder, a picar e a descascar. Estes são, na maioria das vezes, ligeiros e são mais comuns quando o tratamento é iniciado.como posso obter informações adicionais?este folheto resumiu a informação mais importante sobre Refissa. Se desejar mais informações, fale com o seu médico ou outro profissional de saúde. Existe também um folheto escrito para os profissionais de saúde que o seu farmacêutico lhe pode fornecer.consulte o seu médico para aconselhamento médico sobre efeitos secundários. PODE COMUNICAR EFEITOS SECUNDÁRIOS À FDA EM 1-800-FDA-1088.
painel de visualização PRINCIPAL-Caixa De Tubos de 40 g
NDC 42851-012-40
117471-0118Refissa ®
creme de tretinoína,
USP (emoliente) 0.05%Rx Only
NET WT 40 gFDA APPROVED

Refissa TRETINOIN (EMOLLIENT)
tretinoin creamProduct Information Product Type HUMAN PRESCRIPTION DRUG LABEL Item Code (Source) NDC:42851-012 Route of Administration TOPICAL DEA Schedule Active Ingredient/Active Moiety Ingredient Name Basis of Strength Strength TRETINOIN (TRETINOIN) TRETINOIN 0.5 mg in 1 g Inactive Ingredients Ingredient Name Strength LIGHT MINERAL OIL SORBITOL HYDROXYOCTACOSANYL HYDROXYSTEARATE METHOXY PEG-22/DODECYL GLYCOL COPOLYMER PEG-45/DODECYL GLYCOL COPOLYMER STEAROXYTRIMETHYLSILANE STEARYL ALCOHOL METHYLPARABEN EDETATE DISODIUM PROPYLPARABEN BUTYLATED HYDROXYTOLUENE CITRIC ACID MONOHYDRATE WATER Packaging # Item Code Package Description 1 NDC:42851-012-40 1 TUBE in 1 CARTON 1 40 g in 1 TUBE 2 NDC:42851-012-20 1 TUBE in 1 CARTON 2 20 g in 1 TUBE Marketing Information Marketing Category Application Number or Monograph Citation Marketing Start Date Marketing End Date ANDA ANDA076498 04/03/2017 Labeler – ZO Skin Health, Inc. (826468527)
Establishment Name Address ID/FEI Operations DPT Laboratories, Ltd. 832224526 manufacture(42851-012) ZO Skin Health, Inc.Mais sobre Refissa (tretinoína tópica)
- Efeitos Colaterais
- Durante a Gravidez ou a Amamentação
- Informação sobre a Dosagem
- Interações Medicamentosas
- Preço & Cupons
- En Español
- classe da Droga: tópico da acne agentes
recursos para o Consumidor
- Informações do Paciente
- Refissa Tópica (Leitura Avançada)
recursos
- Informação de Prescrição
- Tretinoin Gel de Microesferas (FDA)
Outras marcas Retin-A, Renova, Atralin, Altreno, … + 2 mais guias de tratamento relacionados com a H3 *
- Fotoaging da pele *
Declaração de exoneração de responsabilidade médica