Ouabain
Ouabain este o glicozidă cardiacă care inhibă schimbul sodiu-potasiu dependent de ATP în membranele celulare. Legarea ouabain la pompa de sodiu-potasiu (numită și Na+/K+ ATPază) previne modificările conformaționale necesare pentru buna funcționare a acesteia. Aceasta afectează compoziția ionilor intracelulari în diferite moduri, cu efecte diferite, în funcție de celulă și de doză. Prin urmare, compusul a fost utilizat în medicină, atât ca tratament terapeutic, cât și în cercetarea legată de transportul activ al membranei active.
proteina țintă: Na+ / K + ATPaza

Na+ / K+ ATPaza transportă activ potasiu în celulă și sodiu în spațiul extracelular conform schemei generale descrise mai jos. Această proteină transmembranară este compusă din trei subunități, alfa, beta și gamma, care se pot dimeriza cu alte pompe in vivo. Structura cristalină este un hexamer simetric radial, când în țesuturile vii, proteinele se asociază cel mai probabil bilateral. Lanțul alfa este prezentat în roz / albastru, iar lanțul beta în galben/verde. Dintre cele două, subunitatea alfa joacă rolul principal în funcționarea proteinei. Pachetul de helice alfa din Centrul proteinei poziționează reziduurile hidrofobe la exteriorul motivului, deschizând un portal prin bistratul lipidic. În interiorul acestui domeniu transmembranar, reziduurile subunității alfa coordonează ionii de sodiu sau potasiu. Domeniul mare de pe partea citoplasmatică a bistratului (cel mai îndepărtat de subunitatea beta) plutește în soluție și este responsabil pentru legarea și hidrolizarea ATP. Ca și în cazul multor enzime proteice ale hidrolizei fosfoesterice, grupările fosfat sunt coordonate cu a . Energia eliberată de clivajul fosfatului de mare energie este transferată prin modificări conformaționale în domeniul transmembranar, unde ionii sunt forțați împotriva gradientului lor de concentrație. Pe partea extracelulară, mișcările pentru a preveni disocierea ionilor de potasiu în timpul intrării lor în celulă. O a treia subunitate gamma (violet/portocaliu), împreună cu subunitatea beta, contribuie la ancorarea domeniilor transmembranare la bistratul fosfolipidic.
funcționarea normală Na+ / K+ ATPaza se modifică unidirecțional între două faze, E1 și E2. În faza E1, se leagă Na+ și ATP în interiorul celulei. După hidroliză, proteina fosforelată ejectează ADP și modifică conformația la E2, permițând disocierea 3Na+ pe partea extracelulară a membranei. Proteina se leagă apoi de 2K+ și hidrolizează fosfatul anorganic legat, provocând revenirea la E1. Chiar înainte de legarea K+ la starea E2, Ouabain se leagă de reziduurile din interiorul pompei, împiedicând tranziția înapoi la E1 (astfel cofactorul de magneziu coordonează o legătură enzimatică )
Ouabain structura și legarea
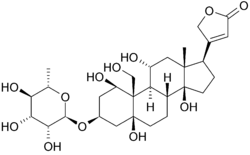
mai jos este structura oubain în două dimensiuni. Molecula constă dintr-un zahăr legat de un colesterol modificat printr-o legătură glicozidică (deci glicozidă). Grupările hidroxil care înconjoară o mare parte din moleculă, împreună cu esterii de la ambele capete, contribuie la legarea sa la pompa de sodiu-potasiu legată de membrană. poate fi văzut și în trei dimensiuni. Cu geometria moleculară și stereochimia afișate în acest fel, se poate vedea mai clar distribuția legăturilor carbon-oxigen polar și a legăturilor carbon-carbon nepolare în spațiul din jurul moleculei. Acest lucru face vizualizarea legării inhibitorului mult mai ușoară. Ouabain este la proteina de-a lungul interiorul unui pachet alfa-helix. componentele reziduurilor ajută oarecum la coordonarea ouabain prin forțele Van der Waals, dar reziduurile, glutamina, acidul aspartic și treonina, împreună cu legătura amidică a unei alanine, înconjoară grupările hidroxil și carbonil ale ligandului, formând legături de hidrogen de 2 până la 4 angstromi în lungime. Acest lucru nu numai că ține medicamentul în loc, dar previne schimbarea conformațională necesară funcției proteinei.
inhibarea mușchiului Cardiac și a pompei ionice
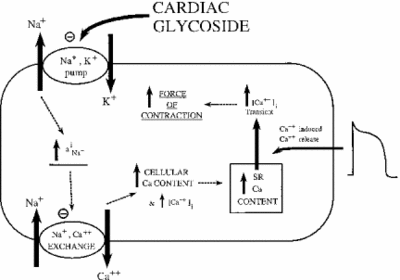
inhibarea Na+/K+ ATPază are efecte indirecte asupra rezistenței contractile sau inotrofiei celulelor musculare cardiace. Prin creșterea concentrației citoplasmatice de sodiu, este activat un schimbător de sodiu-calciu, crescând astfel concentrația celulară de calciu. Calciul este un al doilea mesager în multe căi de semnalizare/reglementare. Eliberarea sa în citoplasma celulelor musculare semnalează contracția, explicând efectul pozitiv al dozelor mici de ouabain asupra introfiei cardiace. Imaginea de mai jos prezintă acest efect al tuturor glicozidelor cardiace asupra țesutului miocardic. După cum se arată, inhibarea pompei de sodiu-potasiu determină creșterea sodiului citoplasmatic, care activează pompa de sodiu-calciu provocând creșterea calciului citoplasmatic. Aceasta crește forța cu care celula se contractă.
dacă este dozat corect, ouabain se dovedește a fi eficient în tratarea insuficienței cardiace și a aritmiilor. Cu toate acestea, activitatea ouabain poate contribui indirect la supraîncărcarea celulelor miocardice cu sodiu. Canalele pasive Na + sunt de obicei inactivate atunci când potențialul membranei este la cel mai înalt nivel. Când se redeschid sau nu reușesc să se închidă, prea mult sodiu se poate scurge în celulă, provocând cheltuielile risipitoare de ATP și/sau contracția musculară necoordonată. Aceasta se numește târziu i-Na. Odată cu creșterea sodiului și a calciului, se activează o kinază dependentă de Ca2+-calmodulină, la rândul său fosforilând și activând canalele pasive Na+. Când efectele ouabain sunt amplificate în acest fel, medicamentul poate provoca mai mult rău decât bine. Cercetările au arătat că o modalitate eficientă de combatere a i-Na târziu este prin inhibarea kinazei dependente de Ca2+-calmodulină (Hoyer și colab. 2011).