Ouabain
Ouabain er et hjerteglykosid, der hæmmer ATP-afhængig natrium-kaliumudveksling på tværs af cellemembraner. Bindingen af ouabain til natrium-kaliumpumpen (også kaldet Na+/K+ ATPase) forhindrer de konformationsændringer, der er nødvendige for dens korrekte funktion. Dette påvirker intracellulær ionsammensætning på forskellige måder med forskellige virkninger afhængigt af cellen og doseringen. Forbindelsen er derfor blevet anvendt i medicin, både som terapeutisk og i forskning relateret til aktiv aktiv membrantransport.
Målprotein: Na+ / K + ATPase

Na+/K+ ATPase transporterer aktivt kalium ind i cellen og natrium til det ekstracellulære rum i henhold til det generelle skema, der er afbildet nedenfor. Dette transmembranprotein består af tre underenheder, alfa, beta og gamma, der kan dimerisere med andre pumper in vivo. Krystalstrukturen er en radialt symmetrisk sekskamer, når proteinerne i levende væv sandsynligvis forbinder bilateralt. Alfa-kæden er vist i pink / blå og beta-kæden i gul / grøn. Af de to spiller alfa-underenheden den ledende rolle i proteinets funktion. Bundtet af alfa-helices i midten af proteinpositionen hydrofobe rester på ydersiden af motivet og åbner en portal gennem lipid-dobbeltlaget. Det er inde i dette transmembrane Domæne, at rester af alfa-underenheden koordinerer natrium-eller kaliumioner. Det store domæne på den cytoplasmatiske side af dobbeltlaget (længst væk fra beta-underenheden) flyder i opløsning og er ansvarlig for binding og hydrolysering af ATP. Som med mange proteiner af phosphoesterhydrolyse koordineres fosfatgrupperne med a . Energien frigivet fra højenergifosfatspaltning overføres via konformationsændringer til transmembrandomænet, hvor ioner tvinges mod deres koncentrationsgradient. På den ekstracellulære side bevæger sig for at forhindre dissociation af kaliumioner under deres indtræden i cellen. En tredje gamma-underenhed (lilla/orange) sammen med beta-underenheden bidrager til forankring af transmembrane domæner til phospholipid-dobbeltlaget.
normal funktion Na+ / K + ATPase ændres ensrettet mellem to faser, E1 og E2. I E1-fasen binder den Na+ og ATP på indersiden af cellen. Efter hydrolyse skubber det phosphorerede protein ADP ud og ændrer konformation til E2, hvilket gør det muligt for 3Na+ at dissociere på den ekstracellulære side af membranen. Proteinet binder derefter 2K+ og hydrolyserer det bundne uorganiske fosfat, hvilket forårsager reversion til E1. Lige før bindingen af K + til E2-tilstanden binder Ouabain sig til rester inde i pumpen, hvilket forhindrer overgangen tilbage til E1 (således at magnesiumkofaktoren koordinerer en ensymatisk bundet )
ouabain struktur og Binding
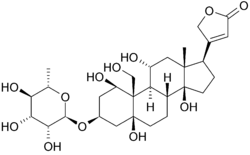
nedenfor er oubains struktur i to dimensioner. Molekylet består af et sukker bundet til et modificeret kolesterol ved en glycosidisk binding (dermed glycosid). De grupper, der omgiver en stor del af molekylet, sammen med esterne i begge ender, bidrager til dets binding til membranen bundet natrium-kalium pumpe. kan også ses i tre dimensioner. Med den molekylære geometri og stereokemi, der vises på denne måde, kan man tydeligere se fordelingen af polært kulstof-ilt og ikke-polært kulstof-kulstofbindinger i rummet omkring molekylet. Dette gør visualisering af bindingen af inhibitoren meget lettere. Ouabain er til proteinet langs indersiden af en alfa-spiralbundt. komponenter af rester hjælper noget med at koordinere ouabain gennem Van Der-kræfter, men rester, glutamin, asparaginsyre og threonin sammen med amidbindingen af en alanin omgiver ligandens hydroksyl-og carbonylgrupper og danner hydrogenbindinger på 2 til 4 Ångstrøm i længden. Dette holder ikke kun lægemidlet på plads, men forhindrer konformationsændring, der er nødvendig for proteinets funktion.
hjertemuskel-og Ionpumpehæmning
inhiberingen af Na+/K+ ATPase har indirekte virkninger på hjertemuskelcellernes kontraktile styrke eller inotrofi. Gennem stigningen i cytoplasmatisk natriumkoncentration aktiveres en natrium-calciumveksler, hvorved den cellulære koncentration af calcium øges. Calcium er en anden messenger i mange signal – /reguleringsveje. Dens frigivelse i cytoplasma af muskelceller signalerer sammentrækning, hvilket forklarer den positive virkning af lave doser af ouabain på hjerteintrofi. Billedet nedenfor viser denne effekt af alle hjerteglykosider på myokardvæv. Som det er vist, inhiberingen af natrium-kalium pumpe forårsager forhøjet cytoplasmatisk natrium, som aktiverer natrium-calcium pumpe forårsager i stigning i cytoplasmatisk calcium. Dette øger den kraft, som cellen kontraherer med.
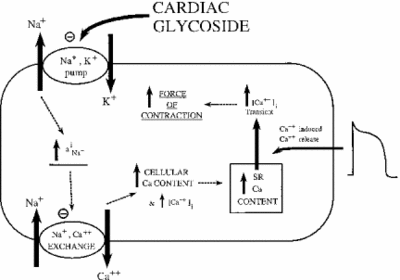
Hvis det doseres korrekt, viser ouabain sig at være effektivt til behandling af hjertesvigt og arytmier. Ouabain-aktivitet kan imidlertid indirekte bidrage til overbelastning af myokardceller med natrium. Passive Na + – kanaler inaktiveres normalt, når membranpotentialet er højest. Når de genåbner eller undlader at lukke, kan for meget natrium lække ind i cellen, hvilket forårsager de spildende udgifter til ATP og/eller ukoordineret muskelkontraktion. Dette kaldes sent i-Na. Med stigningen af natrium og calcium aktiveres en Ca2 + – calmodulinafhængig kinase, som igen phosphorylerer og aktiverer passive Na+ kanaler. Når virkningerne af ouabain forstærkes på denne måde, kan stoffet forårsage mere skade end godt. Forskning har vist, at en effektiv måde at bekæmpe sen i-Na er ved inhibering af den Ca2+-calmodulin-afhængige kinase (Hoyer et al. 2011).