Ouabaína
Ouabaína es un glucósido cardíaco que inhibe el intercambio sodio-potasio dependiente de ATP a través de las membranas celulares. La unión de ouabaína a la bomba de sodio y potasio (también llamada Na+/K+ ATPasa) evita los cambios conformacionales necesarios para su correcto funcionamiento. Esto afecta la composición de iones intracelulares de varias maneras con diversos efectos, dependiendo de la célula y la dosis. Por lo tanto, el compuesto se ha utilizado en medicina, tanto como terapéutico como en investigación relacionada con el transporte activo de membrana activa.
Proteína Diana: Na + / K + ATPasa

Na + / K + ATPasa transporta activamente potasio a la célula y sodio al espacio extracelular de acuerdo con el esquema general descrito a continuación. Esta proteína transmembrana se compone de tres subunidades, alfa, beta y gamma, que pueden dimerizarse con otras bombas in vivo. La estructura cristalina es un hexámero radialmente simétrico, cuando en tejidos vivos, las proteínas probablemente se asocian bilateralmente. La cadena alfa se muestra en rosa/azul y la cadena beta en amarillo/verde. De las dos, la subunidad alfa desempeña el papel principal en el funcionamiento de la proteína. El haz de hélices alfa en el centro de la proteína coloca residuos hidrófobos en el exterior del motivo, abriendo un portal a través de la bicapa lipídica. Es dentro de este dominio transmembrana que los residuos de la subunidad alfa coordinan iones de sodio o potasio. El dominio grande en el lado citoplasmático de la bicapa (más alejado de la subunidad beta) flota en solución y es responsable de la unión e hidrolización del ATP. Al igual que con muchas enzimas proteicas de hidrólisis de fosfoéster, los grupos fosfato se coordinan con a . La energía liberada por la escisión de fosfato de alta energía se transfiere a través de cambios conformacionales al dominio transmembrana, donde los iones se ven forzados contra su gradiente de concentración. En el lado extracelular, se mueve para evitar la disociación de iones de potasio durante su entrada en la célula. Una tercera subunidad gamma (púrpura / naranja), junto con la subunidad beta, contribuye al anclaje de los dominios transmembrana a la bicapa fosfolípida.
El funcionamiento normal de la ATPasa Na+/K + cambia unidireccionalmente entre dos fases, E1 y E2. En la fase E1, se une a Na+ y ATP en el interior de la célula. Después de la hidrólisis, la proteína fosforelada expulsa ADP y cambia la conformación a E2, permitiendo que 3Na+ se disocie en el lado extracelular de la membrana. La proteína luego se une a 2K+ e hidroliza el fosfato inorgánico unido, causando la reversión a E1. Justo antes de la unión de K+ al estado E2, la Ouabaína se une a los residuos dentro de la bomba, evitando la transición de regreso a E1 (por lo tanto, el cofactor de magnesio coordina una unión enzimática )
Estructura de Ouabaína y unión
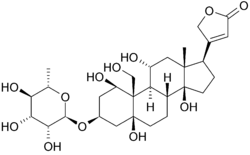
A continuación se muestra la estructura de oubain en dos dimensiones. La molécula consiste en un azúcar unido a un colesterol modificado por un enlace glucosídico (por lo tanto, glucósido). Los grupos hidroxilos que rodean gran parte de la molécula, junto con los ésteres en cada extremo, contribuyen a su unión a la bomba de sodio y potasio unida a la membrana. también se puede ver en tres dimensiones. Con la geometría molecular y la estereoquímica mostradas de esta manera, se puede ver más claramente la distribución de los enlaces carbono-oxígeno polares y carbono-carbono no polares en el espacio que rodea la molécula. Esto facilita mucho la visualización de la unión del inhibidor. La ouabaína es la proteína a lo largo del interior de un haz de hélice alfa. los componentes de los residuos ayudan en cierta medida a coordinar la ouabaína a través de las fuerzas de Van der Waals, pero los residuos, la glutamina, el ácido aspártico y la treonina, junto con el enlace amida de una alanina, rodean los grupos hidroxilo y carbonilo del ligando, formando enlaces de hidrógeno de 2 a 4 angstroms de longitud. Esto no solo mantiene el medicamento en su lugar, sino que previene el cambio conformacional necesario para la función de la proteína.
Inhibición del músculo cardíaco y de la Bomba de iones
La inhibición de la ATPasa Na+/K+ tiene efectos indirectos sobre la fuerza contráctil, o inotrofia, de las células del músculo cardíaco. A través del aumento de la concentración citoplasmática de sodio, se activa un intercambiador de sodio y calcio, aumentando así la concentración celular de calcio. El calcio es un segundo mensajero en muchas vías de señalización/regulación. Su liberación en el citoplasma de las células musculares indica contracción, lo que explica el efecto positivo de dosis bajas de ouabaína en la introfia cardíaca. La siguiente imagen muestra este efecto de todos los glucósidos cardíacos en el tejido miocárdico. Como se muestra, la inhibición de la bomba de sodio y potasio causa sodio citoplasmático elevado, que activa la bomba de sodio y calcio causando un aumento del calcio citoplasmático. Esto aumenta la fuerza con la que la célula se contrae.
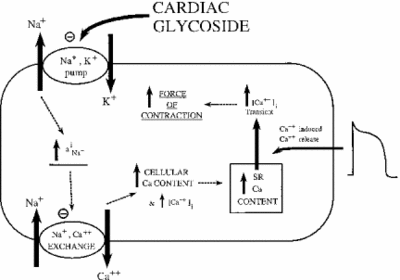
Si se dosifica correctamente, ouabaína demuestra ser eficaz en el tratamiento de la insuficiencia cardíaca y arritmias. Sin embargo, la actividad de la ouabaína puede contribuir indirectamente a la sobrecarga de sodio de las células miocárdicas. Los canales pasivos de Na+ generalmente se inactivan cuando el potencial de membrana está en su punto más alto. Cuando se vuelven a abrir o no se cierran, demasiado sodio puede filtrarse a la célula, causando el gasto derrochador de ATP y/o contracción muscular descoordinada. Esto se llama late I-Na. Con el aumento de sodio y calcio, se activa una quinasa dependiente de calmodulina Ca2+, a su vez fosforilando y activando canales pasivos de Na+. Cuando los efectos de la ouabaína se amplifican de esta manera, el medicamento puede causar más daño que bien. La investigación ha demostrado que una forma efectiva de combatir el I-Na tardío es mediante la inhibición de la cinasa dependiente de Ca2+-calmodulina (Hoyer et al. 2011).