rajat immunologiassa
- Johdanto
- T-ja B-Solulokerot ja kaksi tavanomaista Stroomasolun alaryhmää
- äskettäin tunnistettu strooman alajoukko, marginaaliset Retikulaarisolut
- MRCs: lle ja antigeenin Sisääntuloreitille Slos: issa
- MRC: t ja Järjestäjäsolut SLO: n kehityksessä
- MRCs: n ja muiden strooman osajoukkojen välinen suhde
- SLOs: n ja tertiääristen Lymfoidirakenteiden Remodelointi
- johtopäätös
- Eturistiriitalausunto
- kiitokset
Johdanto
sekundaariset imukudoselimet/kudokset (Slos) ovat välttämättömiä adaptiivisen immuunivasteen tehokkaalle induktiolle. Useat SLOs-tyypit, mukaan lukien imusolmukkeet (LNS), perna ja limakalvoihin liittyvät imukudokset (maltat), kuten Peyerin laastarit (PPs), on sijoitettu strategisesti eri paikkoihin kehossa. SLOs on monimutkainen suodatin, joka näytteitä antigeenejä ja on varustettu erittäin herkkä immuunisensorit. Ulkomaisten antigeenien keräämiseksi ja suodattamiseksi SLOs sisältää erikoistuneita kudosrakenteita, jotka liittyvät endoteeliin tai epiteeliin. Immuunisolut, kuten lymfosyytit, dendriittisolut (DCs) ja makrofagit, kerääntyvät tiheiksi ja muodostavat lokeroita. Merkittävä kaikille SLOs: ille yhteinen piirre on B-ja T-solujen eriytynyt lokalisointi. Slosin arkkitehtuuria tukevat useat mesenkymaalista alkuperää olevat Ei-hematopoieettiset stroomasolut, jotka rakentavat verkostoja ja määrittelevät lokeroita (Mueller and Germain, 2009; Roozendaal and Mebius, 2011). Stroomaverkostot tarjoavat paitsi toimivan jalansijan myös tilan immuunisolujen toiminnalle sekä fyysisen kehyksen kudokselle. Lisäksi kasvava näyttö osoittaa, että stroomasoluilla on myös kriittinen rooli immuunisolujen toiminnassa ja homeostaasissa (Link et al., 2007; Fletcher et al., 2010; Suzuki ym., 2010; Lukacs-Kornek ym., 2011). SLOs on ohjelmoitu kehittämään Anlagen, jotka tapahtuvat tietyissä paikoissa ja aikana rajoitetun ajan sikiössä ja imeväisessä. Lisäksi stroomasolujen tiedetään olevan tärkeitä SLO: n kehityksessä ja ylläpidossa (Mebius, 2003). Tässä keskityn äskettäin tunnistettuun strooman osajoukkoon, marginaalisiin retikulaarisiin soluihin (MRCS) ja tiivistän niiden ominaisuudet. Keskustelen myös MRCs: n ja kudosrakenteen, muiden strooman osajoukkojen ja immunologisten toimintojen välisestä suhteesta.
T-ja B-Solulokerot ja kaksi tavanomaista Stroomasolun alaryhmää
edellä kuvatulla tavalla B-ja T-solut paikallistuvat erillisiksi alueiksi SLOs: n sisällä. B-solut kerääntyvät munarakkuloiksi (B-vyöhykkeeksi) kapselin alla olevaan ulompaan aivokuoreen LNs: ssä tai pernan ulompaan periarteriolaariseen lymfoidivaippaan (PALS). PPS: n ydinkudosta on suurten munarakkuloiden rypäs. Immuunivasteen aikana follikkelien aktivoidut B-solut muodostavat itukeskuksia, joissa ne erilaistuvat korkean affiniteetin vasta-ainetuottajiksi (Cyster et al., 2000). Sen sijaan T-solut paikallistavat erilliselle alueelle (T-vyöhyke) munarakkuloiden vieressä, eli paracortexiin LNs: ssä, sisäisiin PALS: iin pernassa tai interfollikulaariseen alueeseen (IFR) PPs: ssä. DCs kerääntyy myös T-vyöhykkeelle esittämään antigeeni-ja prime-T-soluja (Steinman et al., 1997).
b-ja T-vyöhykkeillä on kaksi erilaista mesenkymaalisen strooman osajoukkoa (Kuva 1a). Follikulaariset dendriittisolut (FDCs) muodostavat tiheän verkoston munarakkuloiden keskellä ja ovat saaneet huomattavaa huomiota, koska niiden merkitys B-solujen vasta-ainetuotannossa (Tew et al., 1997; Kyster et al., 2000; Victoratos et al., 2006; Suzuki ym., 2010). FDCs express CR1 / CD35, CD23, ja joskus MAdCAM-1 (Szabo et al., 1997; Kyster et al., 2000). Sen sijaan monimutkainen fibroblastisten retikulaaristen solujen verkosto (FRCs) käsittää T-vyöhykkeen tukirangan, joka tuottaa podoplaniinia/gp38: aa ja erilaisia solunulkoisia matriisikomponentteja (Gretz et al., 1997; Luther ym., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). Yleensä immuunisolujen siirtymistä ja lokalisointia säätelevät erilaiset kemokiinit (Mackay, 2001). Lepäävät lymfosyytit ja kypsät DCs ovat erittäin herkkiä ”homeostatic kemokines” (Kyster, 1999; Müller et al 2003). Tämän mukaisesti on olemassa selviä korrelaatioita stroomasolujen subsetien tuottamien kemokiinien ja vastaavien reseptorien ilmentävien immuunisolujen lokalisoinnin välillä; FDCs: n tuottama CXCL13 on cxcr5: tä ilmentävien B-solujen houkutin, kun taas T-vyöhykkeeltä FRCs peräisin olevat CCL19 ja CCL21 houkuttelevat T-soluja ja kypsiä DCs: iä yhteisen reseptorin CCR7 (Cyster, 1999; Cyster et al., 2000; Luther ym., 2000). Lisäksi lymfosyytit, jotka vaeltavat voimakkaasti kudoksen parenkyma skannata antigeenejä ajatellaan käyttää stroomia verkkoja jalansijaa (Bajénoff et al 2006). Erilaisia tekijöitä tuottamia stroomal subsets tarvitaan myös aktivointi ja eloonjääminen immuunisolujen (Cyster et al., 2000; Huber ym., 2005; Link et al., 2007; Suzuki ym., 2010; Lukacs-Kornek ym., 2011; Malhotra et al., 2012). Siksi stroomaverkoston rakenne ja toiminta kussakin lokerossa on todennäköisesti optimoitu immuunisolun osajoukkojen toiminnalle.
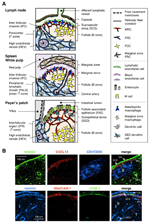
kuva 1. Stroomasolujen osajoukot ja kudosrakenteet SLOs. (A) kudosrakenteiden Kaavamainen esitys hiiren SLOs: issa painottaen stroomasoluja ja antigeenikuljetuslaitteistoa. Stroomia, kuten mesenkymaali -, Endoteeli-ja epiteelisoluja sekä myeloidisia soluja, kuten makrofageja ja dendriittisoluja (lueteltu oikeassa paneelissa), piirretään korostuksen vuoksi. B) Ylempi: kudoskehys, joka muodostuu kolmesta erityyppisestä stroomasolusta LN: n uloimmalla aivokuoren alueella. Fluoresoiva immunosisältö hiiren osassa. Ylemmässä micrograph, on pieni lepo follikkelia (B)ilman germinal center, joka tukee FDCs ilmentävät CR1/CD35 mutta havaitsematta cxcl13. Sen sijaan MRCs muodostaa laminiini+CXCL13+ retikulaarisen verkoston follikkelin ulkoreunaan kapselin (CA) ja SCS: n alle. FRCs: n paracortexissa (T) rakentama verkko on laminiini+CXCL13-CR1/CD35-. Alempi: MAdCAM-1+ MRC kerros liittyy läheisesti Lyve-1 + lymfaattinen endoteeli kerros SCS. Huomaa, että MRC-taso on laajennettu IFC-alueelle.
T-vyöhykkeen stroomaverkko koostuu FRCs: stä ja RETIKULAARISENA kuituna tunnetusta ECM-nipusta, joka muodostaa pienimolekyylisten aineiden (Gretz et al., 1997, 2000; Nolte et al., 2003). Tämä kanava kuljettaa erilaisia tekijöitä ja liukoisia antigeenejä syvällä kudoksessa, kun taas hiukkaset ja suuret molekyylit jäävät pääasiassa pois lymfosyyttien osastoista. Itse asiassa, lymph-kantamat kemokiinit perifeeristen kudosten kuljetetaan nopeasti high endoteeli venule kautta kanava hallita mobilisointi kiertävien solujen LNS (Palframan et al., 2001). Lisäksi jotkut resident DCs suoraan yhteyttä putki ja kaapata lymph kantamat antigeenit (Sixt et al., 2005).
äskettäin tunnistettu strooman alajoukko, marginaaliset Retikulaarisolut
LN-aivokuoren ulointa reunaa, aivan kapselin alapuolella, ympäröi subkapsulaarinen sinus (SCS; Kuva 1a). SCS: n luminaalipinta on lymfaattisten endoteelisolujen peitossa ja niiden kortikaalista puolta tukee kellarikalvo, jota kutsutaan ”lattiaksi” (Szakal et al., 1983). Erityisesti IFRS: n sisällä retikulaariset kuidut levittäytyvät lattiasta paracortexiin (Gretz et al., 1997). Tärkeää on, että follikkelien uloimmalla alueella havaitaan myös ohut kerros retikulaarista rakennetta. FRC-kaltaiset stroomasolut follikulaarisessa retikulumissa ilmentävät CXCL13: A ja MAdCAM-1: tä, mutta eivät ccl21: tä, mikä osoittaa, että nämä solut eroavat t-vyöhykkeestä FRCs, kun taas FDC-merkkiaine CR1/CD35 oli havaitsematta tai vain heikosti ilmaistu näissä soluissa (Katakai et al., 2008; kuvat 1B ja 2a). FDCs ei tuota retikulaarisia kuituja, ja näin ollen retikulaarinen merkkiaine ER-TR7 puuttuu käytännössä follikkelien keskeltä (Katakai et al., 2004a, b). Lisäksi subkapsulaarisen alueen retikulaarisolut ilmaisevat nimenomaan RANKL/TRANCE-bakteeria, joka on LN-kehityksen kannalta välttämätön TNF-perheen sytokiini (Dougall et al., 1999; Kong ym., 1999). Siksi näiden stroomasolujen ajateltiin olevan Uusi stroomaalinen osajoukko ja ne nimettiin marginaalisiksi retikulaarisiksi soluiksi (MRCs; Katakai et al., 2008). Huomattava on, että huomattava määrä CXCL13: a ilmaistaan perustuslaillisesti MRC: nä lepäävissä pienissä munarakkuloissa, vaikka FDCs ilmaisisi cxcl13: n pitoisuuksia, joita ei ole havaittavissa (Kuva 1B). On hyvin todettu, että pernan Pals: n ulkoreuna, erityisesti se, joka sijaitsee follikkelien yllä, rajautuu MAdCAM-1+ stroomakerrokseen. Solut, jotka muodostavat limakalvon kellarikalvon alla marginaalinen sinus (MS) myös ilmaista CXCL13 ja RANKL, mikä osoittaa, että nämä solut ovat eräänlainen MRCs (Katakai et al., 2008). Maltaissa MRCs: ää muistuttavat retikulaarisolut muodostavat verkoston subepitheliaalikupolin (SED) alueella juuri follikkeliin liittyvän epiteelin kellarikalvon alla (FAE; Katakai et al., 2008; Knoop et al., 2009). Yhdessä MRCs: n ajatellaan olevan strooman osajoukko, joka on yhteinen SLOs: lle, mutta joka eroaa FDCs: stä ja FRCs: stä.
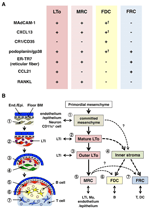
kuva 2. MRCs: n ja muiden Stroomasolujen osajoukkojen välinen suhde SLOs: ssä. (A) merkkiekspression malli strooman solun osajoukoissa. Madcam-1: n, CXCL13: n ja podoplaniinin/gp38: n ilmentymistasot FDCs: ssä ovat usein heikkoja tai havaitsemattomia immunohistokemian (†) avulla. (B) Schematic of a generated model of SLO development with the locations of stroomal cell subsets (left) and a putative genealogy of stroomal cell subsets (right). Numerot, jotka osoittavat solun elementtejä vasemmassa piirroksessa, edustavat strooman solun osajoukkoja, jotka on esitetty oikeassa kaaviossa. BM, kellarikalvo; loppu./ Epi., endoteeli-tai epiteelikerros.
MRCs: lle ja antigeenin Sisääntuloreitille Slos: issa
sekundaarisille lymfoidisille elimille on ominaista erikoinen rakenne, joka suodattaa ja kuljettaa antigeenejä lymfosyyttiosastoihin (Kuva 1a). LNs on yhteydessä imusuoniin, jotka kartoittavat lymfakiertoisia antigeenejä. Koska afferent lymphatics on avoin SCS: lle, sinus imunestejärjestelmän Endoteeli ja lattia kellarin kalvo ovat ikään kuin Ln-suodattimen etupinta. Perna suodattaa verta, jossa keskusvaltimon haarat avautuvat MS-ja marginaalivyöhykkeelle (MZ), jossa immuunisolut kartoittavat veren sisältöä. Näissä erikoistuneissa poskiontelorakenteissa rajaesteitä ovat imusuonen endoteeli LN: n SCS: ssä ja veren endoteeli pernan MS: ssä, joita molempia tukee MRC reticulum. Mielenkiintoista on, että CD169 + metallofiiliset makrofagit jakautuvat selektiivisesti lähellä sinusvuorausta munarakkuloiden päällä, joista osa asettuu endoteeliesteen yli ja välittää hiukkasantigeenejä sinus-lumenista lymfosyyttiosastoon (Szakal et al., 1983; Taylor ym., 2005; Carrasco and Batista, 2007; Phan et al., 2009). DCs, joka kuljettaa antigeenejä kudoksista imusuonten kautta, saapuu SCS: ään ja siirtyy sen jälkeen parakorteksiin interfollikulaarisen kanavan lattian poikki (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). Maltaissa EPÄIHMISET toimivat esteenä, jossa erikoistunut epiteelisolu nimeltä M-solut siirtävät bakteereja tai hiukkasia suolen luumenista taustalla oleviin DCs: ään tai makrofageihin (Kraehenbuhl and Neutra, 2000). Siksi MRCs tukee Frontline-antigeenikuljetuslaitteistoa jokaisessa SLO: ssa. SLOs: n perusrakenne on se, että munarakkulat ovat ensisijaisesti järjestyneet kohti antigeenin sisäänmenokohtaa ja niihin liittyy T-alueita. Strooman näkökulmasta koko kudosarkkitehtuuri näyttää siis järjestäytyneen kohti MRC-kerrosta.
vaikka MRCs: n immunologiset toiminnot ovat edelleen vaikeasti saavutettavissa, aiemmin osoitettiin, että MRCS: n rakentama kanavaverkko ulommassa follikkelissa kuljettaa pieniä liukoisia antigeenejä follikulaarisiin B-soluihin ja FDCs: iin (Bajénoff and Germain, 2009; Roozendaal et al., 2009). Useimmat CD169 + makrofagit sijaitsevat SCS-lattian aivokuoren puolella ja työntyvät sinus-lumeniin partikkelien vangitsemiseksi (Phan et al., 2009). Näin MRCs saattaa olla mukana näiden makrofagien lokalisoinnissa, morfologiassa ja toiminnassa. M-solujen kehitys PPs: ssä edellyttää RANKL-RANK-signalointia, jota todennäköisesti ohjaa RANKL-ilmentävä MRC-verkko aivan epäihmisten alapuolella (Knoop et al., 2009). Lt-polun estäminen, joka poistaa MRC-allekirjoitukset pernan valkoisessa massassa, häiritsee MS-rakennetta (Koike et al., 1996; Balogh ym., 2007; Katakai et al., 2008; Zindl ym., 2009). Lisäksi kohonneet ICAM-1, VCAM-1 ja CXCL13-lausekkeet viittaavat siihen, että MRCs osallistuu follikulaaristen B-solujen dynaamiseen interstitiaaliseen siirtymiseen toiminnallisena tukirakenteena. CD169 + makrofagien on osoitettu toimittavan hiukkasantigeenejä suoraan antigeenispesifisiin B-soluihin tällä alueella (Carrasco and Batista, 2007; Phan et al., 2009), mikä viittaa siihen, että MRC: n verkkovälitteinen B-solujen migraation valvonta voi vaikuttaa tähän prosessiin. Koska MRC: tä esiintyy myös IFC: n alueella, ne mahdollisesti säätelevät DCS: n siirtymistä SCS: stä kohti T-vyöhykettä.
MRC: t ja Järjestäjäsolut SLO: n kehityksessä
sekundaariset imukudossolut kehittyvät anlageenista, jotka ovat mesenkymaali-ja hematopoieettisten solujen aggregaatteja, jotka liittyvät verisuoniin tai epiteeliin, tietyssä kohdassa ja ajanjaksossa sikiössä tai lapsessa (Mebius, 2003). Kriittinen tapahtuma SLO-anlageenin kehityksessä on cd45+CD4+CD3 – hematopoieettisten solujen kertyminen, jotka tunnetaan myös lymfaattisen kudoksen indusoijasoluina (LTi), jotka ovat vuorovaikutuksessa mesenkymaalisten stroomasolujen kanssa, joita kutsutaan lymfaattisen kudoksen organisoijasoluiksi (LTo) (Mebius et al., 1997). TNF-perheen sytokiini, lymfotoksiini (LT)-α1β2, jota LTi-solut ilmentävät, lähettää Lt-β-reseptorin kautta signaaleja LTo-soluihin. LTo-solut indusoivat myöhemmin adheesiomolekyylien ilmentymistä, mukaan lukien ICAM-1, Vcam-1 ja MAdCAM-1 sekä kemokiinit CXCL13, CCL19 ja CCL21 (Honda et al., 2001; Cupedo ym., 2004a; Bénézech et al 2010). Erityisesti CXCL13 on erityisen tärkeä LTi-solujen houkuttelussa anlageenille reseptorinsa cxcr5 kautta (Finke et al., 2002; Luther ym., 2003; Ohl ym., 2003). Oletetaan, että positiivinen takaisinkytkentä, ts. vasta muuttaneet LTi-solut, jotka tuottavat LT: tä, aktivoivat LTo: n stroomasoluja edistäen anlagenin järjestämistä. Kun lymfosyytit alkoivat kertyä syntymän jälkeen, kudos laajenee ja eri stroomasolujen osajoukkojen tukemat lokerot indusoituvat (Cupedo et al., 2004b; Bajénoff ja Germain 2009).
marginaaliset retikulaarisolut ja LTo-solut ilmentävät hyvin samanlaista eri merkkiaineiden rakennetta (Kuva 2a), mikä viittaa siihen, että näiden kahden stroomasolun välillä on jonkinlainen yhteys. LTo-solut näyttävät keskittyvän enemmän oletetun SCS: n imunesteytimen vieressä olevan LN anlagenin marginaalialueelle (Finke et al., 2002; Cupedo ym., 2004a; Eberl et al., 2004; Katakai et al., 2008). Tämä LTo-solukerros näyttää laajenevan ulospäin anlageenin kasvun myötä, josta lopulta näyttää tulevan MRC-kerros (Katakai et al., 2008). Samoin lymfosyyttien kerääntyessä postnataalisen pernan keskusvaltimon ympärille Madcam-1: tä ja RANKL: ää ilmentävät LTo-solut laajenevat kerroksen mukana ja muuttuvat Valkoisessa massassa MRCs: ksi. Nämä havainnot viittaavat vahvasti siihen, että MRC: t ovat LTo-strooman suora jälkeläinen, joka säilyttää LTo-solujen ominaisuudet slosin erikoistuneissa paikoissa. Jopa RÄTTIPUUTTEISILLA hiirillä esiintyy subkapsulaarinen MRC-kerros atrofisissa LNS-ja kutistuneissa periarteriaalisissa MRC-vaipoissa pernassa, mikä osoittaa, että MRC-kehitys tapahtuu B-ja T-soluista riippumatta ja ohjelmoidaan ennen niiden kolonisaatiota (Katakai et al., 2008). Koska Slots tehokkaasti näyte antigeenejä laukaista immuunivasteen, antigeenia keräävät rakenteet, jotka rakentuvat kehityksen aikana on ylläpidettävä sen jälkeen. Näin ollen on järkevää, että näitä kudosrakenteita ylläpitävät järjestäjämäiset stroomasolut koko aikuisiän ajan.
MRCs: n ja muiden strooman osajoukkojen välinen suhde
Kuvassa 2b esitetään strooman osajoukkojen mahdollinen sukututkimus SLOs: ssä. Alkiossa verisuonen tai epiteelin läheisyydessä oleva alkumesenkyymi sitoutuu muodostamaan anlage-ytimen ja vetää puoleensa LTi-soluja. Myös hermosolut tai muut vähemmän tunnetut solut ovat mukana alkutekijöissä (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). LTi-solujen kertyminen helpottaa mesenkyymisolujen kypsymistä LTo-soluiksi, mikä lopulta helpottaa perusarkkitehtuurin rakentamista. Tyypillisesti LTo-solut pyrkivät keskittymään Anlagen reuna-alueelle ja laajentamaan ulospäin kudoksen kasvun myötä, kun taas stroomasolut, joissa esiintyy heikkoja tai ei LTo-allekirjoituksia, kasvavat vastaavasti Anlagen sisäosassa. B-ja T-solujen postnataalinen kolonisaatio johtaa lokeroihin tavanomaisten strooman osajoukkojen induktiolla.
Jos tämä kaava pitää paikkansa, siitä seuraa, että kaikki aikuisten Sloo-solujen strooman osajoukot ovat alun perin peräisin LTo-soluista. Onko LTo-solujen ominaisuudet säilyttävillä MRCs: llä siis kyky erottautua FDCs: ksi tai FRCs: ksi? MRC: t jakavat monia allekirjoituksia muiden osajoukkojen kanssa (kuva 2a), mikä viittaa siihen, että tämä on mahdollista. Yksi spekulaatio on, että MRCs toimivat strooman kantasoluja, jotka jatkuvasti toimittaa kaikki strooman subsets koko aikuisuuden. Vaikka tämä ajatus on kiehtova, se vaatii varovaista harkintaa ja vahvistamista tulevaisuudessa. Mesenkyymisolut ovat yleensä luonteeltaan hyvin joustavia ympäröivästä ympäristöstä riippuen, ja siten erityispiirteitä voidaan helposti muuttaa. LNS: stä eristettyjen stroomasolujen laajennettu viljely johtaa monien geenien, erityisesti homeostaattisten kemokiinien, ekspression menetykseen (Katakai et al., 2004a; Tomei et al., 2009). Tämä viittaa siihen, että stroomasolujen osajoukkojen in vivo-fenotyypit säilyvät optimaalisesti kudosolosuhteissa, jotka ovat palautuvia eivätkä johdu terminaalisesta erilaistumisesta. Lisäksi tulehdusärsykkeet aiheuttavat stroomasolujen voimakasta lisääntymistä ja Slos: n dramaattista remodelaatiota (Katakai et al., 2004a; Chyou et al., 2011). Näin ollen, vaikka MRC: t voitaisiin muuntaa toisiksi osajoukoiksi, perinteiset strooman osajoukot saattavat myös uusiutua itsestään ja olla vaihdettavissa aikuisissa SLOs: issa.
SLOs: n ja tertiääristen Lymfoidirakenteiden Remodelointi
immuunivasteen aikana SLOs: n sisällä olevat stroomarakenteet luutuvat dramaattisesti (Gretz et al., 1997; Katakai et al., 2004a). Jotkut infektiot aiheuttavat vakavia häiriöitä kudosrakenteisiin LNS ja perna valkoinen massa muutaman päivän, joka palautuu, kun taudinaiheuttajat ovat hävitetty (Mueller et al., 2007a, b; Scandella et al., 2008; St John and Abraham, 2009). Tämä restaurointiprosessi todennäköisesti kertautuu itseorganisoituvaan prosessiin SLO: n kehitystä muistuttavan takaisinkytkentäreaktion kautta. Tärkeää on, että LTi: n kaltaisia soluja on myös aikuisten kudoksissa ja säätelevät infektioon liittyvää Slos: n remodelaatiota (Kim et al., 2003; Scandella et al., 2008). Vaikka MRCs: n roolia tällaisissa prosesseissa ei tunneta, niillä on mahdollisesti organisointirooli yhteistyössä LTi: n kaltaisten solujen kanssa ja ne määrittävät slosin ulkorungon rekonstruktion aikana.
kroonisessa tulehduksessa, joka liittyy erilaisiin elimellisiin patologioihin, suuri määrä soluttautuvia lymfosyyttejä johtaa usein organisaatioihin, jotka ovat samanlaisia kuin Slos eli tertiääriset imukudokset (TLTs; Drayton et al., 2006). B-ja T-solut ovat eriytyneet ja vastaavat stroomasolujen osajoukkojen verkostot indusoituvat. Olisi mielenkiintoista selvittää, onko MRC: t läsnä näissä kohdunulkoisissa imukudosrakenteissa; kuitenkin MRC: n kaltaisia soluja ja niihin liittyviä kudosrakenteita ei havaita tlts: ssä, jotka kehittyivät hiiren autoimmuunigastriitin aikana (Katakai et al., 2006, 2008). On korostettava, että TLT: t eivät pohjimmiltaan ole ohjelmoituja lymfaattisia organisaatioita, eivätkä ne luonnollisestikaan liity antigeenia kuljettaviin rakenteisiin. Tämän vuoksi MRC: t todennäköisesti puuttuvat TLTs: stä. Vaikka Stroomasolut, jotka ovat Fenotyypiltään samanlaisia kuin MRCs: t, saattavat indusoitua joissakin leesioissa, niitä ei tunnisteta MRCs: ksi, elleivät ne liity läheisesti tiettyyn endoteeli-tai epiteelirakenteeseen ja muodosta kerrostunutta retikkeliä ulompien munarakkuloiden kohdalla.
johtopäätös
marginaaliset retikulaarisolut ovat ainutlaatuinen Stroomasolujen osajoukko, joka on yhteinen SLOs: lle. MRC: t eroavat selvästi tavanomaisista osajoukoista, jotka indusoituvat tai kypsyvät lymfosyyttien kanssa syntyneiden vuorovaikutusten kautta syntymän jälkeen ja ovat suoraan peräisin Anlageenissa olevista LTo-stroomasoluista ja lymfosyyteistä riippumattomia. MRCs-verkosto liittyy läheisesti Slos: n antigeenikuljetuslaitteistoon, ja sen ajatellaan suoraan tai välillisesti valvovan antigeenin toimitusta lymfosyyttien lokeroihin sekä immuunisolujen lokalisointia ja siirtymistä. MRC: llä on todennäköisesti keskeinen rooli SLO: n rakenteiden ylläpitämisessä ulkokehyksenä, ja se voidaan muuntaa toisiksi stroomaalisiksi osajoukoiksi vakaassa tilassa tai kudosmuutoksen aikana. On tärkeää ottaa kollektiivisesti huomioon kaikki strooman osajoukot, kudosrakenteet ja immunologiset mikroympäristöt, jotta SLO-järjestelmä voidaan ymmärtää kattavasti.
Eturistiriitalausunto
kirjoittaja vakuuttaa, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisiksi eturistiriidoiksi.
kiitokset
tätä työtä tuettiin osittain Japanin opetus -, kulttuuri -, urheilu -, tiede-ja teknologiaministeriön myöntämällä apurahalla nuorelle tutkijalle ja innovatiivisten alojen tieteelliselle tutkimukselle.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N., and Germain, R. N. (2006). Stroomasoluverkot säätelevät lymfosyyttien tuloa, migraatiota ja alueellisuutta imusolmukkeissa. Syytesuoja 25, 989-1001.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bajénoff, M., and Germain, R. N. (2009). B-solujen follikkelin kehitys uudistaa kanavointijärjestelmää ja mahdollistaa liukoisen antigeenin toimituksen follikulaarisiin dendriittisoluihin. Blood 114, 4989-4997.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, H. H., and Weih, F. (2007). Lymfotoksiini-beeta-signaloinnin ja homeodomiinitranskriptiotekijän nkx2.3 erilliset roolit pernan endoteeliosastojen ontogeniassa. Cell Tissue Res. 328, 473-486.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., and Caamaño, J. H. (2010). Strooman järjestäjäsolujen ontogenia imusolmukekehityksen aikana. J. Immunol. 184, 4521–4530.
Pubmed Abstract/Pubmed kokoteksti
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Münk, A., and Förster, R. (2011). Afferentit lymfaperäiset T-solut ja DCs käyttävät erilaisia kemokiinireseptorista CCR7 riippuvia reittejä imusolmukkeeseen ja intranodaaliseen siirtymiseen. Nat. Immunol. 12, 879–887.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Carrasco, Y. R., and Batista, F. D. (2007). B-solut hankkivat partikkeliantigeenin makrofagipitoisella alueella follikkelin ja imusolmukkeen subkapsulaarisen poskiontelon rajalla. Immuniteetti 27, 160-171.
Pubmed Abstract / Pubmed kokoteksti/CrossRef kokoteksti
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M., and Lu, T. T. (2011). Imusolmukkeen verisuonten-strooman kasvun koordinoitu säätely ensin CD11c+ – soluissa ja sitten T-ja B-soluissa. J. Immunol. 187, 5558–5567.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., and Mebius, R. E. (2004a). Oletetut imusolmukejärjestäjät ovat eri tavoin edustettuina kehittäessään suoliliepeitä ja perifeerisiä solmuja. J. Immunol. 173, 2968–2975.
Pubmed Abstract/Pubmed kokoteksti
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Kyster, J. G., and Mebius, R. E. (2004b). Solujen järjestäytymistä imusolmukkeissa säätelevät Ei-B-soluista saadut signaalit, eikä se ole riippuvainen CXC-kemokiiniligandista 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract/Pubmed kokoteksti
Kyster, J. G. (1999). Kemokiinit ja solumuutto sekundaarisissa lymfoidisissa elimissä. Science 286, 2098-2102.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Kyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A., and Ngo, V. N. (2000). Follikulaariset stroomasolut ja lymfosyytit kiinnittyvät munarakkuloihin. Immunol. Ilm. 176: 181-193.
Pubmed Abstract | Pubmed kokoteksti | CrossRef kokoteksti
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J., and Schuh, J. (1999). Arvojärjestys on välttämätön osteoklastien ja imusolmukkeiden kehitykselle. Genes Dev. 13, 2412–2424.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Drayton, D. L., Liao, S., Mounzer, R. H., and Ruddle, N. H. (2006). Lymfaattisen elimen kehitys: ontogeniasta neogeneesiin. Nat. Immunol. 7, 344–353.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y., and Littman, D. R. (2004). Ydinreseptorin Rory(t) olennainen tehtävä sikiön imukudosta indusoivien solujen tuotannossa. Nat. Immunol. 5, 64–73.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M., and Kraehenbuhl, J. (2002). CD4+CD3-solut indusoivat Peyerin laastarikehitystä: α4β1-integriinin aktivaation rooli CXCR5: llä. Syytesuoja 17, 363-373.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, M. S., Collier, A. R., Boyd, R. L., and Turley, S. J. (2010). Imusolmukesolun fibroblastiset retikulaarisolut esittävät suoraan perifeerisen kudoksen antigeenia vakaassa tilassa ja tulehdustilassa. Käyt. Viim. Med. 207, 689–697.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Anderson, A. O., and Shaw, S. (1997). Cords, channels, corridors and conduits: critical architectural elements helping cell interactions in the lymph node cortex. Immunol. Rev. 156, 11-24.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., and Shaw, S. (2000). Lymph-borne kemokines ja muut pienimolekyyliset molekyylit saavuttavat korkean endoteelin venules kautta erikoistuneita putkia, kun taas toiminnallinen este rajoittaa pääsyä lymfosyyttien mikroympäristöjen imusolmuke cortex. Käyt. Viim. Med. 192, 1425–1440.
Pubmed Abstract / Pubmed kokoteksti / CrossRef kokoteksti
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., and Nishikawa, S.-I. (2001). Hematopoieettisen / mesenkymaalisen yhteisvaikutuksen molekyylipohjainen perusta Peyerin laastari-organogeneesin aloittamisen aikana. Käyt. Viim. Med. 193, 621–630.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G., and Aguzzi, A. (2005). Lymfotoksiini-β-reseptoreista riippuvaiset geenit imusolmukkeissa ja follikulaarisissa dendriittisolukopioijissa. J. Immunol. 174, 5526–5536.
Pubmed Abstract/Pubmed Full Text
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., and Shaw, S. (2001). Lymph node T cell cortex: a spatial and molecular organization of lymph node T cell cortex: a labyrinthine onkalo, jota rajoittaa epiteelin kaltainen yksikerros fibroblastisia retikulaarisia soluja, jotka on ankkuroitu kellarin kalvomaiseen solunulkoiseen matriisiin. Int. Immunol. 13, 1243–1253.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Sugai, M., Gonda, H., and Shimizu, A. (2004a). Imusolmukesolun fibroblastiset retikulaarisolut rakentavat strooman retikulumin kontaktissa lymfosyyttien kanssa. Käyt. Viim. Med. 200, 783–795.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M., and Shimizu, A. (2004b). A novel reticular stroomal structure in lymph node cortex: an immuno-platform for interactions among Dendritic cells, T cells and B cells. Int. Immunol. 16, 1133–1142.
Pubmed Abstract | Pubmed kokoteksti | CrossRef kokoteksti
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S., and Shimizu, A. (2006). Spontaani laajamittainen lymfoidinen neogeneesi ja tasapainoinen autoimmuunitauti verrattuna toleranssiin H+/K+-ATPaasi-reaktiivisella TCR-siirtogeenisellä hiirellä. J. Immunol. 177, 7858–7867.
Pubmed Abstract/Pubmed kokoteksti
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., and Shimizu, A. (2008). Järjestäjämäinen retikulaarinen stroomasolukerros, joka on yhteinen aikuisten sekundaarisille imukudoselimille. J. Immunol. 181, 6189–6200.
Pubmed Abstract/Pubmed kokoteksti
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, M. D., and Lane, P. J. (2003). CD4+ CD3-lisälaitteiset solut aktivoivat pohjustettuja CD4 T-soluja OX40: n ja CD30: n kautta paikoissa, joissa T-solut tekevät yhteistyötä B-solujen kanssa. Immuniteetti 18, 643-654.
Pubmed Abstract | Pubmed kokoteksti | CrossRef kokoteksti
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., nochi, T., Akiba, H., Yagita, H., Kiyono, H., and Williams, I. R. (2009). RANKL on välttämätön ja riittävä käynnistämään antigeeninäytteenoton m-solujen kehittyminen suolen epiteelissä. J. Immunol. 183, 5738–5747.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Watanabe, T., Miyawaki, S., and Miyasaka, M. (1996). Pernan reunavyöhykettä ei esiinny alymfoplastisilla aly-mutanteilla hiirillä. Euro. J. Immunol. 26, 669–675.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J., and Penninger, J. M. (1999). OPGL on keskeinen osteoklastogeneesin, lymfosyyttien kehityksen ja imusolmukesolmun organogeneesin säätelijä. Luonto 397, 315-323.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kraehenbuhl, J. P., and Neutra, M. R. (2000). Epiteelisolujen m: erilaistuminen ja toiminta. Annu. Pastori Cell Dev. Biol. 16, 301–332.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Link, A., Vogt, tk, Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Kyster, J. G., and Luther, S. A. (2007). Imusolmukkeiden fibroblastiset retikulaarisolut säätelevät naiivien T-solujen homeostaasia. Nat. Immunol. 8, 1255–1265.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., and Turley, S. J. (2011). Nonhematopoieettisen strooman aiheuttama typpioksidin säännelty vapautuminen kontrolloi aktivoidun T-solualtaan laajenemista imusolmukkeissa. Nat. Immunol. 12, 1096–1104.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G., and Kyster, J. G. (2000). Kemokiinien ELC ja SLC yhteisekspressio T-vyöhykkeen stroomasoluilla ja ELC-geenin poisto PLT/plt-hiirellä. Proc. Natl. Acad. Sci. USA 97, 12694-12699.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Luther, S. A., Ansel, K. M., ja Kyster, J. G. (2003). Cxcl13: n, interleukiini 7-reseptorin α: n ja CCR7-ligandien päällekkäiset roolit imusolmukkeiden kehityksessä. Käyt. Viim. Med. 197, 1191–1198.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mackay, C. R. (2001). Kemokiinit: immunologian korkeat vaikutustekijät. Nat. Immunol. 2, 95–101.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J., and the Immunological Genome Project Consortium. (2012). Transkriptionaalinen profilointi strooman tulehtuneista ja lepäävistä imusolmukkeista määrittelee immunologiset tunnusmerkit. Nat. Immunol. 13, 499–510.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mebius, R. E., Rennert, P., and Weissman, I. L. (1997). Kehittyvät imusolmukkeet keräävät CD4+ CD3-LTß+ – soluja, jotka voivat erilaistua APC -, NK-soluiksi ja follikulaarisoluiksi, mutta eivät T-tai B-soluiksi. Immuniteetti 7, 493-504.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mebius, R. E. (2003). Imukudosten organogeneesi. Nat. Rev. Immunol. 3, 292–303.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., and Matloubian, M. (2007a). Homeostaattisen kemokiiniekspression ja solukaupan säätely immuunivasteiden aikana. Science 317, 670-674.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., and Ahmed, R. (2007B). Viruksen kohdistaminen fibroblastisiin retikulaarisiin soluihin edistää immunosuppressiota ja sen pysyvyyttä kroonisen infektion aikana. Proc. Natl. Acad. Sci. 104, 15430-15435.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., and Germain, R. N. (2009). Stroomasolu edistää immuunijärjestelmän homeostaasia ja toimivuutta. Nat. Rev. Immunol. 9, 618–629.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Müller, G., Höpken, U. E., and Lipp, M. (2003). Ccr7: n ja CXCR5: n vaikutus lymfaattisen elimen kehitykseen ja systeemiseen immuniteettiin. Immunol. Rev. 195, 117-135.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., and Mebius, R. E. (2003). Johdinjärjestelmä jakaa kemokiinit ja pienet veren mukana kulkeutuvat molekyylit pernan valkoisen massan läpi. Käyt. Viim. Med. 198, 505–512.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., and Förster, R. (2003). Cxcr5: n ja CCR7: n yhteistyömekanismit sekundaaristen lymfaattisten elinten kehittämisessä ja järjestämisessä. Käyt. Viim. Med. 197, 1199–1204.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A., and von Andrian, U. H. (2001). Tulehduksellinen kemokiini kuljetus ja esitys HEV: kauko-ohjaus mekanismi monosyyttien rekrytointi imusolmukkeiden tulehtunut kudoksia. Käyt. Viim. Med. 194, 1361–1373.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Phan, T. G., Green, J. A., Gray, E. E., Xu, Y., and Kyster, J. G. (2009). Immuunikompleksi relay subcapsular sinus makrofagit ja noncognate B solut ajaa vasta affiniteetti kypsymistä. Nat. Immunol. 10, 786–793.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Roozendaal, R., Mempel, T. R., Pitcher, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H., and Carroll, M. C. (2009). Putket välittävät pienimolekyylipainoisen antigeenin kulkeutumista imusolmuketupen follikkeleihin. Immuniteetti 30, 264-276.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Roozendaal, R., and Mebius, R. E. (2011). Stroomasolujen ja immuunisolujen yhteisvaikutukset. Annu. Rev. Immunol. 29, 23–43.
Pubmed Abstract | Pubmed kokoteksti | CrossRef kokoteksti
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, Sa, Junt, T., and Ludewig, B. (2008). Lymfaattisen elimen eheyden palauttaminen imukudosta indusoivien solujen ja T-soluvyöhykkeen strooman vuorovaikutuksen avulla. Nat. Immunol. 9, 667–675.
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B., and Sorokin, L. (2005). Kanavajärjestelmä kuljettaa liukoisia antigeenejä afferentista imusolmukkeesta imusolmuke-t-solualueen dendriittisoluihin. Syytesuoja 22, 19-29.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Steinman, R. M., Pack, M., and Inaba, K. (1997). Dendriittisoluja lymfaattisten elinten t-solualueilla. Immunol. Rev. 156, 25-37.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
St John, A. L., and Abraham, S. N. (2009). Salmonella häiritsee imusolmukearkkitehtuuria tlr4-välitteisellä homeostaattisten kemokiinien tukahduttamisella. Nat. Med. 15, 1259–1265.
Pubmed Abstract | Pubmed kokoteksti | CrossRef kokoteksti
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W., and Fagarasan, S. (2010). Ympäristön ärsykkeiden aistiminen follikulaaristen dendriittisolujen avulla edistää immunoglobuliini A: n sukupolvea suolistossa. Syytesuoja 33, 71-83.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Szabo, M. C., Butcher, E. C., and McEvoy, L. M. (1997). Limakalvon follikulaaristen dendriittisolujen erikoistuminen, joka ilmenee limakalvon adheesiomolekyyli-1-näytöllä. J. Immunol. 158, 5584–5588.
Pubmed Abstract / Pubmed kokoteksti
Szakal, A. K., Holmes, K. L., and Tew, J. G. (1983). Immuunikompleksien kuljetus subkapsulaarisesta sinuksesta ei-fagosyyttisten solujen, mukaan lukien dendriittimorfologiset solut, pinnalla oleviin imusolmuketupiin. J. Immunol. 131, 1714–1727.
Pubmed Abstract/Pubmed kokoteksti
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., and Gordon, S. (2005). Makrofagireseptorit ja immuunivaste. Annu. Rev. Immunol. 23, 901–944.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., and Szakal, A. K. (1997). Follikulaariset dendriittisolut ja antigeenin ja kostimulatoristen signaalien esittäminen B-soluille. Immunol. Rev. 156, 39-52.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A., and Swartz, M. A. (2009). Fluid flow säätelee strooman solujen organisaatiota ja CCL21-ilmentymistä kudosmuokkatussa imusolmukemikroympäristössä. J. Immunol. 183, 4273–4283.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
van de Pavert, S. A., Olivier, B. J., Governse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., de Jonge, W. J., and Mebius, R. E. (2009). Kemokiini CXCL13 on välttämätön imusolmukesolun aloittamiselle ja indusoituu retinoiinihapon ja hermosolujen stimulaation vaikutuksesta. Nat. Immunol. 10, 1193–1199.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., and Kioussis, D. (2007). Tyrosiinikinaasireseptori RET on Peyerin laastari-organogeneesin keskeinen säätelijä. Nature 446, 547-551.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., and Kollias, G. (2006). FDC-spesifiset p55tnfr: n ja IKK2: n toiminnot FDC-verkkojen ja vasta-ainevasteiden kehittämisessä. Syytesuoja 24, 65-77.
Pubmed Abstract / Pubmed kokoteksti/CrossRef kokoteksti
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D., and Chaplin, D. D. (2009). Lymfotoksiini LTa1ß2 säätelee postnataalista ja aikuisen pernan marginaalista sinus-verisuonten rakennetta ja toimintaa. Immuniteetti 30, 408-420.
Pubmed Abstrakti / Pubmed kokoteksti / CrossRef kokoteksti