Frontiere in Immunologia
- Introduzione
- Compartimenti di cellule T e B e due sottoinsiemi di cellule stromali convenzionali
- Un sottoinsieme stromale appena identificato, cellule reticolari marginali
- Gli MRC e la via di ingresso dell’antigene negli SLOs
- MRCs e cellule stromali dell’organizzatore nello sviluppo di SLO
- Relazione tra MRC e altri sottoinsiemi stromali
- Rimodellamento degli SLOs e delle strutture linfoidi terziarie
- Conclusione
- Dichiarazione sul conflitto di interessi
- Riconoscimenti
Introduzione
Gli organi/tessuti linfoidi secondari (SLO) sono essenziali per l’induzione efficiente delle risposte immunitarie adattive. Diversi tipi di SLOs, inclusi i linfonodi (LNs), la milza e i tessuti linfoidi associati alla mucosa (MALTI) come i cerotti di Peyer (PPs), sono posizionati strategicamente in vari punti all’interno del corpo. Gli SLOS sono un filtro elaborato che campiona gli antigeni ed è dotato di sensori immunitari altamente sensibili. Al fine di raccogliere e filtrare antigeni estranei, gli SLOS contengono strutture tissutali specializzate associate all’endotelio o all’epitelio. Le cellule immunitarie come linfociti, cellule dendritiche (DCS) e macrofagi si accumulano ad alte densità e formano compartimenti. Una caratteristica notevole comune a tutti gli SLOs è la localizzazione segregata delle cellule B e delle cellule T. L’architettura di SLOs è supportata da diversi tipi di cellule stromali non ematopoietiche di origine mesenchimale, che costruiscono reti e definiscono compartimenti (Mueller e Germain, 2009; Roozendaal e Mebius, 2011). Le reti stromali forniscono non solo un punto d’appoggio funzionale, ma anche uno spazio per le attività delle cellule immunitarie, nonché una struttura fisica per il tessuto. Inoltre, prove crescenti indicano che le cellule stromali svolgono anche ruoli critici nella funzione delle cellule immunitarie e nell’omeostasi (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). Gli SLOS sono programmati per svilupparsi dall’anlagen che si verifica in determinati luoghi e durante periodi ristretti nel feto e nel neonato. Inoltre, le cellule stromali sono note per essere importanti per lo sviluppo e il mantenimento di SLO (Mebius, 2003). Qui, mi concentro su un sottoinsieme stromale recentemente identificato, le cellule reticolari marginali (MRC) e riassumo le loro caratteristiche. Discuto anche la relazione tra MRC e struttura tissutale, altri sottoinsiemi stromali e funzioni immunologiche.
Compartimenti di cellule T e B e due sottoinsiemi di cellule stromali convenzionali
Come descritto sopra, le cellule B e le cellule T si localizzano in regioni distinte all’interno di SLO. Le cellule B si accumulano per formare follicoli (zona B) nella corteccia esterna sotto la capsula in LNs o nella guaina linfoide periarteriolare esterna (PALS) nella milza. Un gruppo di grandi follicoli è il tessuto principale di PPs. Durante le risposte immunitarie, le cellule B attivate nei follicoli formano centri germinali, dove si differenziano in produttori di anticorpi ad alta affinità (Cyster et al., 2000). Al contrario, le cellule T si localizzano in un’area separata (zona T) adiacente ai follicoli, cioè la paracorteccia in LNs, gli AMICI interni nella milza o la regione interfollicolare (IFR) in PPs. I DCS si accumulano anche nella zona T per presentare l’antigene e le cellule T prime (Steinman et al., 1997).
Esistono due diversi tipi di sottoinsiemi stromali mesenchimali nelle zone B e T (Figura 1A). Le cellule dendritiche follicolari (FDCS) formano una fitta rete al centro dei follicoli e hanno ricevuto una notevole attenzione a causa della loro importanza nella produzione di anticorpi da parte delle cellule B (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). FDCs express CR1 / CD35, CD23 e occasionalmente MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Al contrario, un’elaborata rete di cellule reticolari fibroblastiche (FRCS) comprende l’impalcatura della zona T, che produce podoplanina/gp38 e vari componenti della matrice extracellulare (ECM) (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al.,2004 bis, b). In generale, la migrazione e la localizzazione delle cellule immunitarie sono regolate da una varietà di chemochine (Mackay, 2001). I linfociti a riposo e i DCS maturi sono altamente reattivi alle “chemochine omeostatiche” (Cyster, 1999; Müller et al 2003). Coerentemente con questo, ci sono chiare correlazioni tra chemochine prodotte da cellule stromali sottoinsiemi e la localizzazione del sistema immunitario le cellule che esprimono i recettori corrispondenti; CXCL13 prodotto da Fdc è un attrattivo di cellule B che esprimono CXCR5, mentre CCL19 e CCL21 dalla zona T FRCs attirare le cellule T mature e DCs, attraverso la comune recettore CCR7 (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Inoltre, si pensa che i linfociti che migrano in modo robusto nel parenchima tissutale per scansionare gli antigeni utilizzino le reti stromali come punto d’appoggio (Bajénoff et al 2006). Una varietà di fattori prodotti da sottoinsiemi stromali sono anche necessari per l’attivazione e la sopravvivenza delle cellule immunitarie (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Pertanto, la struttura e la funzione della rete stromale in ciascun compartimento sono probabilmente ottimizzate per l’attività dei sottoinsiemi di cellule immunitarie.
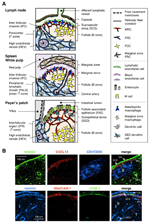
FIGURA 1. Sottoinsiemi di cellule stromali e strutture tissutali di SLOs. (A) Rappresentazione schematica delle strutture tissutali in SLOS di topo, con particolare attenzione alle cellule stromali e all’apparato che trasporta l’antigene. Gli elementi stromali, tra cui le cellule mesenchimali, endoteliali ed epiteliali, nonché le cellule mieloidi come i macrofagi e le cellule dendritiche (elencate nel pannello di destra), sono disegnati per l’enfasi. (B) Superiore: La struttura del tessuto costruita da tre diversi tipi di cellule stromali nella regione corticale esterna di LN. Immunostaining fluorescente di una sezione di LN del topo. Nel micrografo superiore, c’è un piccolo follicolo a riposo (B) senza un centro germinale, che è supportato da FDCS che esprimono CR1/CD35 ma livelli non rilevabili di CXCL13. Invece, MRCS formano una rete reticolare laminina + CXCL13 + nel bordo esterno del follicolo sotto la capsula (CA) e SCS. La rete costruita da FRCs nel paracortex (T) è laminin+CXCL13-CR1/CD35-. Inferiore: lo strato MAdCAM-1+ MRC è strettamente associato allo strato endoteliale linfatico LYVE-1 + nel SCS. Si noti che il livello MRC è esteso all’area IFC.
La rete stromale nella zona T è composta da FRCS e un fascio ECM noto come fibra reticolare, che forma un “condotto” che facilita il passaggio di sostanze a basso peso molecolare (Gretz et al., 1997, 2000; Nolte et al., 2003). Questo condotto trasporta vari fattori e antigeni solubili in profondità all’interno del tessuto, mentre le particelle e le grandi molecole sono prevalentemente escluse dai compartimenti linfocitari. Infatti, le chemochine trasmesse dai tessuti periferici vengono rapidamente trasportate alla venula endoteliale alta attraverso il condotto per controllare la mobilizzazione delle cellule circolanti nel LNs (Palframan et al., 2001). Inoltre, alcuni DCS residenti contattano direttamente il condotto e catturano gli antigeni linfatici (Sixt et al., 2005).
Un sottoinsieme stromale appena identificato, cellule reticolari marginali
Il margine esterno della corteccia LN, appena sotto la capsula, è circondato dal seno subcapsulare (SCS; Figura 1A). La superficie luminale del SCS è ricoperta da cellule endoteliali linfatiche e il loro lato corticale è sostenuto dalla membrana basale, chiamata “pavimento” (Szakal et al., 1983). In particolare all’interno degli IFRs, le fibre reticolari si diffondono dal pavimento nella paracorteccia (Gretz et al., 1997). È importante sottolineare che un sottile strato di struttura reticolare si osserva anche nella regione più esterna dei follicoli. Le cellule stromali simili a FRC nel reticolo follicolare esprimono CXCL13 e MAdCAM-1 ma non CCL21, il che indica che queste cellule sono distinte dalla zona T FRCs, mentre il marcatore FDC CR1/CD35 non è stato rilevato o solo debolmente espresso in queste cellule (Katakai et al., 2008; Figure 1B e 2A). Le FDC non generano fibre reticolari e, di conseguenza, il marcatore reticolare ER-TR7 è praticamente assente al centro dei follicoli (Katakai et al.,2004 bis, b). Inoltre, le cellule reticolari nella regione subcapsulare esprimono specificamente RANKL / TRANCE, che è una citochina della famiglia TNF che è essenziale per lo sviluppo LN (Dougall et al., 1999; Kong et al., 1999). Pertanto, si pensava che queste cellule stromali fossero un nuovo sottoinsieme stromale e fossero designate cellule reticolari marginali (MRC; Katakai et al., 2008). Da notare, una notevole quantità di CXCL13 è espressa costitutivamente in MRC nei piccoli follicoli a riposo anche se i FDC esprimono livelli non rilevabili di CXCL13 (Figura 1B). È ben stabilito che il bordo esterno degli AMICI nella milza, in particolare quello che si trova sopra i follicoli, è delimitato da uno strato stromale MAdCAM-1+. Le cellule che costituiscono il rivestimento della membrana basale sotto il seno marginale (MS) esprimono anche CXCL13 e RANKL, indicando che queste cellule sono un tipo di MRC (Katakai et al., 2008). Nei MALTI, le cellule reticolari simili agli MRC formano una rete nella regione della cupola subepiteliale (SED) appena sotto la membrana basale dell’epitelio associato al follicolo (FAE; Katakai et al., 2008; Knoop et al., 2009). Presi insieme, si pensa che gli MRC siano un sottoinsieme stromale comune agli SLOs ma distinto da FDCS e FRCs.
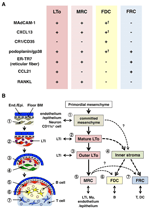
FIGURA 2. Relazione tra MRC e altri sottoinsiemi di cellule stromali in SLOS. (A) Modello di espressione marker in sottoinsiemi di cellule stromali. I livelli di espressione di MAdCAM-1, CXCL13 e podoplanina/gp38 in FDCs sono spesso deboli o non rilevabili da immunoistochimica (†). (B) Schema di un modello generalizzato di sviluppo SLO con le posizioni di sottoinsiemi di cellule stromali (a sinistra) e una genealogia putativa di sottoinsiemi di cellule stromali (a destra). I numeri che indicano gli elementi delle celle nel disegno a sinistra rappresentano sottoinsiemi di celle stromali mostrati nello schema a destra. BM, membrana basale; Fine./Epi., strato endoteliale o epiteliale.
Gli MRC e la via di ingresso dell’antigene negli SLOs
Gli organi linfoidi secondari sono caratterizzati da strutture peculiari che filtrano e trasportano gli antigeni nei compartimenti linfatici (Figura 1A). LNs sono collegati con vasi linfatici per rilevare antigeni linfatici. Poiché i linfatici afferenti sono aperti al SCS, l’endotelio linfatico del seno e la membrana basale del pavimento sono, per così dire, la superficie anteriore del filtro LN. La milza filtra il sangue, in cui i rami dell’arteria centrale si aprono alla SM e alla zona marginale (MZ), dove le cellule immunitarie esaminano il contenuto del sangue. In queste strutture sinusali specializzate, le barriere di confine sono l’endotelio linfatico nel SCS del LN e l’endotelio sanguigno nel MS della milza, entrambi supportati dal reticolo MRC. È interessante notare che i macrofagi metallofili CD169 + sono distribuiti selettivamente vicino al rivestimento del seno sopra i follicoli, alcuni dei quali si depositano attraverso la barriera endoteliale e trasportano antigeni particolati dal lume del seno nel compartimento linfocitario (Szakal et al., 1983; Taylor et al., 2005; Carrasco e Batista, 2007; Phan et al., 2009). DCs che trasportano antigeni dai tessuti attraverso i vasi linfatici arrivano al SCS e successivamente si muovono nel paracortex attraverso il pavimento del canale interfollicolare (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). Nei MALTi, il FAE funziona come la barriera in cui una cellula epiteliale specializzata chiamata cellule M trasferisce batteri o particelle dal lume intestinale a DCS o macrofagi sottostanti (Kraehenbuhl e Neutra, 2000). Pertanto, gli MRC supportano l’apparato di trasporto dell’antigene in prima linea in ogni SLO. Il disegno di base di SLOs è che i follicoli sono principalmente disposti verso il sito di ingresso dell’antigene e sono accompagnati da zone T. Quindi, da un punto di vista stromale, l’intera architettura tissutale sembra essere organizzata verso lo strato MRC.
Sebbene le funzioni immunologiche degli MRC rimangano elusive, è stato precedentemente dimostrato che la rete di condotti costruita dagli MRC nel follicolo esterno trasporta piccoli antigeni solubili alle cellule B follicolari e agli FDC (Bajénoff e Germain, 2009; Roozendaal et al., 2009). La maggior parte dei macrofagi CD169 + sono posizionati sul lato corticale del pavimento SCS e sporgono un’estensione nel lume del seno per catturare le particelle (Phan et al., 2009). Pertanto, gli MRC potrebbero essere coinvolti nella localizzazione, nella morfologia e nella funzione di questi macrofagi. Lo sviluppo delle cellule M in PPs richiede la segnalazione RANKL-RANK, che è probabilmente controllata da una rete MRC che esprime RANKL appena sotto il FAE (Knoop et al., 2009). Inibendo la via LT, che abolisce le firme MRC nella polpa bianca splenica, disturba la struttura MS (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl et al., 2009). Inoltre, l’espressione elevata di ICAM-1, VCAM-1 e CXCL13 implica che gli MRC sono coinvolti nella migrazione interstiziale dinamica delle cellule B follicolari come scaffold funzionale. I macrofagi CD169 + hanno dimostrato di fornire direttamente antigeni particolati a cellule B antigene-specifiche in quest’area (Carrasco e Batista, 2007; Phan et al., 2009), suggerendo che il controllo mediato dalla rete MRC della migrazione delle cellule B può influire su questo processo. Poiché gli MRC sono presenti anche nella regione IFC, possono regolare la trasmigrazione dei DCS dall’SCS verso la zona T.
MRCs e cellule stromali dell’organizzatore nello sviluppo di SLO
Gli organi linfoidi secondari si sviluppano dall’anlagen, che sono aggregati di cellule mesenchimali ed ematopoietiche associate a vasi o epitelio, in un sito e periodo definiti nel feto o nel neonato (Mebius, 2003). Un evento critico nello sviluppo del SLO anlagen è l’accumulo di CD45 + CD4 + CD3-cellule ematopoietiche, che sono anche conosciute come cellule induttori del tessuto linfoide (LTi) che interagiscono con cellule stromali mesenchimali chiamate cellule lymphoid tissue organizer (LTO) (Mebius et al., 1997). Una citochina della famiglia TNF, linfotossina (LT)-α1β2 che è espressa dalle cellule LTi trasmette segnali alle cellule LTo tramite il recettore LT-β. Le cellule LTo inducono successivamente l’espressione di molecole di adesione, tra cui ICAM-1, VCAM-1 e MAdCAM-1 e chemochine CXCL13, CCL19 e CCL21 (Honda et al., 2001; Cupedo et al., 2004a; Bénézech et al 2010). In particolare, CXCL13 è particolarmente importante nell’attrarre le cellule LTi all’anlagen tramite il suo recettore CXCR5 (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). Si presume che un ciclo di feedback positivo, cioè le cellule LTi che producono LT attivano ulteriormente le cellule LTO stromali, promuovendo l’organizzazione dell’anlagen. Quando i linfociti hanno iniziato ad accumularsi dopo la nascita, il tessuto si espande e vengono indotti i compartimenti supportati da diversi sottoinsiemi di cellule stromali (Cupedo et al., 2004b; Bajénoff e Germain 2009).
Le cellule reticolari marginali e le cellule LTo esprimono un modello molto simile di vari marcatori (Figura 2A), suggerendo che esiste una relazione tra queste due cellule stromali. Le cellule LTo sembrano essere più concentrate nella regione marginale dell’anlagen LN adiacente al seno linfatico del presuntivo SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Questo strato di cellule LTo sembra espandersi verso l’esterno con la crescita dell’anlagen, che alla fine sembra diventare lo strato MRC (Katakai et al., 2008). Allo stesso modo, quando i linfociti si accumulano intorno all’arteria centrale nella milza postnatale, le cellule LTo che esprimono MAdCAM-1 e RANKL si espandono con lo strato e diventano MRC nella polpa bianca. Questi risultati suggeriscono fortemente che gli MRC sono un diretto discendente dello stroma LTo, che preservano le caratteristiche delle cellule LTo in siti specializzati all’interno di SLOS. Anche i topi carenti presentano uno strato MRC subcapsulare in LNs atrofici e guaina MRC periarterial rimpicciolita nella milza, indicando che lo sviluppo MRC avviene indipendentemente dalle cellule B e T ed è programmato prima della loro colonizzazione (Katakai et al., 2008). Poiché gli SLOs campionano in modo efficiente gli antigeni per innescare le risposte immunitarie, le strutture di raccolta degli antigeni costruite durante lo sviluppo devono essere mantenute in seguito. Di conseguenza, è ragionevole che queste strutture tissutali siano mantenute da cellule stromali simili all’organizzatore per tutta l’età adulta.
Relazione tra MRC e altri sottoinsiemi stromali
La figura 2B mostra la possibile genealogia dei sottoinsiemi stromali in SLOS. Nell’embrione, il mesenchima primordiale che si trova in prossimità della vascolarizzazione o dell’epitelio è impegnato a formare il nucleo anlage e attrae le cellule LTi. Le cellule nervose o altre cellule meno caratterizzate sono anche coinvolte nel processo iniziale (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). L’accumulo di cellule LTi facilita la maturazione delle cellule mesenchimali in cellule LTo, che alla fine facilita la costruzione dell’architettura di base. Tipicamente, le cellule LTo tendono a concentrarsi alla periferia dell’anlage e ad espandersi verso l’esterno con la crescita del tessuto, mentre le cellule stromali che presentano firme LTO deboli o assenti aumentano viceversa nella porzione interna dell’anlage. La colonizzazione postnatale delle cellule B e T porta a compartimenti con l’induzione di sottoinsiemi stromali convenzionali.
Se questo schema è corretto, ne consegue che tutti i sottoinsiemi stromali negli SLOS adulti sono originariamente derivati dalle cellule LTo. Pertanto, gli MRC che preservano le caratteristiche delle cellule LTo hanno la capacità di differenziarsi in FDC o FRC? Gli MRC condividono molte firme con altri sottoinsiemi (Figura 2A), suggerendo che ciò è possibile. Una speculazione è che gli MRC funzionano come cellule staminali stromali che forniscono continuamente tutti i sottoinsiemi stromali durante l’età adulta. Sebbene questa idea sia intrigante, richiederà una considerazione cauta e un’ulteriore convalida in futuro. Le cellule mesenchimali sono generalmente di natura altamente flessibile a seconda dell’ambiente circostante e quindi le caratteristiche specifiche possono essere facilmente modificate. La coltura estesa di cellule stromali isolate da LNs provoca la perdita di espressione per molti geni, in particolare le chemochine omeostatiche (Katakai et al., 2004a; Tomei et al., 2009). Ciò suggerisce che i fenotipi in vivo dei sottoinsiemi di cellule stromali sono mantenuti in modo ottimale dalle circostanze del tessuto, che sono reversibili e non a causa della differenziazione terminale. Inoltre, gli stimoli infiammatori inducono la robusta proliferazione delle cellule stromali e il drammatico rimodellamento degli SLOs (Katakai et al., 2004a; Chyou et al., 2011). Pertanto, sebbene gli MRC possano essere convertiti in altri sottoinsiemi, i sottoinsiemi stromali convenzionali potrebbero anche auto-rinnovarsi ed essere intercambiabili negli SLOS adulti.
Rimodellamento degli SLOs e delle strutture linfoidi terziarie
Durante le risposte immunitarie, le strutture stromali all’interno degli SLOs vengono drasticamente rimodellate (Gretz et al., 1997; Katakai et al., 2004a). Alcune infezioni causano una grave interruzione delle strutture tissutali all’interno del LNs e della polpa bianca splenica entro pochi giorni, che viene ripristinata man mano che i patogeni vengono sradicati (Mueller et al., 2007a, b; Scandella et al., 2008; San Giovanni e Abramo, 2009). Questo processo di ripristino probabilmente riassume un processo di auto-organizzazione tramite una reazione di feedback simile allo sviluppo SLO. È importante sottolineare che le cellule simili a LTi sono presenti anche nei tessuti adulti e regolano il rimodellamento associato all’infezione degli SLOs (Kim et al., 2003; Scandella et al., 2008). Sebbene il ruolo degli MRC in tali processi sia sconosciuto, possono avere un ruolo organizzativo in collaborazione con cellule simili a LTi e determinare la struttura esterna degli SLOS durante la ricostruzione.
Nell’infiammazione cronica associata a varie patologie d’organo, un gran numero di linfociti infiltranti spesso portano a organizzazioni simili agli SLOs, noti come tessuti linfoidi terziari (TLTs; Drayton et al., 2006). Le cellule B e T sono segregate e le reti corrispondenti di sottoinsiemi di cellule stromali sono indotte. Sarebbe interessante determinare se gli MRC sono presenti in queste strutture linfoidi ectopiche; tuttavia, le cellule simili a MRC e le strutture tissutali correlate non sono osservate nei TLT che si sono sviluppati durante la gastrite autoimmune del topo (Katakai et al., 2006, 2008). Va sottolineato che le TLT non sono fondamentalmente organizzazioni linfoidi programmate e naturalmente non si associano alle strutture che trasportano l’antigene. Pertanto, gli MRC sono probabilmente assenti nelle TLT. Anche se le cellule stromali che sono fenotipicamente simili a MRCs potrebbero essere indotte in alcune lesioni, non sarebbero identificate come MRCS a meno che non si associno strettamente alla struttura endoteliale o epiteliale specifica e formino un reticolo stratificato ai follicoli esterni.
Conclusione
Le cellule reticolari marginali sono un sottoinsieme di cellule stromali unico comune agli SLOS. Gli MRC sono chiaramente diversi dai sottoinsiemi convenzionali che sono indotti o maturati attraverso interazioni con i linfociti dopo la nascita e sono direttamente derivati dalle cellule LTO stromali nell’anlagen e indipendenti dai linfociti. La rete di MRC è strettamente associata all’apparato di trasporto dell’antigene degli SLOs e si pensa che controlli direttamente o indirettamente la consegna dell’antigene ai compartimenti linfocitari, nonché la localizzazione e la migrazione delle cellule immunitarie. Gli MRC svolgono probabilmente ruoli chiave nel mantenimento delle strutture SLO come struttura esterna e possono essere convertiti in altri sottoinsiemi stromali allo stato stazionario o durante il rimodellamento del tessuto. Sarà importante considerare collettivamente tutti i sottoinsiemi stromali, le strutture tissutali e i microambiente immunologici per comprendere in modo completo il sistema SLO.
Dichiarazione sul conflitto di interessi
L’autore dichiara che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Riconoscimenti
Questo lavoro è stato sostenuto in parte da Grant-in-Aid for Young Scientist and for Scientific Research on Innovative Areas from The Ministry of Education, Culture, Sports, Science, and Technology of Japan.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N., e Germain, R. N. (2006). Le reti cellulari stromali regolano l’ingresso, la migrazione e la territorialità dei linfociti nei linfonodi. Immunita ‘ 25, 989-1001.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bajénoff, M., and Germain, R. N. (2009). Lo sviluppo del follicolo delle cellule B rimodella il sistema del condotto e permette la consegna solubile dell’antigene alle cellule dendritiche follicolari. Sangue 114, 4989-4997.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Balogh, P., Balázs, M., Czömpöly, T., Weih, DS, Arnold, HH, e Weih, F. (2007). Ruoli distinti della segnalazione linfotossina-beta e del fattore di trascrizione omeodominio Nkx2.3 nell’ontogenesi dei compartimenti endoteliali nella milza. Tessuto cellulare Res. 328, 473-486.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., e Caamaño, JH (2010). Ontogenesi delle cellule organizzatore stromali durante lo sviluppo linfonodale. J. Immunol. 184, 4521–4530.
Pubmed Abstract/Pubmed Full Text
Braun, A., Worbs, T., Moschovakis, GL, Halle, S., Hoffmann, K., Bölter, J., Münk, A., e Förster, R. (2011). Le cellule T afferenti derivate dalla linfa e le DCS utilizzano diverse vie dipendenti dal recettore della chemochina CCR7 per l’ingresso nel linfonodo e la migrazione intranodale. NAT. Immunolo. 12, 879–887.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Carrasco, YR, and Batista, FD (2007). Le cellule B acquisiscono antigene particolato in un’area ricca di macrofagi al confine tra il follicolo e il seno subcapsulare del linfonodo. Immunità 27, 160-171.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M., e Lu, TT (2011). Regolazione coordinata della crescita vascolare-stromale linfonodale prima da cellule CD11c+ e poi da cellule T e B. J. Immunol. 187, 5558–5567.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., and Mebius, R. E. (2004a). Gli organizzatori dei linfonodi presuntivi sono rappresentati in modo differenziato nello sviluppo di nodi mesenterici e periferici. J. Immunol. 173, 2968–2975.
Pubmed Abstract/Pubmed Full Text
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Cyster, J. G., e Mebius, R. E. (2004b). L’inizio dell’organizzazione cellulare nei linfonodi è regolato da segnali derivati dalle cellule non B e non dipende dal ligando chemochine CXC 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract/Pubmed Full Text
Cyster, JG (1999). Chemochine e migrazione cellulare negli organi linfoidi secondari. Scienza 286, 2098-2102.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cyster, JG, Ansel, KM, Reif, K., Ekland, EH, Hyman, PL, Tang, HL, Luther, SA, and Ngo, VN (2000). Cellule stromali follicolari e linfociti homing ai follicoli. Immunolo. Apoc 176: 181-193.
Pubmed Astratto | Pubmed Testo Completo | CrossRef Testo Completo
dougall edizioni guerin, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J., e Schuh, J. (1999). RANK è essenziale per lo sviluppo di osteoclasti e linfonodi. Geni Dev. 13, 2412–2424.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Drayton, D. L., Liao, S., Mounzer, R. H., and Ruddle, N. H. (2006). Sviluppo degli organi linfoidi: dall’ontogenesi alla neogenesi. NAT. Immunolo. 7, 344–353.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Eberl, G., Marmon, S., Sunshine, MJ, Rennert, PD, Choi, Y. e Littman, DR (2004). Una funzione essenziale per il recettore nucleare RORy (t) nella generazione di cellule induttori del tessuto linfoide fetale. NAT. Immunolo. 5, 64–73.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M., e Kraehenbuhl, J. (2002). CD4 + CD3-le cellule inducono lo sviluppo della patch di Peyer: ruolo dell’attivazione dell’integrina α4β1 da parte di CXCR5. Immunità 17, 363-373.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A. Nel 2010 è stato pubblicato il primo album in studio della band. Le cellule reticolari fibroblastiche dei linfonodi presentano direttamente l’antigene del tessuto periferico in condizioni stazionarie e infiammatorie. J. Scad. Med. 207, 689–697.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Gretz, J. E., Anderson, A. O., and Shaw, S. (1997). Corde, canali, corridoi e condotti: elementi architettonici critici che facilitano le interazioni cellulari nella corteccia linfonodale. Immunolo. Apoc 156, 11-24.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., and Shaw, S. (2000). Chemochine linfatiche e altre molecole a basso peso molecolare raggiungono venule endoteliali elevate tramite condotti specializzati mentre una barriera funzionale limita l’accesso ai microambiente linfocitari nella corteccia linfonodale. J. Scad. Med. 192, 1425–1440.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., e Nishikawa, S.-I. (2001). Base molecolare per l’interazione ematopoietica / mesenchimale durante l’inizio dell’organogenesi del cerotto di Peyer. J. Scad. Med. 193, 621–630.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, YX, Miele, G., e Aguzzi, A. (2005). Geni dipendenti dal recettore linfotossina-β nei trascrittomi cellulari dendritici linfonodali e follicolari. J. Immunol. 174, 5526–5536.
Pubmed Abstract/Pubmed Full Text
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., and Shaw, S. (2001). Organizzazione spaziale e molecolare della corteccia delle cellule T dei linfonodi: una cavità labirintica delimitata da un monostrato epiteliale di cellule reticolari fibroblastiche ancorate alla matrice extracellulare di membrana basale. Int. Immunolo. 13, 1243–1253.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Sugai, M., Gonda, H. e Shimizu, A. (2004a). Le cellule reticolari fibroblastiche dei linfonodi costruiscono il reticolo stromale tramite il contatto con i linfociti. J. Scad. Med. 200, 783–795.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Lee, JH, Gonda, H., Sugai, M., e Shimizu, A. (2004b). Una nuova struttura stromale reticolare nella corteccia linfonodale: una immuno-piattaforma per le interazioni tra cellule dendritiche, cellule T e cellule B. Int. Immunolo. 16, 1133–1142.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S., e Shimizu, A. (2006). Neogenesi linfoide spontanea su larga scala e autoimmunità bilanciata rispetto alla tolleranza nello stomaco del topo transgenico TCR reattivo H+/K+-ATPasi. J. Immunol. 177, 7858–7867.
Pubmed Astratto | Pubmed Testo Completo
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., e Shimizu, A. (2008). Strato cellulare stromale reticolare simile all’organizzatore comune agli organi linfoidi secondari adulti. J. Immunol. 181, 6189–6200.
Pubmed Abstract/Pubmed Full Text
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, MD, e Lane, P. J. (2003). CD4 + CD3-le cellule accessorie costimolano le cellule T CD4 innescate attraverso OX40 e CD30 nei siti in cui le cellule T collaborano con le cellule B. Immunità 18, 643-654.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H., e Williams, I. R. (2009). RANKL è necessario e sufficiente per avviare lo sviluppo di cellule M di campionamento dell’antigene nell’epitelio intestinale. J. Immunol. 183, 5738–5747.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S., e Miyasaka, M. (1996). La zona marginale splenica è assente nei topi alymphoplastic aly mutant. EUR. J. Immunol. 26, 669–675.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L. Nel 1999, dopo la morte del padre, si trasferì a Parigi, dove si trasferì a Parigi, dove si trasferì a Parigi, dove si trasferì a Parigi, dove rimase fino al 1999. OPGL è un regolatore chiave dell’osteoclastogenesi, dello sviluppo dei linfociti e dell’organogenesi dei linfonodi. Natura 397, 315-323.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kraehenbuhl, J. P., and Neutra, M. R. (2000). Cellule epiteliali M: differenziazione e funzione. Annu. Rev. Cell Dev. Biol. 16, 301–332.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Link, A., Vogt, TK, Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, JG, e Luther, SA (2007). Le cellule reticolari fibroblastiche nei linfonodi regolano l’omeostasi delle cellule T ingenue. NAT. Immunolo. 8, 1255–1265.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., and Turley, S. J. (2011). Il rilascio regolato di ossido nitrico da stroma non ematopoietico controlla l’espansione del pool di cellule T attivate nei linfonodi. NAT. Immunolo. 12, 1096–1104.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Luther, SA, Tang, HL, Hyman, PL, Farr, AG e Cyster, JG (2000). Coespressione delle chemochine ELC e SLC da parte delle cellule stromali della zona T e delezione del gene ELC nel topo plt / plt. Proc. Natl. Acad. Sic. USA 97, 12694-12699.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Luther, S.A., Ansel, K. M., e Cyster, JG (2003). Ruoli sovrapposti di CXCL13, recettore α dell’interleuchina 7 e ligandi CCR7 nello sviluppo dei linfonodi. J. Scad. Med. 197, 1191–1198.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mackay, CR (2001). Chemochine: fattori ad alto impatto dell’immunologia. NAT. Immunolo. 2, 95–101.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J., e il consorzio del progetto genoma immunologico. (2012). Il profilo trascrizionale dello stroma da linfonodi infiammati e a riposo definisce le caratteristiche immunologiche. NAT. Immunolo. 13, 499–510.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mebius, R. E., Rennert, P., and Weissman, I. L. (1997). I linfonodi in via di sviluppo raccolgono cellule CD4+ CD3 – LTß+ che possono differenziarsi in cellule APC, NK e cellule follicolari ma non in cellule T o B. Immunità 7, 493-504.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mebius, R. E. (2003). Organogenesi dei tessuti linfoidi. NAT. Rev. Immunol. 3, 292–303.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., e Matloubian, M. (2007a). Regolazione dell’espressione omeostatica della chemochina e del traffico cellulare durante le risposte immunitarie. Scienza 317, 670-674.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, CP, e Ahmed, R. (2007b). Il targeting virale delle cellule reticolari fibroblastiche contribuisce all’immunosoppressione e alla persistenza durante l’infezione cronica. Proc. Natl. Acad. Sic. U. S. A. 104, 15430-15435.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., and Germain, R. N. (2009). La cellula stromale contribuisce all’omeostasi e alla funzionalità del sistema immunitario. NAT. Rev. Immunol. 9, 618–629.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Müller, G., Höpken, U. E., e Lipp, M. (2003). L’impatto di CCR7 e CXCR5 sullo sviluppo degli organi linfoidi e sull’immunità sistemica. Immunolo. Apoc 195, 117-135.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., and Mebius, R. E. (2003). Un sistema di condotti distribuisce chemochine e piccole molecole trasmesse dal sangue attraverso la polpa bianca splenica. J. Scad. Med. 198, 505–512.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O. e Förster, R. (2003). Meccanismi cooperativi di CXCR5 e CCR7 nello sviluppo e nell’organizzazione di organi linfoidi secondari. J. Scad. Med. 197, 1199–1204.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Palframan, RT, Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, DR, Rollins, BJ, Zweerink, H., Rot, A., e von Andrian, U. H. (2001). Chemochine infiammatoria trasporto e presentazione in HEV: un meccanismo di controllo remoto per il reclutamento di monociti ai linfonodi nei tessuti infiammati. J. Scad. Med. 194, 1361–1373.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Phan, TG, Green, JA, Gray, EE, Xu, Y. e Cyster, JG (2009). Il relè del complesso immune dai macrofagi subcapsulari del seno e dalle cellule B noncognate guida la maturazione di affinità dell’anticorpo. NAT. Immunolo. 10, 786–793.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Roozendaal, R., Mempel, T. R., Lanciatore, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H., e Carroll, M. C. (2009). I condotti mediano il trasporto dell’antigene a basso peso molecolare ai follicoli linfonodali. Immunità 30, 264-276.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Roozendaal, R., and Mebius, R. E. (2011). Interazioni tra cellule stromali e cellule immunitarie. Annu. Rev. Immunol. 29, 23–43.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, SA, Junt, T., e Ludewig, B. (2008). Ripristino dell’integrità dell’organo linfoide attraverso l’interazione di cellule tessuto-induttori linfoidi con stroma della zona delle cellule T. NAT. Immunolo. 9, 667–675.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, MB, e Sorokin, L. (2005). Il sistema di condotti trasporta antigeni solubili dalla linfa afferente alle cellule dendritiche residenti nell’area delle cellule T del linfonodo. Immunità 22, 19-29.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Steinman, R. M., Pack, M., and Inaba, K. (1997). Cellule dendritiche nelle aree delle cellule T degli organi linfoidi. Immunolo. Apoc 156, 25-37.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
St John, A. L., and Abraham, S. N. (2009). La salmonella sconvolge l’architettura dei linfonodi mediante la soppressione mediata da TLR4 delle chemochine omeostatiche. NAT. Med. 15, 1259–1265.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, WW, e Fagarasan, S. (2010). Il rilevamento di stimoli ambientali da parte delle cellule dendritiche follicolari promuove la generazione di immunoglobulina A nell’intestino. Immunità 33, 71-83.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Szabo, M. C., Butcher, E. C., and McEvoy, L. M. (1997). Specializzazione delle cellule dendritiche follicolari della mucosa rivelate dal display mucosal addressin-cell adhesion molecule-1. J. Immunol. 158, 5584–5588.
Pubmed Abstract/Pubmed Full Text
Szakal, A. K., Holmes, K. L., e Tew, J. G. (1983). Trasporto di immunocomplessi dal seno subcapsulare ai follicoli linfonodali sulla superficie delle cellule nonfagocitiche, comprese le cellule con morfologia dendritica. J. Immunol. 131, 1714–1727.
Pubmed Abstract/Pubmed Full Text
Taylor, PR, Martinez-Pomares, L., Stacey, M., Lin, HH, Brown, GD, e Gordon, S. (2005). Recettori dei macrofagi e riconoscimento immunitario. Annu. Rev. Immunol. 23, 901–944.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., e Szakal, A. K. (1997). Cellule dendritiche follicolari e presentazione dell’antigene e dei segnali costimolatori alle cellule B. Immunolo. Apoc 156, 39-52.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S.A. e Swartz, M. A. (2009). Il flusso del fluido regola l’organizzazione delle cellule stromali e l’espressione di CCL21 in un microambiente linfonodale ingegnerizzato dai tessuti. J. Immunol. 183, 4273–4283.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
van de Pavert, S.A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, WW, Randall, TD, de Jonge, WJ, e Mebius, R. E. (2009). La chemochina CXCL13 è essenziale per l’inizio dei linfonodi ed è indotta dall’acido retinoico e dalla stimolazione neuronale. NAT. Immunolo. 10, 1193–1199.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., e Kioussis, D. (2007). Il recettore della tirosina chinasi RET è un regolatore chiave dell’organogenesi della patch di Peyer. Natura 446, 547-551.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, MB, Rajewsky, K., Pasparakis, M., and Kollias, G. (2006). FDC-funzioni specifiche di p55TNFR e IKK2 nello sviluppo di reti FDC e di risposte anticorpali. Immunità 24, 65-77.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, AS, Grayson, M. H., Choi, K., Schreiber, R. D., e Chaplin, D. D. (2009). La linfotossina LTa1ß2 controlla la struttura e la funzione vascolare del seno marginale della milza postnatale e adulta. Immunità 30, 408-420.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text