határok az immunológiában
- Bevezetés
- T és B sejt rekesz és két hagyományos Stromasejt részhalmaz
- egy újonnan azonosított stromális részhalmaz, marginális retikuláris sejtek
- az MRC-ket és az antigén belépési útvonalát az SLO-kban
- MRC-k és szervező Stromasejtek az SLO fejlődésében
- kapcsolat az MRC-k és más stromális részhalmazok között
- az SLO-k és a tercier limfoid struktúrák átalakítása
- következtetés
- összeférhetetlenségi nyilatkozat
- Köszönetnyilvánítás
Bevezetés
a másodlagos limfoid szervek/szövetek (Slo) elengedhetetlenek az adaptív immunválaszok hatékony indukciójához. Az SLO-k több típusa, beleértve a nyirokcsomókat (LNs), a lépet és a nyálkahártyához kapcsolódó limfoid szöveteket (maláták), mint például a Peyer-tapaszok (PPs), stratégiailag helyezkednek el a test különböző helyein. Az SLO-k egy bonyolult szűrő, amely antigéneket mintát vesz, és rendkívül érzékeny immunszenzorokkal van felszerelve. Az idegen antigének összegyűjtése és szűrése érdekében az SLO-k speciális szöveti struktúrákat tartalmaznak, amelyek az endotheliumhoz vagy a hámhoz kapcsolódnak. Az immunsejtek, mint például a limfociták, a dendritikus sejtek (DCs) és a makrofágok nagy sűrűségűek és rekeszeket alkotnak. Az összes Slo-ra jellemző figyelemre méltó tulajdonság a B-sejtek és a T-sejtek szegregált lokalizációja. Az SLOs architektúráját számos mezenchimális eredetű, nem hematopoietikus stromális sejt támogatja, amelyek hálózatokat építenek és rekeszeket határoznak meg (Mueller and Germain, 2009; Roozendaal and Mebius, 2011). A stromális hálózatok nemcsak funkcionális lábat biztosítanak, hanem helyet biztosítanak az immunsejt-tevékenységeknek, valamint a szövet fizikai keretét is. Sőt, egyre több bizonyíték arra utal, hogy a stromális sejtek kritikus szerepet játszanak az immunsejtek működésében és a homeosztázisban (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). Az SLO-k úgy vannak programozva, hogy az anlagenből fejlődjenek ki, amelyek bizonyos helyeken és korlátozott időszakokban fordulnak elő a magzatban és a csecsemőben. Ezenkívül a stromális sejtek fontosak az SLO fejlesztése és karbantartása szempontjából (Mebius, 2003). Itt egy nemrégiben azonosított stromális részhalmazra, a marginális retikuláris sejtekre (MRC) összpontosítok, és összefoglalom jellemzőiket. Kitérek továbbá az MRC-k és a szövetszerkezet, más stromális részhalmazok és immunológiai funkciók közötti kapcsolatra.
T és B sejt rekesz és két hagyományos Stromasejt részhalmaz
a fent leírtak szerint a B-sejtek és a T-sejtek az SLO-k különböző régióiban lokalizálódnak. A B-sejtek felhalmozódnak, hogy tüszőket (B zónát) képezzenek a kapszula alatti külső kéregben az LNs-ben vagy a lép külső periarterioláris limfoid hüvelyében (PALS). A nagy tüszők csoportja a PPs magszövete. Az immunválaszok során az aktivált B-sejtek a tüszőkben csíraközpontokat képeznek, ahol nagy affinitású antitest-termelőkké differenciálódnak (Cyster et al., 2000). Ezzel szemben a T-sejtek egy külön területre (T-zónára) lokalizálódnak a tüszők mellett, azaz a paracortex LNs-ben, belső PALS a lépben, vagy interfollicularis régió (IFR) a PPs-ben. A DC-k a T-zónában is felhalmozódnak, hogy antigént és prime T-sejteket mutassanak be (Steinman et al., 1997).
két különböző típusú mezenchimális stromális részhalmaz van a B és T zónában (1a ábra). A follikuláris dendritikus sejtek (FDC-k) sűrű hálózatot alkotnak a tüszők közepén, és jelentős figyelmet kaptak a B-sejtek antitesttermelésében betöltött jelentőségük miatt (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). Fdcs express CR1/CD35, CD23, és esetenként MAdCAM-1 (Szabó et al., 1997; Cyster et al., 2000). Ezzel szemben a fibroblasztikus retikuláris sejtek (FRCs) bonyolult hálózata magában foglalja a T zóna állványát, amely podoplanin/gp38-at és különböző extracelluláris mátrix (ECM) komponenseket (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). Általában az immunsejtek migrációját és lokalizációját különböző kemokinek szabályozzák (Mackay, 2001). A nyugvó limfociták és az érett DC-k nagyon érzékenyek a” homeosztatikus kemokinokra ” (Cyster, 1999; M!). Ezzel összhangban egyértelmű összefüggések vannak a stromasejt-részhalmazok által termelt kemokinek és a megfelelő receptorokat expresszáló immunsejtek lokalizációja között; az FDCs által termelt CXCL13 a cxcr5-et expresszáló B-sejtek vonzója, míg a T-zónából származó CCL19 és CCL21 a ccr7 közös receptoron keresztül vonzza a T-sejteket és az érett DCs-t (Cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Sőt, úgy gondolják, hogy azok a limfociták, amelyek robusztusan vándorolnak a szövet parenchymájában az antigének szkennelésére, stromális hálózatokat használnak lábaiként (baj Xhamnoff et al 2006). A stromális részhalmazok által termelt különféle tényezők szintén szükségesek az immunsejtek aktiválásához és túléléséhez (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Ezért az egyes rekeszekben lévő stromális hálózat szerkezete és funkciója valószínűleg az immunsejt-részhalmazok aktivitására van optimalizálva.
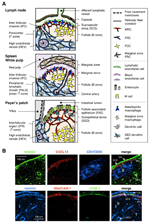
1. ábra. Az SLO-k stromasejt-részhalmazai és szöveti struktúrái. A) a szöveti struktúrák sematikus ábrázolása egér Slo-kban, különös tekintettel a stromasejtekre és az antigénszállító készülékre. A stromális elemek, köztük a mesenchymális, endotheliális és epitheliális sejtek, valamint a mieloid sejtek, például a makrofágok és a dendritikus sejtek (a jobb oldali panelen felsorolva) kiemelésre kerülnek. (B) Felső: az LN külső kérgi régiójában három különböző típusú stromasejt által felépített szövetkeret. Egy egér LN szakasz fluoreszcens immunfestése. A felső mikrográf, van egy kis nyugalmi tüsző (B) csíraközpont nélkül, amelyet a CR1/CD35 expresszáló FDC-k támogatnak, de a CXCL13 kimutathatatlan szintje. Ehelyett az MRC-k laminin+CXCL13+ retikuláris hálózatot alkotnak a tüsző külső szélén a kapszula (CA) és az SCS alatt. Az FRCs által a paracortexben (T) épített hálózat laminin+CXCL13-CR1/CD35-. Alsó: a MAdCAM-1 + MRC réteg szorosan kapcsolódik a LYVE-1 + nyirok endothel réteghez az SCS-ben. Vegye figyelembe, hogy az MRC réteg kiterjed az IFC területre.
a stromális hálózat a T zónában FRC-kből és egy ECM kötegből áll, amely retikuláris rostként ismert, amely egy “vezetéket” képez, amely megkönnyíti az alacsony molekulatömegű anyagok átjutását (Gretz et al., 1997, 2000; Nolte et al., 2003). Ez a vezeték különböző faktorokat és oldható antigéneket szállít a szövet mélyén, míg a részecskék és a nagy molekulák túlnyomórészt kizártak a limfocita rekeszekből. Valójában a perifériás szövetekből származó nyirok által terjesztett kemokineket gyorsan szállítják a magas endothel venulába a vezetéken keresztül, hogy ellenőrizzék a keringő sejtek mozgósítását az LNs-be (Palframan et al., 2001). Ezenkívül néhány rezidens DC közvetlenül érintkezik a vezetékkel, és befogja a nyirok által terjesztett antigéneket (Sixt et al., 2005).
egy újonnan azonosított stromális részhalmaz, marginális retikuláris sejtek
az LN kéreg külső peremét, közvetlenül a kapszula alatt, a subcapsularis sinus veszi körül (SCS; 1a ábra). Az SCS luminalis felületét nyirok endothel sejtek borítják, kérgi oldalukat pedig az alapmembrán, az úgynevezett “padló” támasztja alá (Szakal et al., 1983). Különösen az IFRs-en belül a retikuláris rostok a padlóról a paracortexbe terjednek (Gretz et al., 1997). Fontos, hogy a tüszők legkülső régiójában vékony retikuláris szerkezetű réteg is megfigyelhető. A follikuláris retikulum FRC-szerű stromális sejtjei expresszálják a cxcl13-at és a MAdCAM-1-et, de a CCL21-et nem, ami azt jelzi, hogy ezek a sejtek különböznek a T zóna FRCs-től, míg az FDC marker CR1/CD35 nem volt kimutatható, vagy csak gyengén expresszálódott ezekben a sejtekben (Katakai et al., 2008; 1b. és 2a. ábra). Az FDC-k nem termelnek retikuláris rostokat, ennek megfelelően az ER-TR7 retikuláris marker gyakorlatilag hiányzik a tüszők közepén (Katakai et al., 2004a, b). Ezenkívül a szubkapsuláris régió retikuláris sejtjei kifejezetten expresszálják a RANKL/TRANCE-t, amely egy TNF család citokin, amely elengedhetetlen az LN fejlődéséhez (Dougall et al., 1999; Kong et al., 1999). Ezért ezeket a stromális sejteket új stromális részhalmaznak gondolták, és marginális retikuláris sejteknek (MRC-K; Katakai et al., 2008). Megjegyzendő, hogy jelentős mennyiségű CXCL13 konstitutívan expresszálódik MRC-ben nyugvó kis tüszőkben, még akkor is, ha az FDC-k kimutathatatlan CXCL13-szintet fejeznek ki (1b ábra). Jól megalapozott, hogy a lépben lévő PALS külső szélét, különösen azt, amely a tüszők felett fekszik, egy MAdCAM-1+ stromális réteg határolja. A sejtek alkotják a bélés alapmembrán alatt a marginális sinus (MS) is expressz CXCL13 és RANKL, jelezve, hogy ezek a sejtek egyfajta MRC (Katakai et al., 2008). Malátákban az MRC-khez hasonló retikuláris sejtek hálózatot alkotnak a szubepitheliális kupola (SED) régióban, közvetlenül a tüszőhöz kapcsolódó hám (FAE; Katakai et al., 2008; Knoop et al., 2009). Összességében úgy gondolják, hogy az MRC-k az SLO-k közös stromális részhalmaza, de különböznek az FDC-ktől és az FRC-ktől.
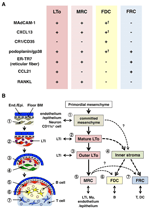
2. ábra. Az MRC-k és az SLO-k egyéb stromasejt-részhalmazai közötti kapcsolat. (A) marker expresszió mintája a stromális sejt részhalmazokban. A Madcam-1, A cxcl13 és a Podoplanin/gp38 expressziós szintje az FDC-kben gyakran gyenge vagy nem észlelhető immunhisztokémiával (ons). (B) az SLO fejlődésének általánosított modelljének vázlata a stromasejt-részhalmazok helyeivel (balra) és a stromasejt-részhalmazok feltételezett genealógiájával (jobbra). A bal oldali rajzon a cellaelemeket jelző számok a jobb oldali sémában látható stromasejt-részhalmazokat képviselik. BM, alapmembrán; vége.Epinefrin., endothel vagy epitheliális réteg.
az MRC-ket és az antigén belépési útvonalát az SLO-kban
a másodlagos limfoid szerveket sajátos struktúrák jellemzik, amelyek szűrik és szállítják az antigéneket a limfocita rekeszekbe (1a.ábra). Az LNs a nyirokerekkel kapcsolódik a nyirok által terjesztett antigének felméréséhez. Mivel az afferens limfatikumok nyitottak az SCS – re, a sinus nyirok endothelium és a padló alapmembrán az LN szűrő elülső felülete. A lép kiszűri a vért, amelyben a központi artéria ágai az MS és a marginális zóna (MZ) felé nyílnak, ahol az immunsejtek felmérik a vér tartalmát. Ezekben a speciális sinus struktúrákban a határzárak az LN SCS-jében lévő nyirok endothelium, a lép SM-jében pedig a vér endothelium, mindkettőt az MRC retikulum támasztja alá. Érdekes módon a CD169 + metallofil makrofágok szelektíven oszlanak el a sinus bélés közelében a tüszők felett, amelyek közül néhány az endothel gáton helyezkedik el, és részecske antigéneket szállít a sinus lumenből a limfocita rekeszbe (Szakal et al., 1983; Taylor et al., 2005; Carrasco és Batista, 2007; Phan et al., 2009). Azok a DC-k, amelyek antigéneket hordoznak a szövetekből a nyirokereken keresztül, megérkeznek az SCS-be, majd az interfollikuláris csatorna padlóján át a paracortexbe kerülnek (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). A Malátákban a FAE gátként működik, amelyben az M-sejteknek nevezett speciális hámsejt baktériumokat vagy részecskéket szállít a bél lumenéből az alatta lévő DCs-be vagy makrofágokba (Kraehenbuhl and Neutra, 2000). Ezért az MRC-k támogatják a frontvonal antigénszállító készülékét minden SLO-ban. Az SLO-K alapvető kialakítása az, hogy a tüszők elsősorban az antigén bejutásának helye felé vannak elrendezve, és T-zónák kísérik őket. Így stromális szempontból úgy tűnik, hogy az egész szöveti architektúra az MRC réteg felé szerveződik.
bár az MRC-k immunológiai funkciói továbbra is megfoghatatlanok, korábban kimutatták, hogy az MRC-k által a külső tüszőben felépített vezetékhálózat kis oldható antigéneket szállít a follikuláris B-sejtekbe és az FDC-kbe (baj Xhamnoff and Germain, 2009; Roozendaal et al., 2009). A legtöbb CD169 + makrofág az SCS padló kérgi oldalán helyezkedik el, és a sinus lumenbe nyúlik ki a részecskék befogására (Phan et al., 2009). Így az MRC-k részt vehetnek ezeknek a makrofágoknak a lokalizációjában, morfológiájában és működésében. Az M-sejtek fejlesztése a PPs-ben RANKL-RANGJELZÉST igényel, amelyet valószínűleg egy RANKL-expresszáló MRC hálózat vezérel közvetlenül a FAE alatt (Knoop et al., 2009). Az LT út gátlása, amely megszünteti az MRC aláírásokat a lépfehér pépben, megzavarja az MS szerkezetét (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl és munkatársai., 2009). Továbbá az emelkedett ICAM-1, VCAM-1 és CXCL13 expresszió azt jelenti, hogy az MRC-k funkcionális állványként részt vesznek a follikuláris B-sejtek dinamikus intersticiális migrációjában. CD169 + makrofágok kimutatták, hogy közvetlenül szállít részecske antigének antigén-specifikus B-sejtek ezen a területen (Carrasco and Batista, 2007; Phan et al., 2009), ami arra utal, hogy a B-sejt migrációjának MRC hálózat által közvetített ellenőrzése befolyásolhatja ezt a folyamatot. Mivel az MRC-k az IFC régióban is jelen vannak, valószínűleg szabályozzák a DC-k transzmigrációját az SCS-ből a T zóna felé.
MRC-k és szervező Stromasejtek az SLO fejlődésében
másodlagos limfoid szervek alakulnak ki az anlagenből, amelyek mesenchymalis és hematopoietikus sejtek aggregátumai, amelyek az erekhez vagy epitheliumhoz kapcsolódnak, a magzat vagy a csecsemő meghatározott helyén és időszakában (Mebius, 2003). A slo anlagen kialakulásának kritikus eseménye a CD45+CD4+CD3 – hematopoietikus sejtek felhalmozódása, amelyek más néven limfoid szövet induktor (LTi) sejtek, amelyek kölcsönhatásba lépnek a mezenchimális stromális sejtekkel, az úgynevezett limfoid szövetszervező (LTo) sejtekkel (Mebius et al., 1997). Egy TNF-családba tartozó citokin, lymphotoxin (lt)-6-1-2, amelyet az LTi-sejtek expresszálnak, jeleket továbbít az LTo-sejtekhez az Lt-6 receptoron keresztül. Az LTo sejtek ezután indukálják az adhéziós molekulák expresszióját, beleértve az ICAM-1, VCAM-1 és MAdCAM-1, valamint a cxcl13, CCL19 és CCL21 kemokinokat (Honda et al., 2001; Cupedo et al., 2004a; B. A., 2010). Különösen a CXCL13 különösen fontos az LTi sejtek vonzásában az anlagenhez a cxcr5 receptorán keresztül (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). Feltételezzük, hogy pozitív visszacsatolási hurok, azaz. az LT-t termelő újonnan bevándorló LTi-sejtek tovább aktiválják az LTo stromális sejteket, elősegítve az anlagen szerveződését. Amint a limfociták a születés után felhalmozódni kezdtek, a szövet kitágul, és a különböző stromasejt-részhalmazok által támogatott rekeszek indukálódnak (Cupedo et al., 2004b; baj Onnoff és Germain 2009).
a marginális retikuláris sejtek és az LTo sejtek nagyon hasonló mintázatot mutatnak a különböző markerekből (2a ábra), ami arra utal, hogy van némi kapcsolat a két stromális sejt között. Úgy tűnik, hogy az LTo sejtek koncentráltabbak az LN anlagen marginális régiójában, a feltételezett SCS nyiroküregével szomszédos (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Úgy tűnik, hogy ez az LTo sejtréteg kifelé tágul az anlagen növekedésével, amely végül MRC réteggé válik (Katakai et al., 2008). Hasonlóképpen, ahogy a limfociták felhalmozódnak a központi artéria körül a posztnatális lépben, a MAdCAM-1-et és a RANKL-t expresszáló LTo-sejtek a réteggel együtt kitágulnak, és MRC-kké válnak a fehér pépben. Ezek az eredmények határozottan arra utalnak, hogy az MRC-k az LTo stroma közvetlen leszármazottai, amelyek megőrzik az LTO sejtek jellemzőit az SLO-k speciális helyein. Még a RAG-hiányos egerek is mutatnak szubkapsuláris MRC réteget atrófiás LNs-ekben és összezsugorodott periarteriális MRC hüvelyekben a lépben, jelezve, hogy az MRC fejlődése A B-és T-sejtektől függetlenül történik, és a kolonizációjuk előtt programozva van (Katakai et al., 2008). Mivel az SLO-k hatékonyan mintaveszik az antigéneket az immunválaszok kiváltására, a fejlesztés során felépített antigéngyűjtő struktúrákat ezt követően fenn kell tartani. Ennek megfelelően ésszerű, hogy ezeket a szöveti struktúrákat szervezőszerű stromasejtek tartják fenn felnőttkorban.
kapcsolat az MRC-k és más stromális részhalmazok között
A 2b.ábra a stromális részhalmazok lehetséges genealógiáját mutatja az SLO-kban. Az embrióban az ős mesenchyme, amely az érrendszer vagy a hám közvetlen közelében van, elkötelezett az anlage mag kialakításában, és vonzza az LTi sejteket. Az idegsejtek vagy más kevésbé jellemzett sejtek szintén részt vesznek a kezdeti folyamatban (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). Az LTi sejtek felhalmozódása megkönnyíti a mezenchimális sejtek érését LTo sejtekké, ami végső soron megkönnyíti az alapvető architektúra felépítését. Jellemzően az LTo-sejtek hajlamosak az anlage perifériájára koncentrálni és a szövet növekedésével kifelé terjeszkedni, míg a stromális sejtek gyenge vagy egyáltalán nem mutatnak LTo-aláírást, ezzel szemben az anlage belső részében növekednek. A B és T sejtek születés utáni kolonizációja a hagyományos stromális részhalmazok indukciójával kompartmentekhez vezet.
Ha ez a séma helyes, ebből következik, hogy a felnőtt Slo-k összes stromális részhalmaza eredetileg LTo-sejtekből származik. Így képesek-e az LTO-sejtek jellemzőit megőrző MRC-k differenciálódni FDC-kké vagy FRC-kké? Az MRC-k sok aláírást osztanak meg más részhalmazokkal (2a ábra), ami arra utal, hogy ez lehetséges. Az egyik spekuláció az, hogy az MRC-k stromális őssejtekként működnek, amelyek felnőttkorban folyamatosan ellátják az összes stromális részhalmazt. Bár ez az ötlet érdekes, óvatos megfontolást és további érvényesítést igényel a jövőben. A mezenchimális sejtek általában rendkívül rugalmasak a környező környezettől függően, így a sajátosságok könnyen megváltoztathatók. Az LNs-ből izolált stromális sejtek kiterjesztett tenyésztése sok gén, különösen a homeosztatikus kemokinek Elveszett expresszióját eredményezi (Katakai et al., 2004a; Tomei et al., 2009). Ez arra utal, hogy a stromasejt-alcsoportok in vivo fenotípusait optimálisan fenntartják a szöveti körülmények, amelyek reverzibilisek, és nem a terminális differenciálódás miatt. Ezenkívül a gyulladásos ingerek indukálják a stromális sejtek robusztus proliferációját és az SLO-k drámai átalakulását (Katakai et al., 2004a; Chyou et al., 2011). Ezért, bár az MRC-K átalakíthatók más részhalmazokká, a hagyományos stromális részhalmazok is megújulhatnak, és felcserélhetők lehetnek felnőtt Slo-kban.
az SLO-k és a tercier limfoid struktúrák átalakítása
az immunválaszok során az SLO-k stromális struktúrái drámai módon átalakulnak (Gretz et al., 1997; Katakai et al., 2004a). Néhány fertőzés az LNs-ben és a lépfehér pépben lévő szövetszerkezetek súlyos megzavarását okozza néhány napon belül, amely a kórokozók felszámolásával helyreáll (Mueller et al., 2007a, b; Scandella et al., 2008; Szent János és Ábrahám, 2009). Ez a helyreállítási folyamat valószínűleg összefoglalja az önszerveződő folyamatot az SLO fejlesztéséhez hasonló visszacsatolási reakció révén. Fontos, hogy az LTi-szerű sejtek a felnőtt szövetekben is jelen vannak, és szabályozzák az SLO-k fertőzéssel összefüggő átalakulását (Kim et al., 2003; Scandella et al., 2008). Bár az MRC – k szerepe az ilyen folyamatokban nem ismert, valószínűleg szervezeti szerepük van az LTi-szerű sejtekkel együttműködve, és meghatározzák az SLO-k külső keretét a rekonstrukció során.
a különböző szervi patológiákkal járó krónikus gyulladásban az infiltráló limfociták nagy száma gyakran olyan szervezetekhez vezet, amelyek hasonlóak az SLO-khoz, úgynevezett tercier limfoid szövetekhez (Tlts; Drayton et al., 2006). A B-és T-sejtek elkülönülnek, és a stromasejt-részhalmazok megfelelő hálózatai indukálódnak. Érdekes lenne meghatározni, hogy az MRC-k jelen vannak-e ezekben a méhen kívüli limfoid struktúrákban; azonban az MRC-szerű sejtek és a kapcsolódó szöveti struktúrák nem figyelhetők meg az egér autoimmun gastritis során kialakult TLT-kben (Katakai et al., 2006, 2008). Hangsúlyozni kell, hogy a TLT-k alapvetően nem programozott limfoid szervezetek, és természetesen nem kapcsolódnak az antigénszállító struktúrákhoz. Ezért az MRC-k valószínűleg hiányoznak a TLTs-ben. Annak ellenére, hogy az MRC-khez fenotípusosan hasonló stromális sejtek indukálódhatnak egyes elváltozásokban, nem azonosíthatók MRC-ként, hacsak nem szorosan kapcsolódnak a specifikus endothel vagy epitheliális szerkezethez, és réteges retikulumot képeznek a külső tüszőknél.
következtetés
a marginális retikuláris sejtek az SLO-kra jellemző egyedi stromasejt-részhalmazok. Az MRC-k egyértelműen különböznek a születés utáni lymphocytákkal való kölcsönhatás révén indukált vagy érlelt hagyományos alcsoportoktól, és közvetlenül az anlagén LTo stromasejtjeiből származnak, és függetlenek a lymphocytáktól. Az MRC-k hálózata szorosan kapcsolódik az SLO-k antigénszállító készülékéhez, és úgy gondolják, hogy közvetlenül vagy közvetve szabályozza az antigén szállítását a limfocita rekeszekbe, valamint az immunsejtek lokalizációját és migrációját. Az MRC-k valószínűleg kulcsszerepet játszanak az SLO-struktúrák külső keretként való fenntartásában, és egyensúlyi állapotban vagy szöveti átalakítás során más stromális részhalmazokká alakíthatók. Fontos lesz az összes stromális részhalmazt, szöveti struktúrát és immunológiai mikrokörnyezetet együttesen figyelembe venni az SLO rendszer átfogó megértése érdekében.
összeférhetetlenségi nyilatkozat
a szerző kijelenti, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Köszönetnyilvánítás
ezt a munkát részben a japán Oktatási, Kulturális, Sport -, Tudományos és Technológiai Minisztérium fiatal tudósoknak és innovatív területeken végzett tudományos kutatásoknak nyújtott támogatása támogatta.
baj Onnoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N. és Germain, R. N. (2006). A stromális sejthálózatok szabályozzák a limfociták bejutását, migrációját és területiségét a nyirokcsomókban. Védettség 25, 989-1001.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
baj Alternnoff, M., and Germain, R. N. (2009). A B-sejtes tüszőfejlődés átalakítja a vezetékrendszert, és lehetővé teszi az oldható antigén szállítását a follikuláris dendritikus sejtekbe. Vér 114, 4989-4997.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Balogh, P., bal Xhamzs, M., CZ (2007). A lymphotoxin-béta jelátvitel és az nkx2.3 homeodomain transzkripciós faktor különböző szerepei a lépben lévő endothel kompartmentek ontogenitásában. Sejtszövet Res. 328, 473-486.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
b (2010), J. H., C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., Caama, J. H. (2010). A stromális szervező sejtek ontogenitása a nyirokcsomó fejlődése során. J. Immunol. 184, 4521–4530.
Pubmed absztrakt / Pubmed teljes szöveg
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., B., B., M., M., A., és F. (2011). Az afferens nyirokból származó T-sejtek és a DC-k különböző kemokin receptor CCR7-függő útvonalakat használnak a nyirokcsomóba való belépéshez és az intranodális migrációhoz. Nat. Immunol. 12, 879–887.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Carrasco, Y. R., and Batista, F. D. (2007). A B-sejtek részecske antigént kapnak egy makrofágban gazdag területen, a tüsző és a nyirokcsomó subcapsularis sinus határán. Védettség 27, 160-171.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M. és Lu, T. T. (2011). A nyirokcsomó vaszkuláris-stromális növekedésének koordinált szabályozása először a CD11c + sejtek, majd a T és B sejtek által. J. Immunol. 187, 5558–5567.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., de Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., and Mebius, R. E. (2004a). A feltételezett nyirokcsomó-szervezők különbözőképpen képviseltetik magukat a mesenterialis és a perifériás csomópontok kialakulásában. J. Immunol. 173, 2968–2975.
Pubmed absztrakt / Pubmed teljes szöveg
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., de Waal-Malefyt, R., Kraal, G., Cyster, J. G., and Mebius, R. E. (2004b). A nyirokcsomókban a sejtszerveződés megindítását nem B-sejtből származó jelek szabályozzák, és nem függ a CXC kemokin ligandumától 13. J. Immunol. 173, 4889–4896.
Pubmed absztrakt / Pubmed teljes szöveg
Cyster, J. G. (1999). Kemokinek és sejtmigráció a másodlagos limfoid szervekben. Tudomány 286, 2098-2102.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A., and Ngo, V. N. (2000). Follicularis stromalis sejtek és lymphocyták, amelyek a tüszőkhöz vezetnek. Immunol. Jel. 176: 181-193.
Pubmed absztrakt | Pubmed teljes szöveg | CrossRef teljes szöveg
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J. és Schuh, J. (1999). A rang elengedhetetlen az osteoclast és a nyirokcsomó fejlődéséhez. Gének Dev. 13, 2412–2424.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Drayton, D. L., Liao, S., Mounzer, R. H., and Ruddle, N. H. (2006). Limfoid szervek fejlődése: az ontogenitástól a neogenezisig. Nat. Immunol. 7, 344–353.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y., and Littman, D. R. (2004). A Rory(t) nukleáris receptor alapvető funkciója a magzati limfoid szövet induktor sejtek generálásában. Nat. Immunol. 5, 64–73.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M., and Kraehenbuhl, J. (2002). A CD4 + CD3-sejtek Peyer patch fejlődését indukálják: a cxcr5 által végzett cxcr5-aktiválás szerepe. Védettség 17, 363-373.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, M. S., Collier, A. R., Boyd, R. L. és Turley, S. J. (2010). A nyirokcsomó fibroblasztikus retikuláris sejtjei egyensúlyi és gyulladásos állapotban közvetlenül jelen vannak a perifériás szöveti antigénnel. J. Felh. Med. 207, 689–697.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Gretz, J. E., Anderson, A. O., and Shaw, S. (1997). Zsinórok, csatornák, folyosók és vezetékek: kritikus építészeti elemek, amelyek megkönnyítik a sejtek kölcsönhatását a nyirokcsomó kéregben. Immunol. Rev. 156, 11-24.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., and Shaw, S. (2000). A nyirok által terjesztett kemokinek és más kis molekulatömegű molekulák speciális vezetékeken keresztül érik el a magas endothel venulákat, míg a funkcionális gát korlátozza a limfocita mikrokörnyezetekhez való hozzáférést a nyirokcsomó kéregben. J. Felh. Med. 192, 1425–1440.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Jamagucsi, K., Fukumoto, T., Csiba, T. és Nishikava, S.-I. (2001). A hematopoietikus/mezenchimális kölcsönhatás molekuláris alapja a Peyer patch organogenezisének megindítása során. J. Felh. Med. 193, 621–630.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G. és Aguzzi, A. (2005). Lymphotoxin-receptorfüggő gének nyirokcsomó-és follikuláris dendritikus sejt transzkriptómákban. J. Immunol. 174, 5526–5536.
Pubmed absztrakt / Pubmed teljes szöveg
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., and Shaw, S. (2001). A nyirokcsomó t-sejtkéreg térbeli és molekuláris szervezése: labirintus üreg, amelyet a fibroblasztikus retikuláris sejtek epitheliumszerű egyrétege határol, amely az alapmembránszerű extracelluláris mátrixhoz van rögzítve. Int. Immunol. 13, 1243–1253.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Katakai, T., Hara, T., Sugai, M., Gonda, H., and Shimizu, A. (2004a). Nyirokcsomó a fibroblasztikus retikuláris sejtek limfocitákkal érintkezve építik fel a stromális retikulumot. J. Felh. Med. 200, 783–795.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M., and Shimizu, A. (2004b). Új retikuláris stromális szerkezet a nyirokcsomó kéregben: immunplatform a dendritikus sejtek, a T-sejtek és a B-sejtek közötti kölcsönhatásokhoz. Int. Immunol. 16, 1133–1142.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S. és Shimizu, A. (2006). Spontán nagy léptékű limfoid neogenezis és kiegyensúlyozott autoimmunitás versus tolerancia a gyomorban a H+ / K + – ATPáz-reaktív TCR transzgenikus egér. J. Immunol. 177, 7858–7867.
Pubmed absztrakt / Pubmed teljes szöveg
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., and Shimizu, A. (2008). Szervező-szerű retikuláris stromális sejtréteg, amely közös a felnőtt másodlagos limfoid szervekben. J. Immunol. 181, 6189–6200.
Pubmed absztrakt / Pubmed teljes szöveg
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-bíró, A., Raykundalia, C., Walker, L. S., Goodall, M. D., and Lane, P. J. (2003). A CD4 + CD3 kiegészítő sejtek az alapozott CD4 T-sejteket ox40-en és CD30-on keresztül stimulálják olyan helyeken, ahol a T-sejtek együttműködnek a B-sejtekkel. Védettség 18, 643-654.
Pubmed absztrakt / Pubmed teljes szöveg | CrossRef teljes szöveg
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H. és Williams, I. R. (2009). A RANKL szükséges és elegendő az antigénmintavételi M sejtek kifejlődésének megkezdéséhez a bél epitheliumában. J. Immunol. 183, 5738–5747.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S. és Miyasaka, M. (1996). Az alimfoplasztikus Aly mutáns egerekben a lép marginális zóna hiányzik. Eur. J. Immunol. 26, 669–675.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J. és Penninger, J. M. (1999). Az OPGL az osteoclastogenezis, a limfocita fejlődés és a nyirokcsomó-organogenezis kulcsfontosságú szabályozója. Természet 397, 315-323.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Kraehenbuhl, J. P., and Neutra, M. R. (2000). Epithelialis m sejtek: differenciálódás és funkció. Annu. Cell Dev Tiszteletes. Biol. 16, 301–332.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., and Luther, S. A. (2007). A nyirokcsomók fibroblasztikus retikuláris sejtjei szabályozzák a naiv T-sejtek homeosztázisát. Nat. Immunol. 8, 1255–1265.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., and Turley, S. J. (2011). A nitrogén-monoxid nem vérképző sztróma által történő szabályozott felszabadulása szabályozza az aktivált T-sejt medence tágulását a nyirokcsomókban. Nat. Immunol. 12, 1096–1104.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G., and Cyster, J. G. (2000). Az ELC és SLC kemokinek együttes expressziója a T zóna stromasejtjei által és az ELC gén deléciója a plt/plt egérben. Proc. NAT. Acad. Sci. U. S. A. 97, 12694-12699.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Luther, S. A., Ansel, K. M., és Cyster, J. G. (2003). A cxcl13, az interleukin 7 receptor és a ccr7 ligandumok átfedő szerepe a nyirokcsomó fejlődésében. J. Felh. Med. 197, 1191–1198.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mackay, C. R. (2001). Kemokinek: az immunológia nagy hatású tényezői. Nat. Immunol. 2, 95–101.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Malhotra, D., Fletcher, A. L., Astarita, J., Lukács-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J. és az immunológiai Genom Projekt konzorcium. (2012). A gyulladt és pihenő nyirokcsomókból származó sztróma transzkripciós profilozása meghatározza az immunológiai jellemzőket. Nat. Immunol. 13, 499–510.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mebius, R. E., Rennert, P., and Weissman, I. L. (1997). A fejlődő nyirokcsomók összegyűjtik a CD4 + CD3-LT-t, amely képes megkülönböztetni az APC-t, az NK-sejteket és a follikuláris sejteket, de nem a T-vagy B-sejteket. Védettség 7, 493-504.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mebius, R. E. (2003). A limfoid szövetek organogenezise. Nat. Rev. Immunol. 3, 292–303.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., and Matloubian, M. (2007a). A homeosztatikus kemokin expresszió és a sejtkereskedelem szabályozása az immunválaszok során. Tudomány 317, 670-674.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mueller, S. N., matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., and Ahmed, R. (2007b). A fibroblasztikus retikuláris sejtek víruscélzása hozzájárul az immunszuppresszióhoz és a perzisztenciához a krónikus fertőzés során. Proc. NAT. Acad. Sci. U. S. A. 104, 15430-15435.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mueller, S. N., and Germain, R. N. (2009). A stromasejt hozzájárul az immunrendszer homeosztázisához és működéséhez. Nat. Rev. Immunol. 9, 618–629.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
m (2003). A ccr7 és a CXCR5 hatása a limfoid szervek fejlődésére és a szisztémás immunitásra. Immunol. Rev. 195, 117-135.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nolte, M. A., beli Xhamn, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., van Rooijen, N., Kraal, G., and Mebius, R. E. (2003). Egy vezetékrendszer osztja el a kemokinokat és a kis vérrel terjedő molekulákat a lépfehér pépen keresztül. J. Felh. Med. 198, 505–512.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., és F (2003). A cxcr5 és CCR7 együttműködő mechanizmusai a másodlagos limfoid szervek fejlesztésében és szervezésében. J. Felh. Med. 197, 1199–1204.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A. és von Andrian, U. H. (2001). Gyulladásos kemokin transzport és prezentáció a HEV-ben: távirányító mechanizmus a monocita toborzáshoz a gyulladt szövetek nyirokcsomóihoz. J. Felh. Med. 194, 1361–1373.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Phan, T. G., Zöld, J. A., szürke, E. E., Xu, Y., and Cyster, J. G. (2009). A subcapsularis sinus makrofágok és a nem ismert B sejtek által kiváltott immunkomplex relé az antitest affinitás érését eredményezi. Nat. Immunol. 10, 786–793.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Roozendaal, R., Mempel, T. R., Kancsó, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H. és Carroll, M. C. (2009). A vezetékek közvetítik a kis molekulatömegű antigén szállítását a nyirokcsomókba tüszők. Védettség 30, 264-276.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Roozendaal, R., and Mebius, R. E. (2011). Stromasejt-immunsejt kölcsönhatások. Annu. Rev. Immunol. 29, 23–43.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T. és Ludewig, B. (2008). A limfoid szerv integritásának helyreállítása a limfoid szövetinduktor sejtek kölcsönhatása révén a T-sejt zóna sztrómájával. Nat. Immunol. 9, 667–675.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B. és Sorokin, L. (2005). A vezetékrendszer oldható antigéneket szállít az afferens nyirokból a rezidens dendritikus sejtekbe a nyirokcsomó T-sejt területén. Védettség 22, 19-29.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Steinman, R. M., Pack, M., and Inaba, K. (1997). Dendritikus sejtek a limfoid szervek T-sejtes területein. Immunol. Rev. 156, 25-37.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
St John, A. L., and Abraham, S. N. (2009). A szalmonella megzavarja a nyirokcsomó architektúráját a homeosztatikus kemokinek tlr4 által közvetített szuppressziójával. Nat. Med. 15, 1259–1265.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W. és Fagarasan, S. (2010). A follikuláris dendritikus sejtek által a környezeti ingerek érzékelése elősegíti az immunglobulin a generációt a bélben. Védettség 33, 71-83.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Szabó, M. C., Butcher, E. C., and McEvoy, L. M. (1997). A nyálkahártya follikuláris dendritikus sejtjeinek specializációja, amelyet a nyálkahártya adhéziós molekula-1 kijelzője tárt fel. J. Immunol. 158, 5584–5588.
Pubmed absztrakt / Pubmed teljes szöveg
Szakal, A. K., Holmes, K. L., and Tew, J. G. (1983). Immun komplexek szállítása a subcapsularis sinus-ból a nyirokcsomó tüszőkbe a nemfagocita sejtek felületén, beleértve a dendritikus morfológiájú sejteket is. J. Immunol. 131, 1714–1727.
Pubmed absztrakt / Pubmed teljes szöveg
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., and Gordon, S. (2005). Makrofág receptorok és immunfelismerés. Annu. Rev. Immunol. 23, 901–944.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F. és Szakal, A. K. (1997). Follicularis dendritikus sejtek és antigén és kostimulációs jelek bemutatása A B-sejtek számára. Immunol. Rev. 156, 39-52.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A., and Swartz, M. A. (2009). A folyadékáramlás szabályozza a stromális sejtek szerveződését és a CCL21 expresszióját egy szöveti nyirokcsomó mikrokörnyezetben. J. Immunol. 183, 4273–4283.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., H (2009), Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., De Jonge, W. J., és Mebius, R. E. (2009). A kemokin CXCL13 elengedhetetlen a nyirokcsomó-iniciációhoz, és retinsav és neuronális stimuláció indukálja. Nat. Immunol. 10, 1193–1199.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., and Kioussis, D. (2007). A tirozin-kináz receptor RET a Peyer patch organogenezisének kulcsfontosságú szabályozója. Természet 446, 547-551.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., and Kollias, G. (2006). A p55TNFR és IKK2 FDC-specifikus funkciói az FDC hálózatok és az antitestválaszok fejlesztésében. Védettség 24, 65-77.
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D. és Chaplin, D. D. (2009). A Lymphotoxin Lta1 6 a posztnatális és a felnőttkori lép marginális sinus vascularis szerkezetét és működését szabályozza. Védettség 30, 408-420.
Pubmed absztrakt | Pubmed teljes szöveg/CrossRef teljes szöveg