Ouabaïne
L’ouabaïne est un glycoside cardiaque qui inhibe l’échange sodium-potassium dépendant de l’ATP à travers les membranes cellulaires. La liaison de l’ouabaïne à la pompe sodium-potassium (également appelée Na+/K+ ATPase) empêche les changements conformationnels nécessaires à son bon fonctionnement. Cela affecte la composition des ions intracellulaires de diverses manières avec divers effets, en fonction de la cellule et du dosage. Le composé a donc été utilisé en médecine, à la fois comme thérapeutique et dans la recherche liée au transport membranaire actif actif.
Protéine cible: Na +/K + ATPase

La Na +/K +ATPase transporte activement le potassium dans la cellule et le sodium dans l’espace extra-cellulaire selon le schéma général illustré ci-dessous. Cette protéine transmembranaire est composée de trois sous-unités, alpha, bêta et gamma, qui peuvent se dimériser avec d’autres pompes in vivo. La structure cristalline est un hexamère radialement symétrique, lorsque dans les tissus vivants, les protéines s’associent très probablement bilatéralement. La chaîne alpha est représentée en rose / bleu et la chaîne bêta en jaune / vert. Des deux, la sous-unité alpha joue le rôle principal dans le fonctionnement de la protéine. Le faisceau d’hélices alpha au centre de la protéine positionne les résidus hydrophobes à l’extérieur du motif, ouvrant un portail à travers la bicouche lipidique. C’est à l’intérieur de ce domaine transmembranaire que les résidus de la sous-unité alpha coordonnent les ions sodium ou potassium. Le grand domaine du côté cytoplasmique de la bicouche (le plus éloigné de la sous-unité bêta) flotte en solution et est responsable de la liaison et de l’hydrolyse de l’ATP. Comme pour de nombreuses enzymes protéiques de l’hydrolyse du phosphoester, les groupes phosphates sont coordonnés avec a. L’énergie libérée par le clivage des phosphates à haute énergie est transférée par des changements conformationnels au domaine transmembranaire, où les ions sont forcés contre leur gradient de concentration. Du côté extracellulaire, les mouvements empêchent la dissociation des ions potassium lors de leur entrée dans la cellule. Une troisième sous-unité gamma (violet/orange), avec la sous-unité bêta, contribue à l’ancrage des domaines transmembranaires à la bicouche phospholipidique.
Le fonctionnement normal de la Na+/K+ATPase change de manière unidirectionnelle entre deux phases, E1 et E2. Dans la phase E1, il se lie au Na+ et à l’ATP à l’intérieur de la cellule. Après hydrolyse, la protéine phosphorélée éjecte l’ADP et change de conformation en E2, ce qui permet à 3Na+ de se dissocier du côté extracellulaire de la membrane. La protéine se lie ensuite à 2K + et hydrolyse le phosphate inorganique lié, provoquant le retour à E1. Juste avant la liaison de K+ à l’état E2, l’Ouabaïne se lie aux résidus à l’intérieur de la pompe, empêchant la transition vers E1 (ainsi le cofacteur de magnésium coordonne une liaison enzymatique)
Structure de l’Ouabaïne et liaison
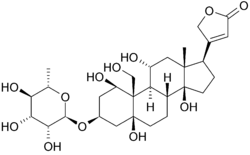
Voici la structure de l’oubaïne en deux dimensions. La molécule est constituée d’un sucre lié à un cholestérol modifié par une liaison glycosidique (donc glycoside). Les groupes hydroxyles entourant une grande partie de la molécule, ainsi que les esters à chaque extrémité, contribuent à sa liaison à la pompe sodium-potassium liée à la membrane. peut également être vu en trois dimensions. Avec la géométrie moléculaire et la stéréochimie ainsi affichées, on peut voir plus clairement la distribution des liaisons carbone-oxygène polaires et carbone-carbone non polaires dans l’espace entourant la molécule. Cela rend la visualisation de la liaison de l’inhibiteur beaucoup plus facile. Ouabaïne est à la protéine le long de l’intérieur d’un faisceau alpha-hélice. les composants des résidus aident quelque peu à coordonner l’ouabaïne par les forces de Van der Waals, mais les résidus, la glutamine, l’acide aspartique et la thréonine, ainsi que la liaison amide d’une alanine, entourent les groupes hydroxyle et carbonyle du ligand, formant des liaisons hydrogène de 2 à 4 angstroms de longueur. Cela maintient non seulement le médicament en place, mais empêche le changement conformationnel nécessaire à la fonction de la protéine.
Inhibition du muscle cardiaque et de la pompe ionique
L’inhibition de la Na +/ K+ ATPase a des effets indirects sur la force contractile, ou inotrophie, des cellules du muscle cardiaque. Grâce à l’augmentation de la concentration de sodium cytoplasmique, un échangeur sodium-calcium est activé, augmentant ainsi la concentration cellulaire de calcium. Le calcium est un deuxième messager dans de nombreuses voies de signalisation / régulation. Sa libération dans le cytoplasme des cellules musculaires signale une contraction, expliquant l’effet positif de faibles doses d’ouabaïne sur l’introphie cardiaque. L’image ci-dessous représente cet effet de tous les glycosides cardiaques sur le tissu myocardique. Comme on le voit, l’inhibition de la pompe sodium-potassium provoque une élévation du sodium cytoplasmique, ce qui active la pompe sodium-calcium provoquant une augmentation du calcium cytoplasmique. Cela augmente la force avec laquelle la cellule se contracte.
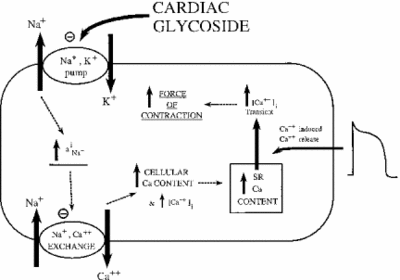
Si dosé correctement, l’ouabaïne s’avère efficace dans le traitement de l’insuffisance cardiaque et des arythmies. Cependant, l’activité de l’ouabaïne peut contribuer indirectement à la surcharge des cellules myocardiques en sodium. Les canaux Na+ passifs sont généralement inactivés lorsque le potentiel membranaire est au plus haut. Lorsqu’ils se rouvrent ou ne parviennent pas à se fermer, une trop grande quantité de sodium peut s’infiltrer dans la cellule, entraînant une dépense inutile d’ATP et / ou une contraction musculaire non coordonnée. C’est ce qu’on appelle l’I-Na tardif. Avec l’augmentation du sodium et du calcium, une kinase Ca2+-calmoduline dépendante est activée, à son tour phosphorylée et activant les canaux Na + passifs. Lorsque les effets de l’ouabaïne sont amplifiés de cette manière, le médicament peut causer plus de mal que de bien. La recherche a montré qu’un moyen efficace de lutter contre l’I-Na tardive est l’inhibition de la kinase Ca2+-calmoduline-dépendante (Hoyer et al. 2011).