Frontiers in Immunology
- introductie
- T-en B-Celcompartimenten en twee conventionele stromale Celsubverzamelingen
- een nieuw geïdentificeerde stromale Subset, marginale reticulaire cellen
- MRC ‘ s en de Antigeeninvoerroute in SLOs
- MRC ‘ s en Organizer stromale cellen in SLO-ontwikkeling
- relatie tussen MRC ‘ s en andere stromale Subsets
- remodellering van SLOs en tertiaire lymfoïde structuren
- conclusie
- belangenconflict verklaring
- Dankbetuigingen
introductie
secundaire lymfoïde organen/weefsels (SLOs) zijn essentieel voor de efficiënte inductie van adaptieve immuunresponsen. Verschillende soorten SLOs, met inbegrip van de lymfeklieren (LNs), milt, en mucosal-geassocieerde lymfoïde weefsels (mouten) zoals Peyer ‘ s patches (PPs), zijn strategisch gepositioneerd in verschillende plaatsen in het lichaam. SLOs zijn een uitgebreid filter dat antigenen samples en is uitgerust met zeer gevoelige immuunsensoren. Om vreemde antigenen te verzamelen en te filtreren, bevatten SLOs gespecialiseerde weefselstructuren die met het endotheel of epitheel worden geassocieerd. De Immune cellen zoals lymfocyten, dendritische cellen (DCs), en macrophages accumuleren aan hoge dichtheden en vormcompartimenten. Een opmerkelijk kenmerk gemeenschappelijk aan alle SLOs is de gescheiden lokalisatie van B-cellen en T-cellen. De architectuur van SLOs wordt ondersteund door verschillende typen niet-hematopoëtische stromale cellen van mesenchymale oorsprong, die netwerken construeren en compartimenten definiëren (Mueller and Germain, 2009; Roozendaal and Mebius, 2011). Stromale netwerken bieden niet alleen een functionele voet aan de grond, maar ook een ruimte voor immuuncelactiviteiten, evenals een fysiek kader voor het weefsel. Bovendien wijst het groeiende bewijsmateriaal erop dat stromale cellen ook kritieke rollen in immune celfunctie en homeostase spelen (Link et al., 2007; Fletcher et al., 2010; Suzuki et al., 2010; Lukacs-Kornek et al., 2011). SLOs zijn geprogrammeerd om zich te ontwikkelen uit de anlagen die op bepaalde plaatsen en tijdens beperkte perioden in de foetus en het kind voorkomen. Daarnaast is bekend dat stromale cellen belangrijk zijn voor SLO-ontwikkeling en-onderhoud (Mebius, 2003). Hier richt ik me op een recent geà dentificeerde stromale subset, marginale reticulaire cellen (MRC ‘ s), en vat hun kenmerken samen. Ik bespreek ook de relatie tussen MRC ‘ s en weefselstructuur, andere stromale subsets en immunologische functies.
T-en B-Celcompartimenten en twee conventionele stromale Celsubverzamelingen
zoals hierboven beschreven, lokaliseren B-cellen en T-cellen zich in verschillende gebieden binnen SLOs. B-cellen accumuleren om follikels (B-zone) te vormen in de buitenste cortex onder de capsule in LNs of in de buitenste periarteriolaire lymfoïde schede (PALS) in de milt. Een cluster van grote follikels is het kernweefsel van PPs. Tijdens immuunresponsen vormen geactiveerde B-cellen in de follikels germinale centra, waar ze zich onderscheiden in producenten van antilichamen met hoge affiniteit (Cyster et al., 2000). In tegenstelling, lokaliseren de cellen van T aan een afzonderlijk gebied (de streek van T) naast de follikels, d.w.z., paracortex in LNs, binnenpals in de milt, of interfolliculair gebied (IFR) in PPs. DCs accumuleren ook in de T-zone om antigeen en prime T-cellen te presenteren (Steinman et al., 1997).
Er zijn twee verschillende soorten mesenchymale stromale deelverzamelingen in de B-en T-zones (figuur 1A). Folliculaire dendritische cellen (Fdc ‘ s) vormen een dicht netwerk in het centrum van de follikels en hebben aanzienlijke aandacht gekregen vanwege hun belang in antilichaamproductie door B-cellen (Tew et al., 1997; Cyster et al., 2000; Victoratos et al., 2006; Suzuki et al., 2010). FDCs express CR1 / CD35, CD23 en soms MAdCAM-1 (Szabo et al., 1997; Cyster et al., 2000). Daarentegen bestaat een uitgebreid netwerk van fibroblastische reticulaire cellen (FRCs) uit de steiger van de T-zone, die podoplanine/gp38 en diverse extracellulaire matrix (ECM) componenten produceert (Gretz et al., 1997; Luther et al., 2000; Kaldjian et al., 2001; Katakai et al., 2004a, b). In het algemeen, worden de immune celmigratie en de lokalisatie geregeld door een verscheidenheid van chemokines (Mackay, 2001). Restlymfocyten en volwassen DCs reageren sterk op “homeostatische chemokines” (cyster, 1999; Müller et al 2003). Consistent met dit, zijn er duidelijke correlaties tussen chemokines geproduceerd door stromale cel subsets en de lokalisatie van immune cellen die de overeenkomstige receptoren uitdrukken; cxcl13 geproduceerd door Fdc ‘ s is een lokstof van B cellen die cxcr5 uitdrukken, terwijl Ccl19 en CCL21 van T zone FRCs T cellen aantrekken en DCS rijpen via de gemeenschappelijke receptor CCR7 (cyster, 1999; Cyster et al., 2000; Luther et al., 2000). Bovendien, worden de lymfocyten die robuust in het weefselparenchym migreren om antigenen af te tasten verondersteld stromale netwerken als steunpunt te gebruiken (Bajénoff et al 2006). Een verscheidenheid van factoren geproduceerd door stromale subgroepen zijn ook nodig voor de activering en overleving van immuuncellen (Cyster et al., 2000; Huber et al., 2005; Link et al., 2007; Suzuki et al., 2010; Lukacs-Kornek et al., 2011; Malhotra et al., 2012). Daarom is de structuur en functie van het stromale netwerk in elk compartiment waarschijnlijk geoptimaliseerd voor de activiteit van immuuncel subsets.
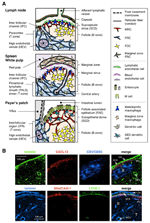
figuur 1. Stromale cel subsets en weefselstructuren van SLOs. (A) schematische weergave van weefselstructuren in muizenlijmen, met de nadruk op stromale cellen en het antigeen-transportapparaat. Stromale elementen, met inbegrip van mesenchymale, endothelial, en epithelial cellen evenals myeloid cellen zoals macrophages en dendritische cellen (vermeld in het rechterpaneel), worden getrokken voor nadruk. B) boven: het weefselkader dat door drie verschillende soorten stromale cellen in het buitenste corticale gebied van LN wordt geconstrueerd. Fluorescerende immunokleuring van een muissectie. In de bovenste micrograaf is er een kleine rustfollikel (B) zonder germinaal centrum, dat wordt ondersteund door Fdc ‘ s die CR1/CD35 uitdrukken, maar niet-detecteerbare niveaus van CXCL13. In plaats daarvan vormen MRCs een laminine + cxcl13 + reticulair netwerk in de buitenrand van het follikel onder de capsule (CA) en SCS. Het door FRCs in de paracortex (T) geconstrueerde netwerk is laminine+CXCL13-CR1/CD35-. Lager: MAdCAM-1 + MRC laag wordt nauw geassocieerd met LYVE – 1 + lymfatische endotheliale laag in de SCS. Merk op dat de MRC-laag wordt uitgebreid naar het IFC-gebied.
het stromale netwerk in de T-zone bestaat uit FRCs en een ECM-bundel, een reticulaire vezel, die een “conduit” vormt die de doorgang van stoffen met een laag molecuulgewicht vergemakkelijkt (Gretz et al., 1997, 2000; Nolte et al., 2003). Deze buis transporteert verschillende factoren en oplosbare antigenen diep in het weefsel, terwijl deeltjes en grote moleculen voornamelijk worden uitgesloten van de lymfocyten compartimenten. Inderdaad, lymfe-borne chemokines uit perifere weefsels worden snel getransporteerd naar de high endothelial venule via de buis om de mobilisatie van circulerende cellen in de LNs te controleren (Palframan et al., 2001). Bovendien, sommige resident DC ‘ s rechtstreeks contact opnemen met de buis en vangen lymfe-borne antigenen (Sixt et al., 2005).
een nieuw geïdentificeerde stromale Subset, marginale reticulaire cellen
de buitenrand van de LN-cortex, net onder de capsule, wordt omgeven door de subcapsulaire sinus (SCS; figuur 1A). Het luminale oppervlak van het SCS is bedekt met lymfatische endotheliale cellen en hun corticale zijde wordt ondersteund door het keldermembraan, genaamd de “vloer” (Szakal et al., 1983). Vooral binnen de IFRs verspreiden reticulaire vezels zich van de vloer naar de paracortex (Gretz et al., 1997). Belangrijk is dat een dunne laag reticulaire structuur ook wordt waargenomen in het buitenste gebied van de follikels. FRC-achtige stromale cellen in het folliculair reticulum drukken CXCL13 en MAdCAM-1 uit, maar niet CCL21, wat aangeeft dat deze cellen onderscheiden zijn van T zone FRCs, terwijl de FDC marker CR1 / CD35 onopgemerkt of slechts zwak tot expressie kwam in deze cellen (Katakai et al., 2008; figuren 1B en 2A). FDC ‘ s genereren geen reticulaire vezels, en bijgevolg is de reticulaire marker ER-TR7 vrijwel afwezig in het centrum van de follikels (Katakai et al., 2004a, b). Bovendien drukken reticulaire cellen in het subcapsulaire gebied specifiek RANKL/TRANCE uit, een TNF – familiecytokine dat essentieel is voor LN-ontwikkeling (Dougall et al., 1999; Kong et al., 1999). Daarom werden deze stromale cellen verondersteld om een nieuwe stromale subset te zijn en werden aangewezen marginale reticulaire cellen (MRCs; Katakai et al., 2008). Een aanzienlijke hoeveelheid CXCL13 wordt constitutief uitgedrukt in MRC ’s in rustende kleine follikels, zelfs als Fdc’ s niet-detecteerbare niveaus van CXCL13 uitdrukken (figuur 1B). Het is duidelijk dat de buitenste rand van PALS in de milt, vooral die welke boven de follikels ligt, wordt begrensd door een MAdCAM-1+ stromale laag. De cellen die de bekleding van het keldermembraan vormen onder de marginale sinus (MS) drukken ook CXCL13 en RANKL uit, wat aangeeft dat deze cellen een type MRC ‘ s zijn (Katakai et al., 2008). In mouten vormen reticulaire cellen vergelijkbaar met MRC ‘ s een netwerk in de subepitheliale koepel (SED) regio net onder het keldermembraan van het follikelgeassocieerde epitheel (FAE; Katakai et al., 2008; Knoop et al., 2009). Samen worden MRC ’s beschouwd als een stromale subset die gemeenschappelijk is voor SLOs, maar die verschilt van FDC’ s en FRC ‘ s.
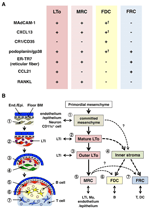
figuur 2. Relatie tussen MRC ‘ s en andere stromale cel subsets in SLOs. (A) patroon van marker expressie in stromale cel subsets. Expressieniveaus van MAdCAM-1, CXCL13 en podoplanine/gp38 in Fdc ‘ s zijn vaak zwak of niet detecteerbaar door immunohistochemie (†). (B) schema van een gegeneraliseerd model van SLO ontwikkeling met de locaties van stromale cel subsets (links) en een vermeende genealogie van stromale cel subsets (rechts). Getallen die celelementen in de linker tekening aangeven, vertegenwoordigen stromale cel subsets die in het rechter schema worden weergegeven. BM, keldermembraan; einde.Epi., endotheliale of epitheliale laag.
MRC ‘ s en de Antigeeninvoerroute in SLOs
secundaire lymfoïde organen worden gekenmerkt door eigenaardige structuren die antigenen filtreren en transporteren naar de lymfocytcompartimenten (figuur 1A). LNs zijn verbonden met lymfevaten om lymfe-borne antigenen te onderzoeken. Omdat de afferente lymphatics open zijn voor het SCS, zijn het sinus lymfatische endotheel en het vloerkeldermembraan als het ware het vooroppervlak van het LN-filter. De milt filtert bloed, waarbij takken van de centrale slagader open naar de MS en marginale zone (MZ), waar immuuncellen de bloedinhoud onderzoeken. In deze gespecialiseerde sinusstructuren zijn de grensbarrières het lymfe endotheel in het SCS van de LN en het bloed endotheel in de MS van de milt, die beide worden ondersteund door het MRC reticulum. Interessant, CD169 + metallofiele macrofagen zijn selectief verdeeld in de buurt van de sinus voering over de follikels, waarvan sommige vestigen over de endotheliale barrière en deeltjesantigenen uit de sinus lumen in de lymfocyten compartiment (Szakal et al., 1983; Taylor et al., 2005; Carrasco and Batista, 2007; Phan et al., 2009). DCs die antigenen van de weefsels via de lymfevaten dragen, komen aan bij het SCS en bewegen zich vervolgens in de paracortex over de vloer van het interfolliculaire kanaal (IFC; Steinman et al., 1997; Katakai et al., 2004b; Braun et al., 2011). In mouten functioneert de FAE als de barrière waarin een gespecialiseerde epitheliale cel genaamd M-cellen bacteriën of deeltjes van het darmlumen naar onderliggende DCs of macrofagen overbrengt (Kraehenbuhl and Neutra, 2000). Daarom ondersteunen MRC ‘ s het frontline antigeen-transportapparaat in elke SLO. Het basisontwerp van SLOs is dat de follikels hoofdzakelijk naar de plaats van antigeen ingang worden geschikt en door T zones worden vergezeld. Dus, vanuit een stromale oogpunt, de hele weefselarchitectuur lijkt te zijn georganiseerd naar de MRC-laag.
hoewel de immunologische functies van MRC ’s ongrijpbaar blijven, werd eerder aangetoond dat het door MRC’ s geconstrueerde leidingnet in de buitenste follikel kleine oplosbare antigenen transporteert naar folliculaire B-cellen en FDC ‘ s (Bajénoff and Germain, 2009; Roozendaal et al., 2009). De meeste CD169 + macrofagen zijn geplaatst aan de corticale kant van de SCS vloer en steken een uitbreiding in het sinus lumen om deeltjes te vangen (Phan et al., 2009). Aldus, zouden MRCs bij de lokalisatie, de morfologie, en de functie van deze macrophages kunnen worden betrokken. M celontwikkeling in PPs vereist RANKL-RANK signalering, die waarschijnlijk wordt gecontroleerd door een RANKL-expressie MRC-netwerk net onder de FAE (Knoop et al., 2009). Het remmen van de Lt-route, die MRC-handtekeningen in de milt witte pulp afschaft, verstoort de MS-structuur (Koike et al., 1996; Balogh et al., 2007; Katakai et al., 2008; Zindl et al., 2009). Bovendien impliceert verhoogde iCam-1 -, VCAM-1-en cxcl13-expressie dat MRC ‘ s betrokken zijn bij de dynamische interstitiële migratie van folliculaire B-cellen als een functionele steiger. CD169 + macrofagen zijn getoond om corpusculaire antigenen aan antigeen-specifieke B cellen in dit gebied direct te leveren (Carrasco en Batista, 2007; Phan et al., 2009), die voorstellen dat MRC netwerk-bemiddelde controle van de celmigratie van B dit proces kan beà nvloeden. Aangezien MRC ’s ook aanwezig zijn in het IFC-gebied, regelen zij mogelijk de transmigratie van DC’ s van het SCS naar de T-zone.
MRC ‘ s en Organizer stromale cellen in SLO-ontwikkeling
secundaire lymfoïde organen ontwikkelen zich uit de anlagen, die aggregaten zijn van mesenchymale en hematopoëtische cellen geassocieerd met vaten of epitheel, op een bepaalde plaats en periode bij de foetus of het kind (Mebius, 2003). Een kritieke gebeurtenis in de ontwikkeling van SLO anlagen is de accumulatie van CD45+CD4+CD3 – hematopoëtische cellen, die ook bekend staan als lymphoid tissue inductor (LTi) cellen die interageren met mesenchymale stromale cellen genoemd lymphoid tissue organizer (LTo) cellen (Mebius et al., 1997). Een TNF-familiecytokine, lymfotoxine (LT)-α1β2 dat wordt uitgedrukt door LTi-cellen, zendt signalen naar LTo-cellen via de LT-β-receptor. LTo-cellen induceren vervolgens de expressie van adhesiemoleculen, waaronder ICAM-1, VCAM-1 en MAdCAM-1, en chemokines CXCL13, CCL19 en Ccl21 (Honda et al., 2001; Cupedo et al., 2004a; Bénézech et al 2010). In het bijzonder is CXCL13 vooral belangrijk om LTi-cellen via zijn receptor CXCR5 naar de anlagen te lokken (Finke et al., 2002; Luther et al., 2003; Ohl et al., 2003). Er wordt aangenomen dat een positieve feedback loop, d.w.z. nieuwe immigrerende LTI-cellen die LT produceren, activeren LTo stromale cellen en bevorderen de organisatie van de anlagen. Als lymfocyten begon te accumuleren na de geboorte, het weefsel breidt en de compartimenten ondersteund door verschillende stromale cel subsets worden geïnduceerd (Cupedo et al., 2004b; Bajénoff and Germain 2009).
marginale reticulaire cellen en LTo-cellen vertonen een zeer vergelijkbaar patroon van verschillende markers (figuur 2A), wat suggereert dat er een verband is tussen deze twee stromale cellen. LTo-cellen lijken meer geconcentreerd te zijn in het marginale gebied van de LN anlagen grenzend aan de lymfatische sinus van de vermoedelijke SCS (Finke et al., 2002; Cupedo et al., 2004a; Eberl et al., 2004; Katakai et al., 2008). Deze LTO-cellaag lijkt naar buiten uit te breiden met de groei van de anlagen, die uiteindelijk de MRC-laag lijkt te worden (Katakai et al., 2008). Naarmate lymfocyten zich ophopen rond de centrale slagader in de postnatale milt, breiden LTo-cellen die MAdCAM-1 en RANKL uitdrukken zich ook uit met de laag en worden MRC ‘ s in de witte pulp. Deze bevindingen suggereren sterk dat MRC ‘ s een directe afstammeling zijn van het LTO-stroma, dat de kenmerken van LTO-cellen op gespecialiseerde locaties binnen SLOs behoudt. Zelfs RAG-deficiënte muizen vertonen een subcapsulaire MRC-laag in atrofische LNs en gekrompen periarteriale MRC-schede in de milt, wat aangeeft dat MRC-ontwikkeling onafhankelijk van B-en T-cellen plaatsvindt en vóór hun kolonisatie is geprogrammeerd (Katakai et al., 2008). Aangezien SLOs efficiënt antigenen steekproef om immune reacties teweeg te brengen, moeten de antigeen-het verzamelen structuren die tijdens ontwikkeling worden gebouwd daarna worden gehandhaafd. Dienovereenkomstig, is het redelijk dat deze weefselstructuren door organizer-als stromale cellen gedurende volwassenheid worden gehandhaafd.
relatie tussen MRC ‘ s en andere stromale Subsets
figuur 2B toont de mogelijke genealogie van stromale subsets in SLOs. In het embryo, wordt het primordiale mesenchyme dat in de nabijheid van vasculature of epitheel is geëngageerd om de anlage kern te vormen en LTI cellen aantrekt. Zenuwcellen of andere minder gekarakteriseerde cellen zijn ook betrokken bij het initiële proces (Veiga-Fernandes et al., 2007; van de Pavert et al., 2009). De accumulatie van LTI-cellen vergemakkelijkt de rijping van mesenchymale cellen in LTO-cellen, die uiteindelijk de bouw van de basisarchitectuur vergemakkelijkt. Typisch, neigen de LTO-cellen om bij de periferie van de anlage te concentreren en naar buiten met weefselgroei uit te breiden, terwijl stromale cellen die zwakke of geen LTO-handtekeningen vertonen omgekeerd verhoging van het binnengedeelte van de anlage. Postnatale kolonisatie van B-en T-cellen leidt tot compartimenten met de inductie van conventionele stromale subsets.
als dit schema correct is, volgt hieruit dat alle stromale subsets in volwassen SLOs oorspronkelijk zijn afgeleid van LTo-cellen. Hebben MRC ’s die de kenmerken van LTo-cellen behouden, dus de mogelijkheid om te differentiëren in Fdc’ s of FRC ‘ s? MRC ‘ s delen veel handtekeningen met andere subsets (figuur 2A), wat suggereert dat dit mogelijk is. Een speculatie is dat MRC ‘ s functioneren als stromale stamcellen die continu alle stromale subsets leveren door volwassenheid. Hoewel dit idee intrigerend is, zal het in de toekomst voorzichtige overweging en verdere validatie vereisen. Mesenchymale cellen zijn over het algemeen zeer flexibel van aard afhankelijk van het omringende milieu, en dus kunnen specifieke eigenschappen gemakkelijk worden veranderd. Uitgebreide kweek van stromale cellen geïsoleerd uit LNs resulteert in verloren expressie voor vele genen, in het bijzonder homeostatische chemokines (Katakai et al., 2004a; Tomei et al., 2009). Dit suggereert dat de in vivo fenotypen van stromale cel subgroepen optimaal worden onderhouden door de weefselomstandigheden, die reversibel zijn en niet te wijten zijn aan terminale differentiatie. Bovendien induceren ontstekingsstimuli de robuuste proliferatie van stromale cellen en de dramatische remodellering van SLOs (Katakai et al., 2004a; Chyou et al., 2011). Daarom, hoewel MRC ‘ s kunnen worden omgezet in andere subsets, conventionele stromale subsets kunnen ook zichzelf vernieuwen en uitwisselbaar in volwassen SLOs.
remodellering van SLOs en tertiaire lymfoïde structuren
tijdens immuunresponsen worden stromale structuren binnen SLOs dramatisch herbouwd (Gretz et al., 1997; Katakai et al., 2004a). Sommige infecties veroorzaken een ernstige verstoring van weefselstructuren binnen de LNs en milt witte pulp binnen een paar dagen, die wordt hersteld als de pathogenen zijn uitgeroeid (Mueller et al., 2007a, b; Scandella et al., 2008; St John and Abraham, 2009). Dit herstelproces recapituleert waarschijnlijk een zelforganiserend proces via een feedback reactie vergelijkbaar met SLO ontwikkeling. Belangrijk, LTi-achtige cellen zijn ook aanwezig in volwassen weefsels en regelen infectie-geassocieerde remodellering van SLOs (Kim et al., 2003; Scandella et al., 2008). Hoewel de rol van MRC ‘ s in dergelijke processen onbekend is, hebben ze mogelijk een organisatierol in samenwerking met LTI-achtige cellen en bepalen ze het buitenste frame van SLOs tijdens de reconstructie.
bij chronische ontsteking geassocieerd met verschillende orgaanpathologieën leiden grote aantallen infiltrerende lymfocyten vaak tot organisaties die vergelijkbaar zijn met SLOs, bekend als tertiaire lymfoïde weefsels (TLTs; Drayton et al., 2006). De cellen van B en T worden gescheiden en de overeenkomstige netwerken van stromale cel subsets worden veroorzaakt. Het zou interessant zijn om te bepalen of MRC ’s aanwezig zijn in deze ectopische lymfoïde structuren; echter, MRC-achtige cellen en verwante weefselstructuren worden niet waargenomen in TLT’ s die zich ontwikkelden tijdens Auto-immuungastritis bij muizen (Katakai et al., 2006, 2008). Men zou moeten benadrukken dat TLTs fundamenteel niet geprogrammeerde lymfoïde organisaties zijn en natuurlijk niet met de antigeen-vervoerende structuren associëren. Daarom zijn MRC ’s waarschijnlijk afwezig in TLT’ s. Hoewel stromale cellen die fenotypisch gelijkaardig aan MRCs in sommige letsels kunnen worden veroorzaakt, zouden zij niet als MRCs worden geà dentificeerd tenzij zij nauw met de specifieke endothelial of epithelial structuur associëren en een gelaagd reticulum bij de buitenste follikels vormen.
conclusie
marginale reticulaire cellen zijn een unieke stromale cel subgroep die vaak voorkomt bij SLOs. MRC ‘ s verschillen duidelijk van conventionele subgroepen die worden geïnduceerd of gerijpt door interacties met lymfocyten na de geboorte, en zijn direct afgeleid van LTO stromale cellen in de anlagen en onafhankelijk van lymfocyten. Het netwerk van MRC ‘ s is nauw verbonden met het antigeen-transportapparaat van SLOs en wordt verondersteld om direct of indirect antigeen levering aan lymfocyten compartimenten evenals de lokalisatie en migratie van immuuncellen te controleren. MRCs spelen waarschijnlijk centrale rollen in het handhaven van SLO-structuren als het buitenkader en kunnen in andere stromale subsets bij steady state of tijdens weefsel het remodelleren worden omgezet. Het zal belangrijk zijn om collectief alle stromale subgroepen, weefselstructuren en immunologische micro-omgevingen te overwegen om het SLO-systeem volledig te begrijpen.
belangenconflict verklaring
de auteur verklaart dat het onderzoek werd uitgevoerd zonder commerciële of financiële relaties die als een potentieel belangenconflict kunnen worden opgevat.
Dankbetuigingen
Dit werk werd gedeeltelijk ondersteund door subsidies voor jonge wetenschappers en voor wetenschappelijk onderzoek op innovatieve gebieden van het Japanse Ministerie van Onderwijs, Cultuur, Sport, Wetenschap en technologie.
Bajénoff, M., Egen, J. G., Koo, L. Y., Laugier, J. P., Brau, F., Glaichenhaus, N., and Germain, R. N. (2006). Stromale cel netwerken reguleren lymfocyten binnenkomst, migratie, en territorialiteit in lymfeklieren. Immuniteit 25, 989-1001.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bajénoff, M., and Germain, R. N. (2009). De ontwikkeling van de B-cel follikel remodelleert het leidingsysteem en staat oplosbare antigeenlevering aan folliculaire dendritische cellen toe. Bloed 114, 4989-4997.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Balogh, P., Balázs, M., Czömpöly, T., Weih, D. S., Arnold, H. H., and Weih, F. (2007). Verschillende rollen van lymfotoxine-beta signalering en de homeodomain transcriptiefactor Nkx2. 3 in de ontogenie van endotheliale compartimenten in milt. Cell Tissue Res. 328, 473-486.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bénézech, C., White, A., Mader, E., Serre, K., Parnell, S., Pfeffer, K., Ware, C. F., Anderson, G., and Caamaño, J. H. (2010). Ontogenie van stromale organizer cellen tijdens lymfeknoop ontwikkeling. J. Immunol. 184, 4521–4530.
Pubmed Abstract / Pubmed Full Text
Braun, A., Worbs, T., Moschovakis, G. L., Halle, S., Hoffmann, K., Bölter, J., Münk, A., and Förster, R. (2011). Afferente lymfe-afgeleide T-cellen en DCs gebruiken verschillende chemokine receptor ccr7-afhankelijke routes voor binnenkomst in de lymfeknoop en intranodale migratie. Nat. Immunol. 12, 879–887.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Carrasco, Y. R., and Batista, F. D. (2007). B-cellen verwerven deeltjesantigeen in een macrofaag-rijk gebied bij de grens tussen de follikel en de subcapsulaire sinus van de lymfeknoop. Immuniteit 27, 160-171.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Chyou, S., Benahmed, F., Chen, J., Kumar, V., Tian, S., Lipp, M., and Lu, T. T. (2011). Gecoördineerde regulering van de lymfeklieren vasculair-stromale groei eerst door CD11c + cellen en vervolgens door T en B cellen. J. Immunol. 187, 5558–5567.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Cupedo, T., Vondenhoff, M. F., Heeregrave, E. J., De Weerd, A. E., Jansen, W., Jackson, D. G., Kraal, G., and Mebius, R. E. (2004a). Vermoedelijke lymfeklieren organisatoren zijn differentieel vertegenwoordigd in het ontwikkelen van mesenterische en perifere knooppunten. J. Immunol. 173, 2968–2975.
Pubmed Abstract / Pubmed Full Text
Cupedo, T., Lund, F. E., Ngo, V. N., Randall, T. D., Jansen, W., Greuter, M. J., De Waal-Malefyt, R., Kraal, G., Cyster, J. G., and Mebius, R. E. (2004b). Initiatie van cellulaire organisatie in lymfeklieren wordt geregeld door niet-B cel-afgeleide signalen en is niet afhankelijk van CXC chemokine ligand 13. J. Immunol. 173, 4889–4896.
Pubmed Abstract / Pubmed Full Text
Cyster, J. G. (1999). Chemokines en celmigratie in secundaire lymfoïde organen. Wetenschap 286, 2098-2102.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Cyster, J. G., Ansel, K. M., Reif, K., Ekland, E. H., Hyman, P. L., Tang, H. L., Luther, S. A., and Ngo, V. N. (2000). Folliculaire stromale cellen en lymfocyten homing naar follikels. Immunol. Rev. 176: 181-193.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Dougall, W. C., Glaccum, M., Charrier, K., Rohrbach, K., Brasel, K., De Smedt, T., Daro, E., Smith, J., Tometsko, M. E., Maliszewski, C. R., Armstrong, A., Shen, V., Bain, S., Cosman, D., Anderson, D., Morrissey, P. J., Peschon, J. J., and Schuh, J. (1999). Rang is essentieel voor osteoclast en lymfeklieren ontwikkeling. Genes Dev. 13, 2412–2424.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Drayton, D. L., Liao, S., Mounzer, R. H., and Ruddle, N. H. (2006). Lymfoïde orgaanontwikkeling: van ontogenie tot neogenese. Nat. Immunol. 7, 344–353.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Eberl, G., Marmon, S., Sunshine, M. J., Rennert, P. D., Choi, Y., and Littman, D. R. (2004). Een essentiële functie voor de nucleaire receptor RORy(t) in de generatie van foetale lymfoïde weefselinductor cellen. Nat. Immunol. 5, 64–73.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Finke, D., Acha-Orbea, H., Mattis, A., Lipp, M., and Kraehenbuhl, J. (2002). CD4 + CD3-cellen induceren Peyer ‘ s patchontwikkeling: rol van α4β1-integrineactivering door CXCR5. Immuniteit 17, 363-373.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Fletcher, A. L., Lukacs-Kornek, V., Reynoso, E. D., Pinner, S. E., Bellemare-Pelletier, A., Curry, M. S., Collier, A. R., Boyd, R. L., and Turley, S. J. (2010). Fibroblastische reticulaire cellen van de lymfeklieren vertonen direct perifeer weefselantigeen onder steady-state-en inflammatoire omstandigheden. J. Exp. Med. 207, 689–697.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Gretz, J. E., Anderson, A. O., and Shaw, S. (1997). Koorden, kanalen, gangen en leidingen: kritische architectonische elementen vergemakkelijken celinteracties in de lymfeknoop cortex. Immunol. Rev. 156, 11-24.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Gretz, J. E., Norbury, C. C., Anderson, A. O., Proudfoot, A. E., and Shaw, S. (2000). Lymfe-borne chemokines en andere moleculen met een laag molecuulgewicht bereiken hoge endothelial venules via gespecialiseerde leidingen terwijl een functionele barrière toegang tot de lymfocyt micro-milieu in lymfeknoop cortex beperkt. J. Exp. Med. 192, 1425–1440.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Honda, K., Nakano, H., Yoshida, H., Nishikawa, S., Rennert, P., Ikuta, K., Tamechika, M., Yamaguchi, K., Fukumoto, T., Chiba, T., and Nishikawa, S.-I. (2001). Moleculaire basis voor hematopoëtische / mesenchymale interactie tijdens initiatie van Peyer ‘ s patch organogenese. J. Exp. Med. 193, 621–630.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Huber, C., Thielen, C., Seeger, H., Schwarz, P., Montrasio, F., Wilson, M. R., Heinen, E., Fu, Y. X., Miele, G., and Aguzzi, A. (2005). Lymfotoxine-β receptor-afhankelijke genen in lymfklier en folliculaire dendritische cel transcriptomen. J. Immunol. 174, 5526–5536.
Pubmed Abstract/Pubmed Full Text
Kaldjian, E. P., Gretz, J. E., Anderson, A. O., Shi, Y., and Shaw, S. (2001). Ruimtelijke en moleculaire organisatie van lymfeknoop T cel cortex: een labyrinthine holte begrensd door een epitheel-achtige monolaag van fibroblastische reticulaire cellen verankerd aan de kelder membraan-achtige extracellulaire matrix. Int. Immunol. 13, 1243–1253.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Sugai, M., Gonda, H., and Shimizu, A. (2004a). Lymfeknoop fibroblastische reticulaire cellen construeren het stromale reticulum via contact met lymfocyten. J. Exp. Med. 200, 783–795.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Hara, T., Lee, J. H., Gonda, H., Sugai, M., and Shimizu, A. (2004b). Een nieuwe reticulaire stromale structuur in de lymfeknoopschors: een immuno-platform voor interacties tussen dendritische cellen, T-cellen en B-cellen. Int. Immunol. 16, 1133–1142.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Katakai, T., Nomura, T., Gonda, H., Sugai, M., Agata, Y., Nishio, A., Masuda, T., Sakaguchi, S., and Shimizu, A. (2006). Spontane grootschalige lymfoïde neogenese en evenwichtige auto-immuniteit versus tolerantie in de maag van H+/K+-ATPase-reactieve TCR transgene muis. J. Immunol. 177, 7858–7867.
Pubmed Abstract/Pubmed Full Text
Katakai, T., Suto, H., Sugai, M., Gonda, H., Togawa, A., Suematsu, S., Ebisuno, Y., Katagiri, K., Kinashi, T., and Shimizu, A. (2008). Organizer-achtige reticulaire stromale cel laag gemeenschappelijk voor volwassen secundaire lymfoïde organen. J. Immunol. 181, 6189–6200.
Pubmed Abstract/Pubmed Full Text
Kim, M. Y., Gaspal, F. M., Wiggett, H. E., McConnell, F. M., Gulbranson-Judge, A., Raykundalia, C., Walker, L. S., Goodall, M. D., And Lane, P. J. (2003). CD4 + CD3-bijkomende cellen costimuleren geprimeerde CD4 T-cellen door OX40 en CD30 op plaatsen waar T-cellen samenwerken met B-cellen. Immuniteit 18, 643-654.
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Knoop, K. A., Kumar, N., Butler, B. R., Sakthivel, S. K., Taylor, R. T., Nochi, T., Akiba, H., Yagita, H., Kiyono, H., and Williams, I. R. (2009). RANKL is noodzakelijk en voldoende om de ontwikkeling van antigeen-sampling m-cellen in het intestinale epitheel in gang te zetten. J. Immunol. 183, 5738–5747.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Koike, R., Nishimura, T., Yasumizu, R., Tanaka, H., Hataba, Y., Hataba, Y., Watanabe, T., Miyawaki, S., and Miyasaka, M. (1996). De milt marginale zone is afwezig bij alymphoplastische aly mutant muizen. Euro. J. Immunol. 26, 669–675.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kong, Y. Y., Yoshida, H., Sarosi, I., Tan, H. L., Timms, E., Capparelli, C., Morony, S., Oliveira-dos-Santos, A. J., Van, G., Itie, A., Khoo, W., Wakeham, A., Dunstan, C. R., Lacey, D. L., Mak, T. W., Boyle, W. J., and Penninger, J. M. (1999). OPGL is een belangrijke regulator van osteoclastogenese, lymfocytenontwikkeling en lymfeknoop organogenese. Nature 397, 315-323.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kraehenbuhl, J. P., and Neutra, M. R. (2000). Epitheliale m-cellen: differentiatie en functie. Annu. Rev. Cell Dev. Biol. 16, 301–332.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Link, A., Vogt, T. K., Favre, S., Britschgi, M. R., Acha-Orbea, H., Hinz, B., Cyster, J. G., and Luther, S. A. (2007). Fibroblastische reticulaire cellen in lymfeklieren regelen de homeostase van naïeve T-cellen. Nat. Immunol. 8, 1255–1265.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Lukacs-Kornek, V., Malhotra, D., Fletcher, A. L., Acton, S. E., Elpek, K. G., Tayalia, P., Collier, A. R., and Turley, S. J. (2011). Gereguleerde afgifte van stikstofmonoxide door niet-hematopoëtische stroma controleert de uitbreiding van de geactiveerde T-celpool in lymfeklieren. Nat. Immunol. 12, 1096–1104.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Luther, S. A., Tang, H. L., Hyman, P. L., Farr, A. G., and Cyster, J. G. (2000). Coexpressie van de chemokines ELC en SLC door T zone stromale cellen en deletie van het ELC gen in de PLT/plt muis. Proc. Natl. Acad. Sci. U. S. A. 97, 12694-12699.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Luther, S. A., Ansel, K. M., and cyster, J. G. (2003). Overlappende rollen van cxcl13, interleukine 7 receptor α, en ccr7 liganden in lymfeklieren ontwikkeling. J. Exp. Med. 197, 1191–1198.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mackay, C. R. (2001). Chemokines: de hoge impactfactoren van de immunologie. Nat. Immunol. 2, 95–101.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Malhotra, D., Fletcher, A. L., Astarita, J., Lukacs-Kornek, V., Tayalia, P., Gonzalez, S. F., Elpek, K. G., Chang, S. K., Knoblich, K., Hemler, M. E., Brenner, M. B., Carroll, M. C., Mooney, D. J., Turley, S. J., and the Immunological Genome Project Consortium. (2012). Transcriptionele profilering van stroma van ontstoken en rustgevende lymfeklieren definieert immunologische kenmerken. Nat. Immunol. 13, 499–510.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mebius, R. E., Rennert, P., and Weissman, I. L. (1997). Ontwikkelen lymfeklieren verzamelen CD4 + CD3-LTß + cellen die kunnen differentiëren aan APC, NK cellen, en folliculaire cellen, maar niet t of B cellen. Immuniteit 7, 493-504.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mebius, R. E. (2003). Organogenese van lymfoïde weefsels. Nat. Rev. Immunol. 3, 292–303.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Hosiawa-Meagher, K. A., Konieczny, B. T., Sullivan, B. M., Bachmann, M. F., Locksley, R. M., Ahmed, R., and Matloubian, M. (2007a). Regulering van homeostatische chemokine expressie en celhandel tijdens immuunreacties. Wetenschap 317, 670-674.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mueller, S. N., Matloubian, M., Clemens, D. M., Sharpe, A. H., Freeman, G. J., Gangappa, S., Larsen, C. P., and Ahmed, R. (2007b). Virale targeting van fibroblastische reticulaire cellen draagt bij tot immunosuppressie en persistentie tijdens chronische infectie. Proc. Natl. Acad. Sci. U. S. A. 104, 15430-15435.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mueller, S. N., and Germain, R. N. (2009). Stromale cel draagt bij aan de homeostase en functionaliteit van het immuunsysteem. Nat. Rev. Immunol. 9, 618–629.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Müller, G., Höpken, U. E., and Lipp, M. (2003). De impact van CCR7 en CXCR5 op lymfoïde orgaanontwikkeling en systemische immuniteit. Immunol. Rev. 195, 117-135.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nolte, M. A., Beliën, J. A., Schadee-Eestermans, I., Jansen, W., Unger, W. W., Van Rooijen, N., Kraal, G., and Mebius, R. E. (2003). Een geleidingssysteem distribueert chemokines en kleine bloedmoleculen door de miltwitte pulp. J. Exp. Med. 198, 505–512.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Ohl, L., Henning, G., Krautwald, S., Lipp, M., Hardtke, S., Bernhardt, G., Pabst, O., and Förster, R. (2003). Samenwerkende mechanismen van CXCR5 en CCR7 in de ontwikkeling en organisatie van secundaire lymfoïde organen. J. Exp. Med. 197, 1199–1204.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Palframan, R. T., Jung, S., Cheng, G., Weninger, W., Luo, Y., Dorf, M., Littman, D. R., Rollins, B. J., Zweerink, H., Rot, A., and von Andrian, U. H. (2001). Inflammatoire chemokine transport en presentatie in HEV: een afstandsbediening mechanisme voor monocyten werving naar lymfeklieren in ontstoken weefsels. J. Exp. Med. 194, 1361–1373.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Phan, T. G., Green, J. A., Gray, E. E., Xu, Y., and Cyster, J. G. (2009). Immune complex relais door subcapsular sinus macrofagen en noncognate B cellen drijft antilichaamaffiniteit rijping. Nat. Immunol. 10, 786–793.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Roozendaal, R., Mempel, T. R., Pitcher, L. A., Gonzalez, S. F., Verschoor, A., Mebius, R. E., von Andrian, U. H., and Carroll, M. C. (2009). Geleiders bemiddelen transport van laag-moleculair-gewicht antigeen naar lymfeknoop follikels. Immuniteit 30, 264-276.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Roozendaal, R., and Mebius, R. E. (2011). Stromale cel-immuuncel interacties. Annu. Rev. Immunol. 29, 23–43.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Scandella, E., Bolinger, B., Lattmann, E., Miller, S., Favre, S., Littman, D. R., Finke, D., Luther, S. A., Junt, T., and Ludewig, B. (2008). Herstel van lymfoïde orgaanintegriteit door de interactie van lymfoïde weefsel-inducerende cellen met stroma van de T-celzone. Nat. Immunol. 9, 667–675.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Sixt, M., Kanazawa, N., Selg, M., Samson, T., Roos, G., Reinhardt, D. P., Pabst, R., Lutz, M. B., and Sorokin, L. (2005). Het geleidingssysteem transporteert oplosbare antigenen van de afferente lymfe naar resident dendritische cellen in het T-celgebied van de lymfeknoop. Immuniteit 22, 19-29.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Steinman, R. M., Pack, M., and Inaba, K. (1997). Dendritische cellen in de T-celgebieden van lymfoïde organen. Immunol. Rev. 156, 25-37.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
St John, A. L., and Abraham, S. N. (2009). Salmonella verstoort de lymfeknooparchitectuur door TLR4-gemedieerde onderdrukking van homeostatische chemokines. Nat. Med. 15, 1259–1265.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Suzuki, K., Maruya, M., Kawamoto, S., Sitnik, K., Kitamura, H., Agace, W. W., and Fagarasan, S. (2010). Het ontdekken van milieustimuli door folliculaire dendritische cellen bevordert immunoglobulin een generatie in de darm. Immuniteit 33, 71-83.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Szabo, M. C., Butcher, E. C., and McEvoy, L. M. (1997). Specialisatie van mucosale folliculaire dendritische cellen onthuld door mucosale addressine-cel adhesie molecule – 1 display. J. Immunol. 158, 5584–5588.
Pubmed Abstract / Pubmed Full Text
Szakal, A. K., Holmes, K. L., and Tew, J. G. (1983). Transport van immuuncomplexen van de subcapsulaire sinus naar lymfeknoop follikels op het oppervlak van nonfagocytaire cellen, waaronder cellen met dendritische morfologie. J. Immunol. 131, 1714–1727.
Pubmed Abstract/Pubmed Full Text
Taylor, P. R., Martinez-Pomares, L., Stacey, M., Lin, H. H., Brown, G. D., and Gordon, S. (2005). Macrofaag receptoren en immuunherkenning. Annu. Rev. Immunol. 23, 901–944.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Tew, J. G., Wu, J., Qin, D., Helm, S., Burton, G. F., and Szakal, A. K. (1997). Folliculaire dendritische cellen en presentatie van antigeen en costimulerende signalen aan B-cellen. Immunol. Rev. 156, 39-52.
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Tomei, A. A., Siegert, S., Britschgi, M. R., Luther, S. A., and Swartz, M. A. (2009). Fluid flow reguleert stromale cel organisatie en ccl21 expressie in een weefsel-engineered lymfeknoop micro-omgeving. J. Immunol. 183, 4273–4283.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
van de Pavert, S. A., Olivier, B. J., Goverse, G., Vondenhoff, M. F., Greuter, M., Beke, P., Kusser, K., Höpken, U. E., Lipp, M., Niederreither, K., Blomhoff, R., Sitnik, K., Agace, W. W., Randall, T. D., De Jonge, W. J., and Mebius, R. E. (2009). Chemokine CXCL13 is essentieel voor de initiatie van de lymfeklieren en wordt geïnduceerd door retinoïnezuur en neuronale stimulatie. Nat. Immunol. 10, 1193–1199.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Veiga-Fernandes, H., Coles, M. C., Foster, K. E., Patel, A., Williams, A., Natarajan, D., Barlow, A., Pachnis, V., and Kioussis, D. (2007). Tyrosine kinase receptor RET is een belangrijke regulator van Peyer ‘ s flard organogenese. Nature 446, 547-551.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Victoratos, P., Lagnel, J., Tzima, S., Alimzhanov, M. B., Rajewsky, K., Pasparakis, M., and Kollias, G. (2006). FDC-specifieke functies van p55TNFR en IKK2 in de ontwikkeling van FDC-netwerken en van antilichaamresponsen. Immuniteit 24, 65-77.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Zindl, C. L., Kim, T. H., Zeng, M., Archambault, A. S., Grayson, M. H., Choi, K., Schreiber, R. D., and Chaplin, D. D. (2009). De lymfotoxine LTa1ß2 controleert postnatale en volwassen milt marginale sinus vasculaire structuur en functie. Immuniteit 30, 408-420.
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text